Förhöjd nivå av follikelstimulerande hormon (FSH) i serum och amenorré hos en kvinna under 40 år är tecken på prematur ovariell insufficiens (POI).
POI kan orsakas av kirurgi, strålning och cytostatika samt autoimmun sjukdom och genetiska faktorer.
Det finns i dag goda möjligheter att hitta en bakomliggande orsak, varför patienter bör erbjudas utredning.
Patienter med POI behöver adekvat östrogensubstitution för att minska risken för benskörhet samt kardiovaskulära och kognitiva komplikationer.
Substitutionsbehandlingen bör fortgå till minst normal menopausålder, det vill säga omkring 51 års ålder.
Det är viktigt att informera om att en viss kvarstående fertilitet kan finnas hos patienter med sekundär amenorré och POI.
Amenorré hos en kvinna i fertil ålder (15–40 år) kan i vissa fall orsakas av prematur ovariell insufficiens (POI). Den synonyma beteckningen primär ovariell insufficiens används också. POI har tidigare kallats POF (premature ovarian failure) eller förtida klimakterium. POI kan debutera antingen med primär amenorré, när menarke inte inträffar, eller med sekundär amenorré, en förlust av blödning efter tidigare menstruationer. Vid primär amenorré ses oftast en utebliven eller ofullständig pubertetsutveckling, medan POI med sekundär amenorré kan ge bortfallssymtom såsom värmevallningar, sömnstörningar, stresskänslighet och besvär av atrofiska slemhinnor.
POI definieras som amenorré (under minst 3 månader) i kombination med upprepat förhöjt serumvärde av follikelstimulerande hormon (FSH) > 40 IE/l hos en kvinna före 40 års ålder [1]. Förhöjda FSH-värden tillsammans med låga östrogennivåer kallas hypergonadotrop hypogonadism och beror på att ovariet inte svarar korrekt på hypofysens signalering och cyklisk follikeltillväxt uteblir (Fakta 1).
Vid POI saknas folliklar helt, eller så utvecklas inte folliklarna normalt. Folliklar kan saknas på grund av ett för litet antal ursprungliga könsceller eller på grund av en accelererad follikelförlust. Sjukdomstillstånd och/eller behandling som orsakar förlust eller störd reglering av follikelväxt kan därför leda till POI. Några exempel på detta är autoimmun sjukdom, metabola rubbningar, strålbehandling, kemoterapi och kirurgi.
Även om tillståndet är mycket ovanligt i unga år ökar prevalensen av POI med stigande ålder och beräknas till 1 per 1 000 före 30 års ålder och 1–2 per 100 före 40 års ålder [1]. I en färsk svensk populationsbaserad registerstudie uppskattades den totala prevalensen av POI (spontan och iatrogen) till 1,9 procent [2]. Medianåldern för naturlig menopaus är ca 51 år i Sverige, med en naturlig variation mellan 40 och 60 år [3], där menopaus mellan 40 och 45 år räknas som tidig och inträffar hos ca 5 procent av kvinnorna [4]. Att drabbas av POI före 30 års ålder kan alltså innebära att normala kvinnliga östrogennivåer förloras mer än 20 år tidigare än förväntat.
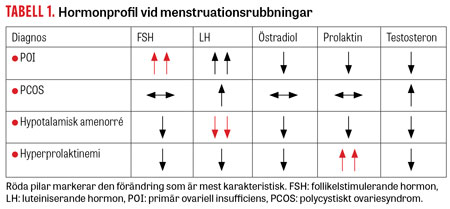
Menstruationsrubbningar kan orsakas av många olika underliggande tillstånd såsom stor viktförändring, nydebuterad diabetes och graviditet, men de vanligaste orsakerna till sekundär amenorré är polycystiskt ovariesyndrom (PCOS), hyperprolaktinemi, hypotalamisk amenorré och POI. Hormonprofilen vid provtagning är dock helt olika vid dessa tillstånd (Tabell 1).
Diagnos
Patienter som söker vård på grund av primär eller sekundär amenorré ska alltid genomgå en utredning för diagnostik av eventuella underliggande och potentiellt behandlingsbara tillstånd. Anamnes kring blödningsmönster, symtom, andra sjukdomar, läkemedelsbehandling, kost- och motionsvanor samt ärftlighet bör gås igenom, och en klinisk gynekologisk undersökning inklusive ultraljudsbedömning av uterus och ovarier ska göras. Den basala provtagningen vid både primär och sekundär amenorré utgörs av en kartläggning av hormonellt status. Initial provtagning bör omfatta FSH, luteiniserande hormon (LH), tyreoideastimulerande hormon (TSH), fritt tyroxin (T4), prolaktin och eventuellt östradiol med känslig metod.
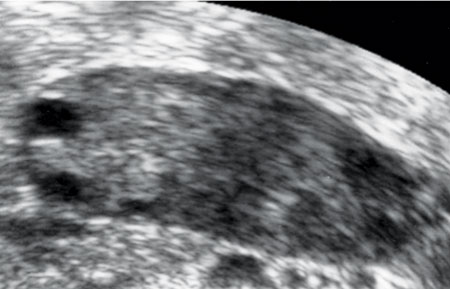
Vid primär amenorré är det viktigt att kartlägga förekomsten av inre kvinnliga genitalia. Unga flickor som inte debuterat sexuellt måste inte undersökas gynekologiskt vid första besöket, och i dessa fall kan man överväga att ultraljud utförs abdominellt av en erfaren undersökare. MR-undersökningar är också ett alternativ. Vid POI har kvinnorna en normalstor eller liten uterus. Ovarier utan folliklar kan vara svåra att visualisera med ultraljud, beroende på undersökarens vana och patientens konstitution (Figur 1). En del patienter har små synliga folliklar och ultraljudsbilden kan variera mellan patienter och undersökningstillfällen. Avsaknad av livmoder kan bero på androgenokänslighetssyndrom eller annan könsutvecklingsrubbning, även kallad DSD (disorders of sex development).
Utredning av bakomliggande orsak
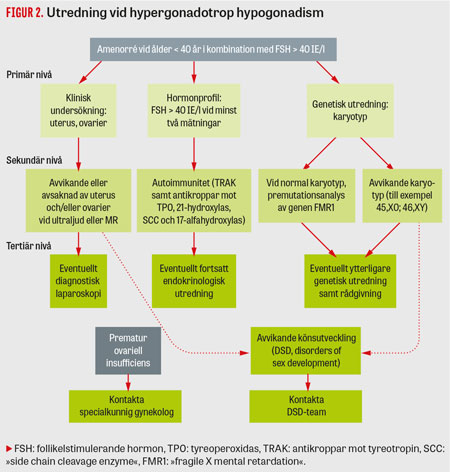
Figur 2 visar en översikt av utredningsgången som initialt kan göras i gynekologisk öppenvård (primär nivå), därefter av gynekolog med specialkunskap i gynekologisk endokrinologi (sekundär nivå) och slutligen vid nationella specialistcentrum med tillgång till endokrinologisk, gynekologisk, kirurgisk och genetisk kompetens i ett DSD-team (tertiär nivå). Anamnesen kan oftast avslöja eventuell sekundär POI efter kirurgi, cytostatikabehandling eller strålning. Den kliniska undersökningen kan i många fall direkt leda till misstanke om en specifik diagnos, till exempel Turners syndrom. I de fallen bör utredningen fokusera direkt på den misstänkta diagnosen, inklusive genetisk diagnostik och rådgivning. I samtliga fall är det viktigt att bekräfta tillståndet hypergonadotrop hypogonadism med upprepad provtagning av FSH samt utesluta avvikelser/avsaknad av uterus och ovarier. Vid normala fynd fortsätter utredningen med undersökning för autoimmunitet och genetiska avvikelser.
Autoimmunitet. Vid misstänkt POI utan säker etiologi bör patienten utredas för autoimmuna tillstånd. Tyreoideasjukdomar påverkar ofta äggstockens funktion hos kvinnor, och kvinnor med POI har en ökad förekomst av autoantikroppar mot tyreoperoxidas (TPO) [5]. POI är vanligt förekommande även vid Addisons sjukdom och typ 1-diabetes samt flera andra autoimmuna tillstånd [6]. Upp till 10 procent av patienter med POI har en autoimmun ooforit som orsak [7]. Provtagning bör omfatta analys av autoantikroppar mot tyreoidea (TPO och tyreotropin), binjurebark (21-hydroxylas/CYP21A2) och gonader (»side chain cleavage enzyme«/CYP11A1 och 17-alfahydroxylas/CYP17A1) [6]. En del av dessa analyser utförs enbart vid specialiserade laboratorier i Sverige. Ett avvikande resultat bör värderas utifrån möjlig kausalitet eller associerat tillstånd som kan behöva föranleda utökad utredning.
Genetisk utredning. En genetisk utredning med kromosomanalys ska alltid utföras vid hypergonadotrop hypogonadism. Observera att primär amenorré utan hypergonadotrop hypogonadism inte behöver utredas med kromosomanalys, då orsaken i de fallen ligger utanför ovariet.
Det vanligaste genetiska fyndet är Turners syndrom, komplett (45,X0) eller mosaikform (45,X0/46,XX eller 45,X0/46,XY). De näst vanligaste kromosomavvikelserna vid POI är kromosomala rearrangemang såsom translokationer och deletioner, främst av delar av X-kromosomen. Balanserade autosomala translokationer kan vara ett normalt bifynd, men en del bedöms vara sjukdomsorsakande på grund av trolig påverkan på gener vid brottpunkterna eller störd meios. Vidare genetisk diagnostik bör i så fall utföras. Vid primär amenorré kan kromosomanalys visa en manlig karyotyp (46,XY); tillståndet kallas gonaddysgenesi (46,XY GD), en form av DSD.
Alla patienter med normal kvinnlig karyotyp och balanserade kromosomavvikelser, som inte säkert förklarar den kliniska bilden, bör erbjudas utvidgad genetisk diagnostik för att utesluta monogena orsaker till POI.
Patienter med POI och sekundär amenorré bör utredas för förekomsten av så kallad FMR1-premutation, en ökning av antalet CGG-repetitioner (55–200) i den icke translaterade delen av FMR1-genen. Över 200 repetitioner kallas för fullmutation och orsakar sjukdomen fragil X-syndrom. Mellan 2 och 11 procent av alla fall av POI orsakas av FMR1-premutation, och kvinnliga premutationsbärare har 20 procents risk att drabbas av POI [8]. Premutationsbärare löper risk att få barn med fragil X-syndrom och familjemedlemmar kan bära samma premutation, varför genetisk rådgivning vid ett postivt fynd är viktigt även för nära släktingar.
Med hjälp av ny genteknik som baseras på massiv parallell sekvensering kan många sjukdomsgener analyseras för både små gendosavvikelser och sekvensvarianter i en analys. Eftersom antalet identifierade möjliga sjukdomsorsakade gener vid POI är stort och ökande har denna diagnostik ett stort värde för patienter som utreds för POI. Gener som bör ingå vid genetisk diagnostik av POI finns beskrivna i Genomics England PanelApp [9] som uppdateras utifrån aktuell kunskap. Några exempel på kända sjukdomsorsakande gener är BMP15, GDF9, FIGLA, NOBOX och FSHR (receptorn för FSH) [9]. En genetisk diagnos är av vikt för den enskilda patienten som önskar en förklaring till sin sjukdom men även för familjen, då anlagsbärartestning kan identifiera ytterligare familjemedlemmar som kan drabbas eller riskera att få drabbade barn.
Patienter med kromosomavvikelser och andra genetiska fynd bör alltid erbjudas remiss till avdelning för klinisk genetik för information och rådgivning (tertiär nivå) och bör skötas av gynekolog/endokrinolog med god kunskap om DSD och i samarbete med ett DSD-team. I Sverige finns fyra DSD-team som kan vara behjälpliga med diagnostik och behandling. Teamen finns vid Akademiska sjukhuset (Uppsala), Karolinska universitetssjukhuset (Stockholm), Sahlgrenska universitetssjukhuset (Göteborg) och Skånes universitetssjukhus (Malmö/Lund).
Substitutionsbehandling
Hos unga flickor med POI och primär amenorré kan en successiv upptrappning av transdermalt östrogen först användas för att inducera pubertet. Efter första menstruationsblödningen används därefter ett tillägg med cykliskt gestagen för att skapa ett regelbundet blödningsmönster. Cyklicitet kan åstadkommas med sedvanlig menopausal hormonbehandling eller med kombinerade p-piller, där det senare också kan vara mer tilltalande för de yngre patienterna. Menopausal hormonbehandling ger inte skydd mot graviditet, vilket bör beaktas hos de patienter som inte önskar bli gravida och som kan antas ha en möjlig fluktuerande ovariefunktion. Oavsett behandlingsval behöver östrogendosen vara tillräcklig: 17-beta-östradiol oralt 2 mg eller transdermalt 1,5 mg i gel eller 100 µg/24 timmar i plåster. P-piller innebär översubstitution, vilket dock inte är problematiskt om riskfaktorer för tromboembolism har uteslutits. En tidigare venös trombos utgör inte någon absolut kontraindikation när en avvägning mellan risk och nytta bedöms som övervägande positiv för östrogenbehandling. Transdermal behandling med östradiol (inte etinylöstradiol som i p-plåster) bör dock väljas för dessa patienter, då denna administrationsform inte är associerad med ökad risk för trombos [10] (Fakta 2).
Enligt både nationella (Svensk förening för obstetrik och gynekologi) och internationella riktlinjer rekommenderas östrogensubstitution vid POI upp till minst normal menopausålder (ca 51 år) oavsett hur länge man har behandlats [1, 11, 12]. Trots detta finns vetenskapliga belägg för en klar underbehandling i Sverige [13, 14]. Kvinnor med POI utan hormonsubstitution har en flerfaldigt ökad risk för osteoporos och frakturer [15]. Även hjärt–kärlsystemet är beroende av östrogen, och kvinnor med POI utan behandling löper en ökad risk för hjärt–kärlsjukdom och har ökad mortalitet i hjärt–kärlsjukdom [16, 17]. Menopausal hormonbehandling motverkar denna riskökning [18], så de hjärt–kärlrisker som beskrivits med menopausal hormonbehandling i framför allt den stora amerikanska studien Women’s Health Initiative (WHI) [19] gäller inte för patienter med POI. WHI-studien omfattar kvinnor med en genomsnittsålder på 63 år. Den relativt höga åldern vid påbörjad hormonbehandling anses förklara fyndet av ökad risk för hjärt–kärlsjukdom i denna studie.
Det finns även rapporter om att POI kan öka risken för nedsatt kognitiv funktion och demens [4, 20] medan menopausal hormonbehandling minskar denna risk i denna patientgrupp, vilket ytterligare talar för användandet av östrogenbehandling. Risken för bröstcancer är minskad vid POI [21], och långvarig menopausal hormonbehandling hos kvinnor med POI ger inte någon ökad risk för bröstcancer jämfört med friska jämnåriga kvinnor [22], vilket är mycket viktigt att förmedla till patienten. Förutsatt att andra riskfaktorer saknas behöver kvinnor med POI inte starta mammografiscreening tidigare än enligt de allmänna riktlinjerna. Hereditet för bröstcancer är inte en kontraindikation för östrogenbehandling vid POI.
Fertilitet
Fertilitetsprognosen är generellt dålig vid POI, men spontan graviditet vid sekundär amenorré har rapporterats i 5–10 procent av fallen [23]. Spontan graviditet har dock inte rapporterats hos kvinnor med POI och primär amenorré. Ovarialreserven kan bedömas med serumnivåer av FSH och anti-müllerskt hormon (AMH) samt genom mätning av antalet antralfolliklar i äggstockarna. Vid klart förhöjda FSH-nivåer och lågt AMH är ägglossningsstimulering sällan meningsfull. Forskning pågår dock för att utveckla fertilitetsbefrämjande åtgärder även för denna patientgrupp. I dagsläget kan patienter med POI och normal uterus erbjudas äggdonation i Sverige.
Uppföljning
Patienter med POI bör följas regelbundet avseende allmänt hälsotillstånd, hormonprofil och benmassa för att optimera substitutionsbehandlingen. Det är en utmaning för alla doktorer som möter kvinnor med POI att stödja och motivera användning av östrogen.
Kvinnor med POI har ofta ett stort behov av psykologiskt stöd i samband med diagnosen, och även senare i livet, beroende på traumat av oväntad tidig infertilitet samt eventuellt förändrad syn på sin kvinnlighet och sexualitet. Det är därför viktigt att patienterna har en stabil kontakt med en erfaren och endokrinologiskt kunnig gynekolog som vid behov kan remittera vidare till psykolog/kurator. Vi rekommenderar att patienter med POI sköts i samråd med specialiserad kollega på regional nivå med ett integrerat omhändertagande av kvinnan [24].
Det finns stor kompetens att tillgå inom de regionala DSD-teamen, som kan erbjuda stöd och råd om handläggning. Pågående studier vid Karolinska institutet försöker bland annat identifiera nya gener av betydelse för äggstockens utveckling och funktion. Med dagens genteknik kan vi snabbt och effektivt identifiera mycket små gendos- och sekvensförändringar i arvsmassan med målet att sådan kunskap kommer att komma patienterna till godo.
Läs även:
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Ameli Norlings bidrag till artikeln har skett inom ramen för forskning vid Karolinska institutet och representerar inte Hälso- och sjukvårdsförvaltningens ställningstagande kring patientgruppen.
Fakta 1. Diagnostiska kriterier vid prematur ovariell insufficiens (POI)
Klinisk bild
Minst 3 månaders sekundär amenorré. Utebliven menstruation i övre tonåren vid primär amenorré.
Ålder
Yngre än 40 år
Follikelstimulerande hormon (FSH)
Upprepade värden över 40 IE/l med minst en månads mellanrum mellan provtagningarna.
Fakta 2. Hormonersättning vid prematur ovariell insufficiens (POI)
- Hormonell substitution upp till minst normal klimakterieålder rekommenderas.
- Östrogensubstitution ska ges i motsvarande standarddos och inte i lågdos.
- Gestagentillägg vid kvarvarande uterus kan ges som vid sedvanlig klimakteriebehandling.
- Transdermalt östrogen (plåster, gel, sprej) rekommenderas vid ökad trombosrisk.
- Östrogenbehandling till kvinnor med POI ökar inte risken för bröstcancer.
Dosrekommendationer
- Östrogen i minimidos 17-beta-östradiol 2 mg oralt dagligen (Femanest, Progynon) eller 1–1,5 mg transdermal gel dagligen (Divigel) eller plåster 75–100 µg/24 timmar (Estradot) tillsammans med syntetiskt progesteron i cyklisk behandling (Provera), 12 tabletter per månad alternativt 14 tabletter var tredje månad, eller i intrauterint inlägg (Mirena). Alternativ: Kombinerade p-piller
- Kombinerad menopausal hormonbehandling: Cyklisk behandling (Femasekvens, Divina plus, Trivina) eller kontinuerlig behandling (Indivina).
(uppdaterad 2023-02-15)