Lungtransplantation har pågått sedan 1990 vid två nationella centrum i Sverige: Lund och Göteborg.
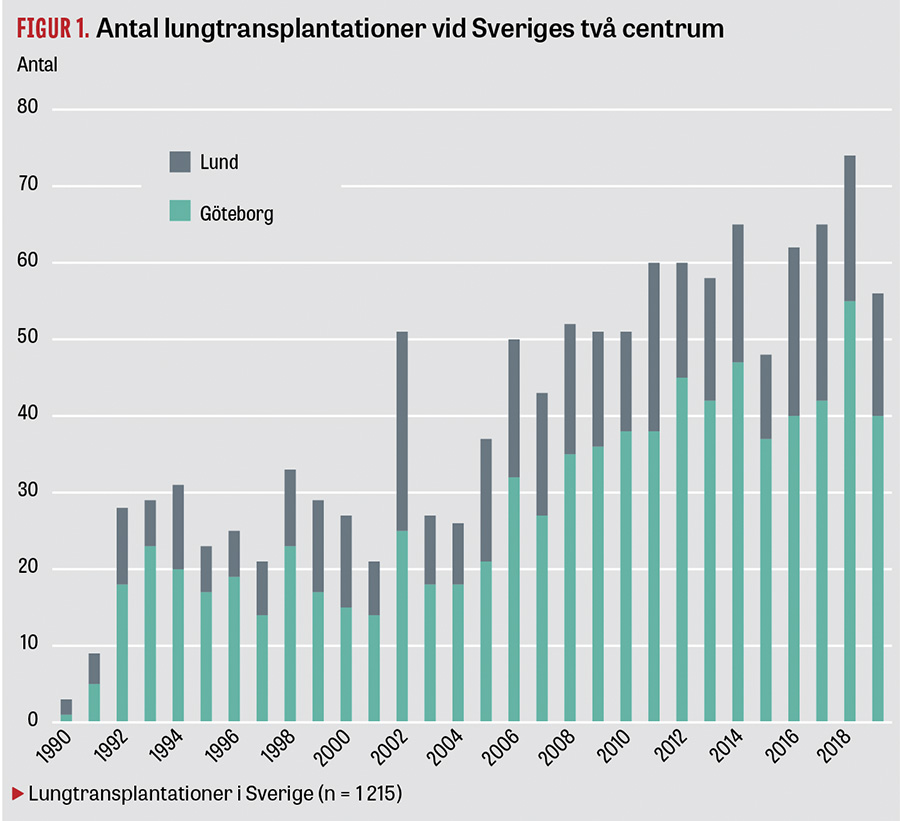
Totalt 1 215 patienter har transplanterats, och antalet är i stigande. Numera görs huvudsakligen dubbel lungtransplantation.
Patienter med svår lungsjukdom i slutstadiet, men som inte är för medtagna i övrigt, är tänkbara kandidater.
På senare år har indikationerna vidgats, och man har transplanterat patienter > 65 års ålder samt patienter från ECMO.
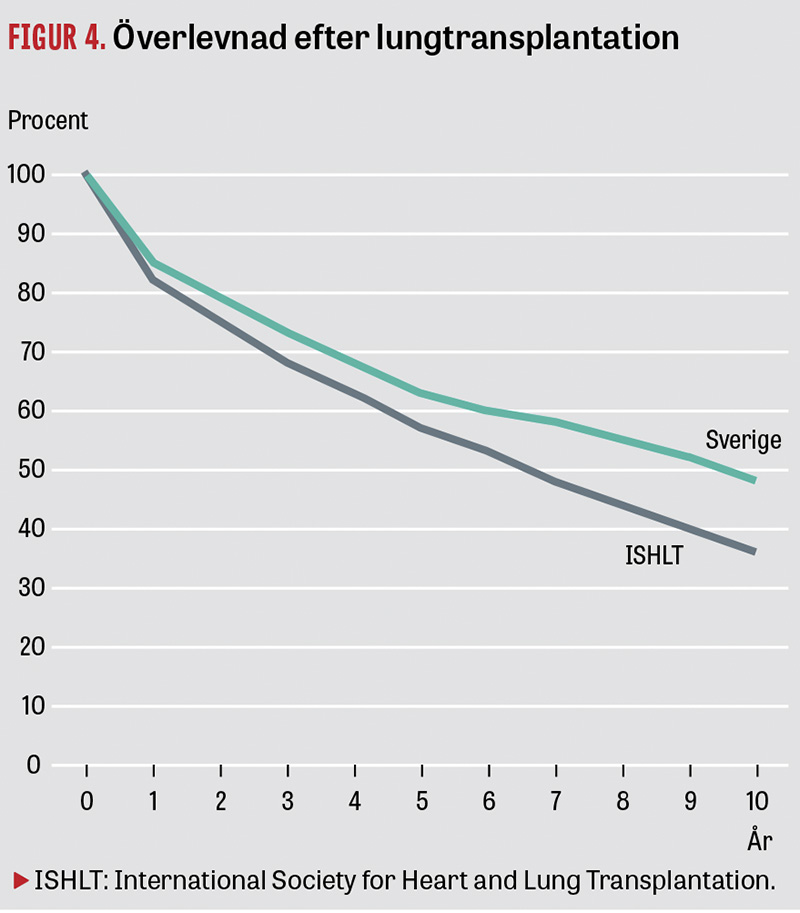
5-årsöverlevnaden är 63 procent och 10-årsöverlevnaden 48 procent, vilket är mycket bra jämfört med internationella resultat.
Bakgrund. Lungtransplantation är numera en accepterad behandling för lungsjukdomar i slutskedet där andra terapeutiska möjligheter är uttömda. I Sverige startade verksamheten 1990 med den första enkellungtransplantationen i Lund och senare samma år den första hjärt–lungtransplantationen i Göteborg. Sedan dess har verksamheten fortsatt vid Sahlgrenska universitetssjukhuset och Skånes universitetssjukhus, vilka delar på uppdraget nationell högspecialiserad vård för lungtransplantation. Man har fram till årsskiftet 2019/2020 transplanterat totalt 1 215 patienter (Figur 1).
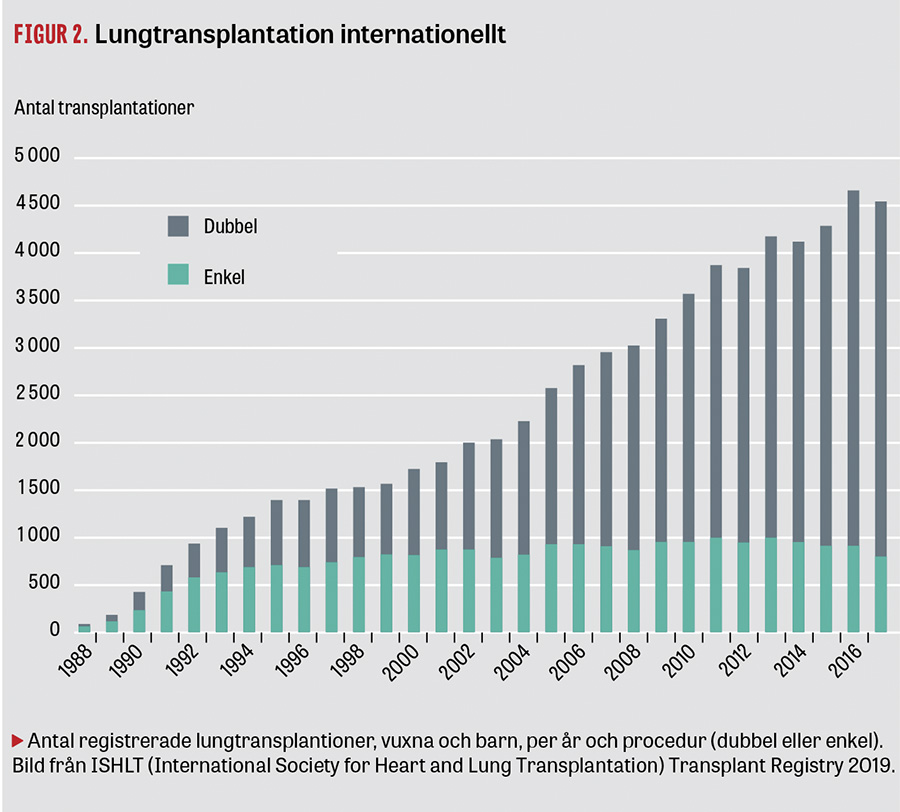
Internationellt görs årligen cirka 4 500 lungtransplantationer, fördelade på ett 260-tal centrum, huvudsakligen belägna i den industrialiserade delen av världen. Ett femtiotal högvolymscentrum gör > 30/år, och dessa står för nästan 40 procent av alla lungtransplantationer [1]. Verksamheten har successivt ökat genom åren, och det gäller främst dubbel lungtransplantation, vilket har visat sig ge bäst långtidsöverlevnad (Figur 2). Enkel lungtransplantation görs fortfarande men brukar reserveras för retransplantation eller äldre mottagare där man vill minimera det kirurgiska traumat.
Den immunsuppressiva behandlingen baseras på tre läkemedelgrupper; steroider, tillväxthämmare och kalcineurinhämmare (ciklosporin eller takrolimus). Upptäckten av ciklosporin på det sena 70-talet var det som revolutionerade transplantationer av solida organ och möjliggjorde bland annat lungtransplantation med acceptabla överlevnadsresultat. Av största vikt för långtidsöverlevnaden är att patienten klarar av total följsamhet till sin immunsuppressiva behandling och inte gör avsteg från denna [2].
Indikationer
Huvudindikationen är svår progredierande lungsjukdom med förväntad överlevnad kortare än två år eller med invalidiserande påverkan på livskvalitet och dagligt liv. International Society for Heart and Lung Transplantation (ISHLT) har utarbetat riktlinjer för valet av lämpliga kandidater för lungtransplantation [3]. Dessa utgör ett bra grundstöd men måste anpassas till lokala förhållanden och individuell bedömning av varje patient. Patienten måste vara allvarligt lungsjuk men samtidigt i så gott allmäntillstånd att hon eller han har en rimlig möjlighet att överleva väntetiden och transplantationen. En sängbunden eller immobiliserad patient i till exempel rullstol är därför sällan en realistisk kandidat. Patienten måste också kunna medverka till livslång immunsuppressiv medicinering och vara helt motiverad till en transplantation. Det är därför viktigt att tidigt informera patienten om att vinsterna med en lungtransplantation kan vara bättre livskvalitet och lungfunktion, men att det också finns risker med ingreppet och att långtidsresultatet är svårt att förutse.
Kontraindikationer
De viktigaste absoluta kontraindikationerna [3]:
- Nedsatt njurfunktion med glomerulär filtration < 50 ml/minut.
- Malignitet senaste 5 åren, med undantag för basaliom eller skivepitalcancer i huden (2 år).
- Svår annan samtidig åkomma såsom icke åtgärdbar kardiovaskulär sjukdom, leversvikt, hjärtsvikt eller neurologisk sjukdom.
- Svår osteoporos med kotkompressioner eller annan uttalad toraxdeformitet.
- Oförmåga att följa medicinering eller kontroller.
- Svår psykisk sjukdom eller missbruk.
Operation
Numera görs lungtransplantation oftast via bilaterala sekventiella torakotomier, vilket ställer stora krav på anestesiologerna då det gäller att hålla patienten stabil under tiden när ena sidans lunga tas ut och den nya sys in. I svåra fall får man ta hjälp av hjärt–lungmaskin eller extrakorporeal membranoxygenering (ECMO) för att syresätta och cirkulera patienten under operationen. De flesta patienterna extuberas inom 1–2 dygn och kan skrivas ut från intensiven efter 2–5 dygn.
Det finns i dag en möjlighet att transplantera direkt från en ECMO-behandling, men det är förbehållet yngre patienter med ett akut insjuknande som i övrigt är stabila, vakna och träningsbara under ECMO-vården och inte har annan samsjuklighet [4]. Möjlighet finns att gå ut med vädjan till organfördelningsorganisationen Scandiatransplant för att snabbt kunna erhålla lämpliga organ i dessa fall [5].
Resultat
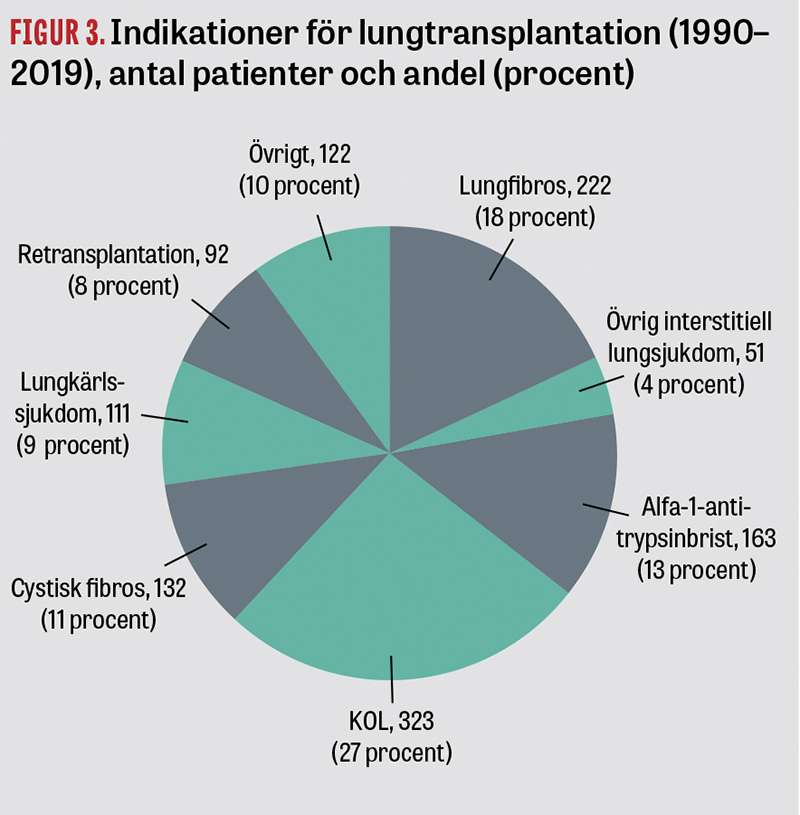
Sedan starten 1990 har huvudindikationerna för lungtransplantation i Sverige fördelat sig enligt nedan (Figur 3):
- Kroniskt obstruktiv lungsjukdom (KOL/emfysem och alfa-1-antitrypsinbrist), 40 procent.
- Restriktiv lungsjukdom (lungfibros samt övrig interstitiell lungsjukdom), 22 procent.
- Cystisk fibros, 11 procent.
- Lungkärlssjukdom (primär eller sekundär pulmonell hypertension), 9 procent.
- Retransplantation (vanligast pga kronisk rejektion i form av obliterativ bronkiolit), 8 procent.
- Övriga, 10 procent.
Medianväntetiden på väntelistan är 54 dagar (spridning 1–580 dagar), och dödlighet på väntelistan numera låg, 7 procent. Medelvårdtiden efter lungtransplantation ligger på 3 veckor, men är i enstaka svåra fall klart längre.
Långtidsöverlevnaden i Sverige och även hos våra motsvarande skandinaviska centrum ligger bra till jämfört med internationella siffror, med en 5-årsöverlevnad på 63 procent (ISHLT 57 procent) samt 10-årsöverlevnad på 48 procent (ISHLT 36 procent, Figur 4).
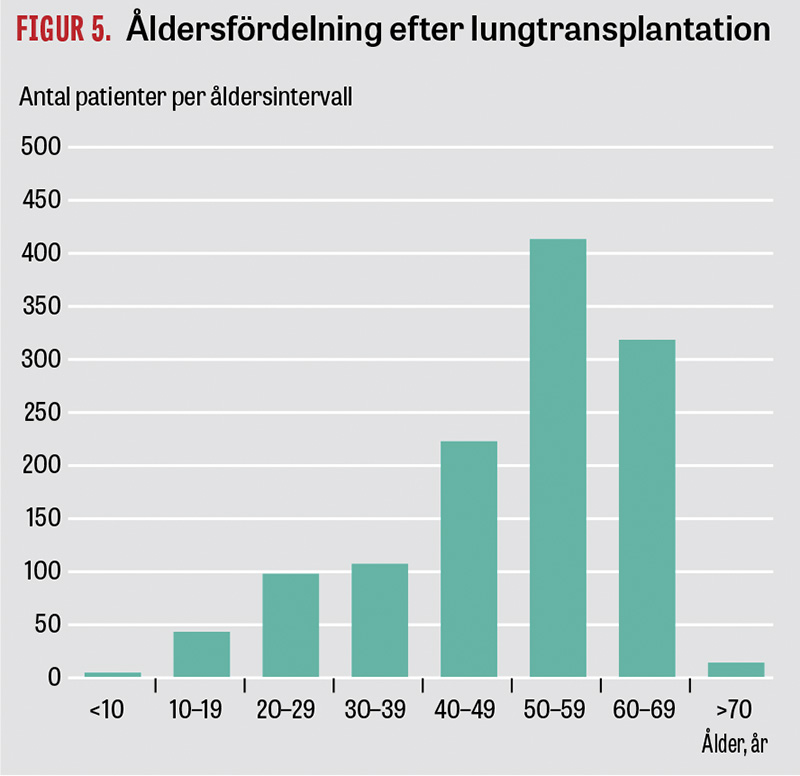
Åldersfördelningen av mottagarna framgår av figur 5.
Komplikationer
Tidigt postoperativt kan reperfusionssyndrom uppstå, sannolikt orsakat av en övergående alveolär skada efter urtagning, nedkylning och transport av organet. Det kan med viss effekt behandlas med steroider, men en ökad risk för framtida lungfunktionsförsämring och sämre långtidsprognos finns associerad med detta.
Akut rejektion eller avstötning uppträder vanligast inom det första postoperativa halvåret, och den viktigaste tidiga kliniska signalen är successivt försämrad lungfunktion i form av sjunkande FEV1. Majoriteten av patienterna drabbas av åtminstone en episod med akut rejektion, men högdos steroidbehandling brukar ge effekt och återställa lungfunktionen.
Infektioner kan vara ett problem under det första postoperativa året, där vanligen bakteriella infektioner debuterar tidigt, medan svamp och virus inträffar något senare [6]. Profylax mot Pneumocystis jiroveci samt cytomegalovirus ges som rutin efter lungtransplantation.
Sena komplikationer efter första året domineras av kronisk rejektion, njurinsufficiens eller malignitet; de sista två är oftast en följd av immunsuppressionen. Kronisk rejektion utvecklas med tiden hos flertalet långtidsöverlevande patienter, och efter 10 år har minst hälften av de som då lever drabbats. Kronisk rejektion förekommer i två varianter, antingen som en obstruktiv lungfunktionsnedsättning orsakad av inflammation i perifera små luftvägar, dvs bronkiolit, eller som en restriktiv fibrotiserande lungvävnadsskada i transplantatet. Den sistnämnda kan progrediera hastigt och har en dålig prognos.
Tidig diagnos och behandling av rejektion eller infektion är av största vikt för att minska risken att senare utveckla kronisk rejektion, och patienter följs därför med täta kontroller på lungtransplantationscentrumet under första året. Därefter brukar det räcka med årliga kontroller, med samtidigt minst halvårsvis uppföljning på hemortens lungmottagningar.
Utveckling
Under de gångna tre decenniernas lungtransplantationsverksamhet har vi kunnat se patientpanoramat ändra sig. Sekundär pulmonell hypertension är numera ovanlig, då rekonstruktiv hjärtkirurgi tidigt i livet hos patienten förhindrar utveckling av pulmonell hypertension och därmed behov av lungtransplantation. Effektiv läkemedelsbehandling av primär pulmonell hypertension har kunnat minska denna mottagargrupp. Patienter med cystisk fibros blir numera aktuella för lungtransplantation senare i livet på grund av effektivare medicinska åtgärder, men antalet som behöver transplanteras minskar inte. Andelen patienter med lungfibros har fördubblats jämfört med för 10 år sedan, då ingen effektiv terapi ännu utvecklats, och medvetenheten i läkarkollegiet om att tidigt remittera för lungtransplantation har blivit bättre. Nya diagnoser som sklerodermi, SLE och transplantat kontra värd-sjukdom efter stamcellstransplantation har tillkommit de senaste tio åren, och andelen retransplantationer har också ökat.
Andelen dödsfall på väntelistan har förbättrats påtagligt, med en minskning från 21 procent år 2000 till 7 procent 2019. Överlevnaden efter lungtransplantation har däremot inte förändrats påtagligt sedan starten 1990, men det kan delvis bero på att allt fler äldre och mer marginella mottagare accepteras. De tidigare absoluta åldersgränserna försvann i slutet på 90-talet efter Socialstyrelsens beslut mot åldersdiskriminering, och i dag utreds varje mottagare utifrån sina biologiska förutsättningar att dra nytta av lungtransplantation. Fler svårt sjuka patienter till exempel i ECMO accepteras i dag för lungtransplantation.
Problemen med akut rejektion har blivit mindre, men långtidsproblemet med kronisk rejektion kvarstår, trots utveckling av nya immunsuppressiva medel, och är den främsta orsaken till retransplantation.
Ex vivo-lungperfusion (EVLP) har använts i ett 30-tal fall i Sverige i syfte att öka organtillgången. EVLP innebär att lunggraft som annars skulle ha kasserats på grund av dålig funktion, ofta ödem eller atelektaser, rekonditioneras i en extern enhet som perfunderar och ventilerar organet. Om man inom fyra timmar uppnår acceptabel funktion går man sedan vidare till lungtransplantation. Uppföljning > 2 år av EVLP-patienter har visat lika bra långtidsresultat som vid konventionell lungtransplantation [7].
Viktig forskning på senare år har visat att patienternas problem med följsamhet till immunsuppressiv medicinering kan vara lika bristfällig efter lungtransplantation som vid andra åkommor och att detta är direkt kopplat till långtidsöverlevnaden [8]. Resultaten har fått klinisk tillämpning vid uppföljningen efter lungtransplantation, där både extra sköterskebesök, frågeformulär och uppföljande kontaktverksamhet i tillägg till läkarbesök syftar till att säkerställa att den livsviktiga och kroniska medicineringen följs.
Framtid
Det troliga är att antalet lungtransplantationer kommer fortsätta att öka, kanske i något långsammare takt än de senaste åren. Fler patienter med lungfibros kommer sannolikt att bli aktuella när verkan av de nya bromsmedicinerna upphör, och även nya patientkategorier kan förutspås, till exempel prematurt födda barn som utvecklat bronkopulmonell dysplasi. Bättre immunsuppressiva regimer för äldre patienter med lägre doser kommer sannolikt vara gynnsamma för överlevnaden, och förhoppningsvis kommer även bättre terapi än dagens att utvecklas mot kronisk avstötning.
Lungtransplantation har sedan starten 1990 funnit sin plats som en etablerad terapi för en del patienter med livshotande lungsjukdom och kommer att fortsätta att utvecklas och förbättras i framtiden. Ett tecken på detta är det nyligen påbörjade nationella projektet att använda organ från donatorer efter hjärtdöd (DCD, donation after cardiac death) i syfte att öka organtillgången.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2020-09-24)