Patienter med akut hjärnskada löper 50 procents risk för epileptiska anfall. Kontinuerlig EEG (cEEG) har föreslagits för säkrare diagnostik, men evidensläget är oklart.
I en litteraturgenomgång identifierades 16 observationsstudier med 943 intensivvårdade hjärnskadepatienter observerade med cEEG, men med olika uppställning och resultatredovisning.
Evidensgraden för cEEG för påvisande av epileptisk aktivitet är låg, och korrelationen med mortalitet är inte bedömbar. Störd sömnaktivitet på cEEG synes ha viss korrelation med neurologiskt utfall, men med oklar terapeutisk implikation.
Ytterligare prospektiva studier med standardiserad utformning och rapportering krävs för att värdera cEEG:s potential.
Patienter som intensivvårdas på grund av ischemisk stroke, spontan hjärnblödning eller traumatisk hjärnskada löper speciellt ökad risk att drabbas av såväl konvulsiva som icke-konvulsiva epileptiska anfall [1-3]. Då icke-konvulsiva anfall inte är kliniskt uppenbara på samma sätt som konvulsiva epileptiska anfall riskerar de att förbli oupptäckta och obehandlade [4]. Även anfall som ännu inte är märkbara vid klinisk undersökning av patienten kan ha negativa konsekvenser med ökad mortalitet och försämrat neurologiskt utfall [5]. Många patienter inom intensivvården är dessutom nedsövda och i vissa fall muskelrelaxerade, vilket ytterligare försvårar den kliniska bedömningen av epileptisk aktivitet.
Ett potentiellt sätt att upptäcka dessa kliniskt svårfångade epileptiska anfall är att övervaka skallskadepatienter med kontinuerlig elektroencefalografi (cEEG). Fördelen är att man får en omedelbar bild av patientens EEG-aktivitet. Det har föreslagits att cEEG kan användas för att prognostisera hjärnskadepatienters överlevnad och neurologiska utfall [4].
Övervakning med cEEG kräver en inarbetad rutin och klara riktlinjer för hur undersökningsresultaten ska tolkas,inte minst med tanke på att olika utrustning, programvara och antal elektroder kan användas. Det finns en risk för feltolkning, särskilt om det är intensivvårdsläkaren som ska tolka resultatet [6, 7]. Studier visar att kunskaperna i EEG-tolkning hos andra än neurofysiologiskt utbildade läkare är dåliga, och sannolikt behövs en stor utbildningsinsats för att lära intensivvårdsläkare att tolka EEG [8]. Icke desto mindre rekommenderar den amerikanska föreningen för klinisk neurofysiologi att cEEG-övervakning används för att upptäcka icke-konvulsiva krampanfall hos intensivvårdade patienter med akuta supratentoriella hjärnskador i kombination med förändrat mentalt status [9]. Detta väcker frågor om hur eventuell cEEG-övervakning praktiskt ska utföras och vem som ska ansvara för tolkningen i en svensk intensivvårdsmiljö som inte är specialiserad på hjärnskadade patienter.
Denna litteraturgenomgång syftar till att värdera evidensläget för cEEG-övervakning avseende att upptäcka epileptiska anfall, prognostisera 30-dagarsmortalitet och prognostisera definierat neurologiskt utfall hos vuxna patienter som intensivvårdas för definierade hjärnskador.
Material och metoder
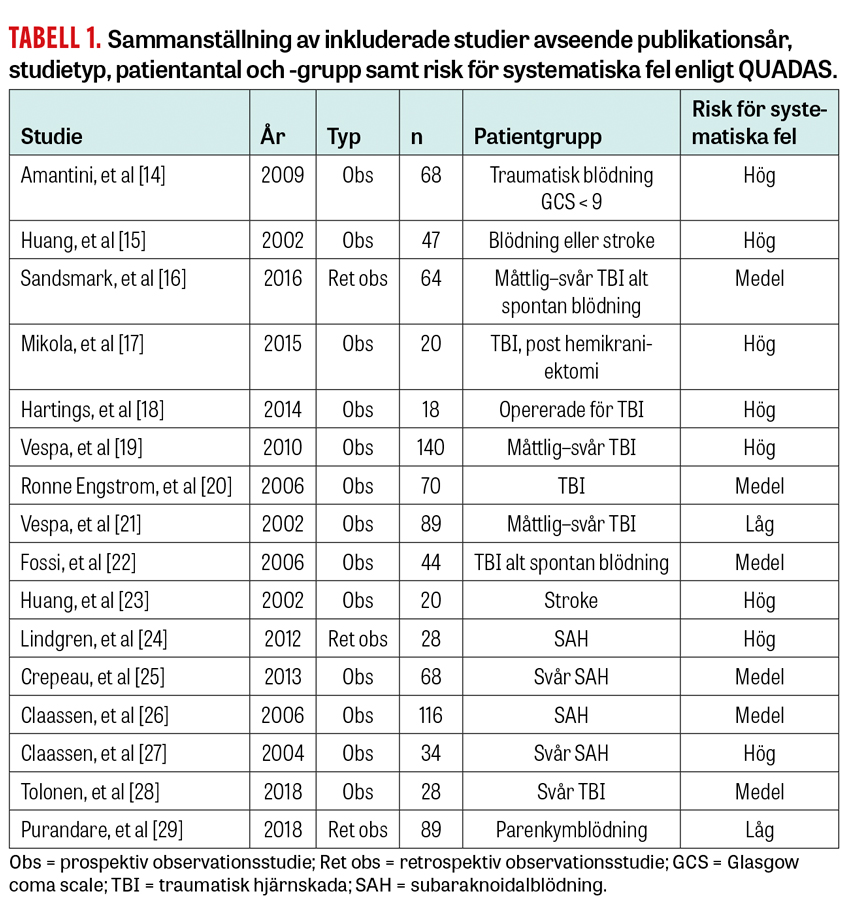
Studien omfattar artiklar publicerade i referentbedömda tidskrifter och avser vuxna patienter (≥ 18 år), vilka intensivvårdas för ischemisk stroke, spontan hjärnblödning eller traumatisk hjärnskada och övervakas med cEEG. Med spontan hjärnblödning menas alla intrakraniella supra- och infratentoriella blödningar som inte uppstått till följd av trauma. Traumatisk hjärnskada innefattar alla typer av skalltrauma med efterföljande sänkt medvetandegrad, med eller utan samtidig intrakraniell blödning. Inga studier exkluderades på grund av eventuella övriga sjukdomar hos patienterna eller för att de hade opererats eller genomgått andra interventioner för sina akuta hjärnskador.
Litteraturgranskningen omfattar randomiserade studier och observationsstudier på engelska eller svenska. Endast studier publicerade efter år 2000 analyserades, då den tekniska utvecklingen gör att äldre EEG-undersökningar inte omedelbart går att likställa med nutida övervakning. Litteratursökningen utfördes gemensamt av författarna och en medicinsk bibliotekarie. Varje studie granskades individuellt av respektive författare, varefter resultaten summerades i konsensus. Genomgången utgick från sökningar i Medline (Pubmed) med sökfrasen »continuous EEG« i kombination med någon av fraserna »cerebrovascular«, »intracranial hemorrhage«, »traumatic brain injury«, »intensive care«, »critically ill« eller »stroke«. Även studier som refererades i framsökta artiklar inkluderades om de uppfyllde inklusionskriterierna.
Respektive syfte utvärderades på nedanstående sätt:
- I vilken utsträckning cEEG identifierar epileptisk aktivitet hos de olika patientgrupperna (prevalens av epileptisk aktivitet)
- cEEG-fynd som korrelerar till 30-dagars totalmortalitet (eller IVA-mortalitet om vårdtiden där överstiger 30 dagar).
- cEEG-fynd som korrelerar till neurologiskt utfall, definierat enligt den modifierade Rankin-skalan (mRS) [10].
Den modifierade Rankin-skalan anger ett numeriskt värde på en patients grad av handikapp och hjälpbehov för att klara sin vardag. Skalan har värden mellan 0 (inget handikapp) och 6 (död). Dåligt neurologiskt utfall definieras ofta som mRS ≥ 4.
Litteraturöversiktens frågeställningar och struktur baserades på det så kallade PICO-systemet (population/problem, intervention, comparison, outcome) [11]. Populationen definierades således enligt ovan, »intervention« som övervakning med cEEG, »comparison« var motsvarande patienter utan cEEG-övervakning och »outcome« epileptisk aktivitet, neurologiskt utfall respektive mortalitet. För de enskilda studierna tillämpades den av SBU rekommenderade granskningsmallen QUADAS (Quality assessment of diagnostic accuracy studies) [12]. Denna är utvecklad för att granska diagnostiska studier och värderar bland annat studiepopulation, metod, bortfall och resultat [13].
Resultat
Litteratursökningen avslutades den 6 maj 2019 och resulterade i 405 sökträffar, där 16 artiklar uppfyllde inklusionskriterierna och är sammanställda i Tabell 1. Av dessa är 3 retrospektiva observationsstudier och 13 prospektiva observationsstudier. Inga randomiserade studier påträffades. Majoriteten av studierna (13 stycken) är utförda på patienter från neurologiska intensivvårdsavdelningar, 2 på allmänna intensivvårdsavdelningar och 1 på patienter både på allmän och neurologisk intensivvårdsavdelning. Totalt omfattar de inkluderade studierna 943 patienter, med intervallet 18–140 patienter.
Epileptisk aktivitet
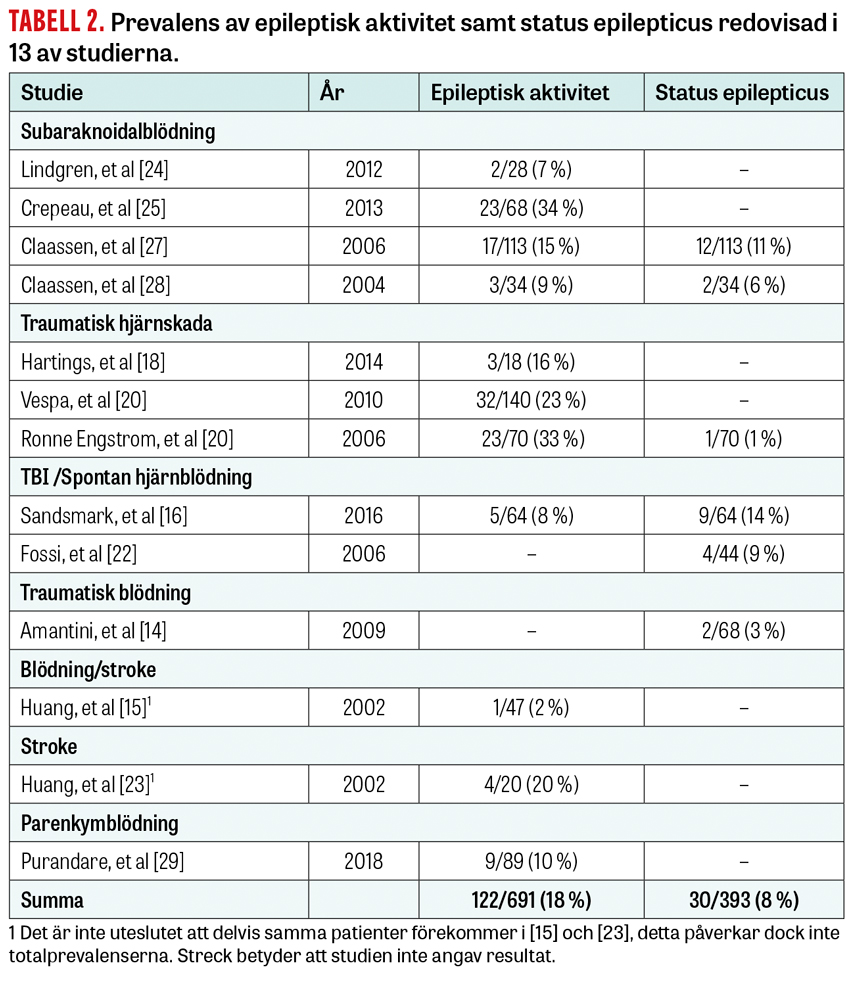
Prevalensen av epileptisk aktivitet redovisas i 13 av studierna, fördelad enligt Tabell 2.
Studierna skiljer sig dock åt (även för respektive diagnosgrupp) avseende typ och svårighetsgrad av hjärnskada, exakt vilken cEEG-metod som användes, sederingsregim och antiepileptisk medicinering. Om man summerar fynden uppvisade 18 procent av patienterna någon form av epileptisk aktivitet, och 8 procent hade någon gång status epilepticus. Sammanfattningsvis är det dock svårt att säkert bestämma prevalensen för de berörda tillstånden då spridningen är stor.
Mortalitet
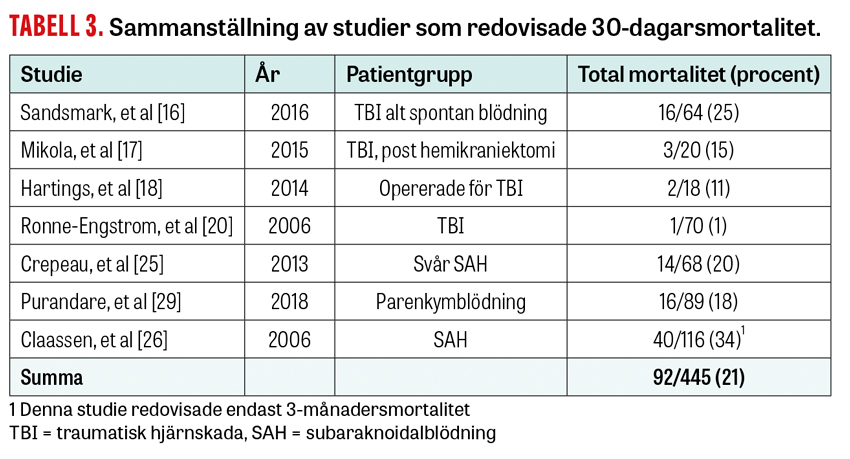
cEEG-fynd som korrelerar till 30-dagarsmortalitet eller mortalitet under intensivvårdstiden redovisas i 7 av studierna och sammanställs i Tabell 3. Den enda studien som redovisar mortalitet som en separat slutvariabel fann fyra olika cEEG-variabler som korrelerade med mortalitetsrisken [29]. Av dessa var två kvantitativa, datorframställda variabler som enbart presenterades genom digital behandling av cEEG-signalen.
Samtliga övriga 6 studier hade som mål att identifiera cEEG-fynd som korrelerade till en sammansatt ändpunkt av mortalitet eller dåligt neurologiskt utfall (ofta definierat som mRS > 4). Denna heterogenitet gör det omöjligt att dra slutsatser om korrelationen mellan enskilda cEEG-fynd och mortalitet utan tillgång till studiernas bakgrundsdata. Sammantaget varierar mortaliteten i studierna mellan 1 och 34 procent.
Neurologiskt utfall
cEEG-fynd som korrelerar till neurologiskt utfall tas upp i 5 av studierna [16, 17, 25, 26, 29] och med olika frågeställningar. En studie värderade huruvida normal sömnarkitektur på cEEG hos patienter med måttlig till svår traumatisk hjärnskada alternativt spontan hjärnblödning korrelerade till neurologiskt utfall (enligt mRS) vid utskrivning [16]. 30 procent av patienterna uppvisade normal sömnarkitektur på cEEG, och detta korrelerade starkt till positivt neurologiskt utfall med mRS < 4 (oddskvot [OR] 5,98, P = 0,012).
En annan studie fann att 12 av 186 olika datorberäknade cEEG-variabler korrelerade till gynnsamt neurologiskt utfall hos 20 patienter som genomgått olika neurokirurgiska ingrepp för traumatisk hjärnskada (multivariat regressionsanalys) [17]. Dock har man inte närmare definierat neurologiskt utfall (enligt något validerat mätinstrument) och inte heller tagit hänsyn till risken för massignifikans.
Den tredje undersökningen påvisade ingen korrelation (uni- och multivariat regressionsanalys) mellan återkommande rytmiska mönster på cEEG och neurologiskt utfall (mRS vid utskrivning) hos patienter som drabbats av aneurysmala subaraknoidalblödningar och samtidiga kramper eller sänkt medvetandegrad [25].
En fjärde studie fann korrelation mellan periodisk epileptisk aktivitet, avsaknad av normal sömnarkitektur och icke-reaktivitet på cEEG med dåligt neurologiskt funktionellt utfall (mRS ≥ 4) hos patienter med spontan subaraknoidalblödning 3 månader efter insult (multivariat logistisk regression, OR 4,3, P = 0,036) [26].
I den femte studien påvisades att posterodominant rytm, närvaro av stadium-2-sömn och nedsatt bakgrundsaktivitet på cEEG korrelerade signifikant (univariat analys) till bättre neurologiskt utfall (mRS < 3 vid 6 månader), även efter att man korrigerat för habituell funktionsnivå [29]. Vid multivariat analys kvarstod stadium 2-sömn signifikant (P = 0,008).
Värt att notera är således att avsaknad av normal sömnarkitektur predicerade dåligt funktionellt utfall i tre studier [16, 26, 29].
I samtliga 16 inkluderade studier gjordes cEEG-tolkningen av neurofysiologiskt utbildade läkare (oftast neurologer) och inte av intensivvårdsläkare. Sammantaget har inte redovisats att bedömningen av insamlade cEEG-data skett utifrån någon specificerad mall, och endast några av studierna använder standardiserad terminologi från American Clinical Neurophysiology Society [30].
Diskussion
Trots att kontinuerlig EEG-övervakning har funnits under lång tid som potentiell metod för omhändertagande av patienter med akuta hjärnskador, illustrerar denna litteraturgenomgång att det finns relativt lite samsyn kring hur metoden ska användas och vilka definitioner som ska tillämpas för utvärdering. Det största problemet är att värdera studierna i förhållande till varandra, då i princip varje enskild variabel (som patientklientel, definition av epileptisk aktivitet, behandlingsregim osv) skiljer sig åt. Det föreligger således ett stort behov av en standardiserad rapportering av data. Därtill kommer att flertalet studier inkluderar relativt få patienter och att samtliga är av observationstyp. Ovanstående studieupplägg medför att någon metaanalys inte låter sig göras. Av samma skäl bedömer vi det vanskligt att väga samman resultaten enligt en GRADE-värdering (Grading of recommendations assessment, development and evaluation), utan redovisar evidensläget i text [31].
Prevalensen av epileptisk aktivitet var svårvärderad, då de 13 studier som redovisade någon form av prevalensdata var vitt skilda i flera avseenden. De vanligaste problemen var otydlighet avseende definitioner av epileptisk aktivitet, dåligt beskriven antiepileptisk och sederande medicinering (vilken skulle kunna påverka prevalensen av epileptisk aktivitet) samt att flertalet av studierna inte hade som primärt mål att beskriva prevalensen av epileptisk aktivitet.
Beträffande mortalitet redovisades mortalitetsdata, i majoriteten av de 7 studier som tog upp sådana, i form av en kombinerad slutvariabel av mortalitet och dåligt neurologiskt utfall (vilket definierades olika). Sannolikt gjordes detta för att uppnå statistisk signifikans för enskilda cEEG-fynd i de relativt små studiematerialen (då låg mortalitetsfrekvens annars skulle kräva större studier). Det finns dock en viss rimlighet i att slå samman dessa två ändpunkter, då det sannolikt ofta är samma patologiska processer som ligger bakom sämre neurologiskt utfall respektive en stor del av mortaliteten vid akut hjärnskada. Dock presenterade ingen studie specificerad mortalitetsorsak, vilket hade varit relevant inte minst då intensivvårdade patienter löper stor risk att drabbas av komplikationer. Den enda studien som visade på cEEG-fynd som korrelerade till mortalitet var Purandare et al [29], men slutsatserna är svårtolkade, eftersom det som undersöktes var korrelationen mellan en ändpunkt (mortalitet) och ett stort antal cEEG-variabler utan hänsyn till risken för massignifikans.
Sammanfattningsvis ger studierna ett mycket svagt och svårvärderat vetenskapligt underlag om huruvida cEEG kan prognostisera mortalitet, vilket därmed inte kan besvaras.
Mer intressanta fynd fanns avseende frågeställningen huruvida neurologiskt utfall kan prognostiseras. Tre studier visade att avsaknad av normal sömnarkitektur på cEEG korrelerade till dåligt neurologiskt utfall [16, 26, 29]. cEEG-tolkningen gjordes i efterhand av neurofysiologiskt kunniga läkare. Däremot går det inte att koppla utsläckt sömnarkitektur till någon specifik åtgärd eller behandling (som skulle kunna reversera hjärnskadeförloppet), utan det rör sig i nuläget om ett strikt prognostiskt fynd. Vi bedömer därför att ett visst vetenskapligt stöd kan föreligga för att cEEG kan prognostisera neurologiskt utfall hos den aktuella patientkategorin.
De terapeutiska implikationerna generellt när man väl upptäcker epileptisk aktivitet på cEEG är även de oklara. Önskvärt vore givetvis om man hade kunnat visa att man genom att behandla epileptisk aktivitet upptäckt med cEEG kan förbättra det neurologiska utfallet och minska mortalitetsrisken för den enskilde patienten, men några sådana slutsatser kan inte dras. Främst beror det på att studierna primärt inte var utformade med den frågeställningen. Dock bör det understrykas att epileptiska anfall alltid behandlas och förebyggs hos intensivvårdspatienter, oavsett hur de påvisas [5].
För att sätta vår översikt i perspektiv bör det framhållas att användningen av cEEG hos patienter med postanoxisk hjärnskada efter främst hjärtstopp har studerats mer extensivt under senare år och med till synes större nytta [32-34]. Detta är dock en mer homogen patientgrupp, där hjärnskadan är sekundär till hjärtstoppet, medan vi önskade värdera evidensläget för patienter med primära hjärnskador.
En väsentlig slutsats av vår översikt är att fler prospektiva studier krävs inom området med större patientantal och standardiserad rapportering av utfallsvariabler och cEEG-tolkning för att bättre värdera diagnostiken, prediktionsförmågan och de terapeutiska implikationerna. Dock är metodproblemen med att utföra randomiserade undersökningar med cEEG-övervakning påtagliga såväl etiskt som medicinskt och vetenskapligt. Till exempel skulle en kontrollgrupp av svårt hjärnskadade patienter av kliniska skäl behöva genomgå frekventa intermittenta EEG, varvid skillnaderna i omhändertagande grupperna emellan rimligen skulle bli relativt små och resultatet svårvärderat. Blindning gentemot behandlande personal och läkare vore också svår att uppnå, även om man kopplade cEEG på kontrollgruppen utan att tolka signalerna, då intermittent EEG ju skulle krävas om patienten uppvisade kramper. Vidare skulle skillnader i medicinering etcetera baserade på cEEG-resultaten i den aktiva patientgruppen göra det uppenbart vilka patienter som tillhörde vilken grupp. Väldefinierade observationsstudier ter sig rimligare och bör kunna utföras multicenterbaserat i Sverige, då vi har en relativt enhetlig intensivvård med god registreringskvalitet.
Sammantaget ger ovanstående litteraturgenomgång inte tillräcklig evidens för att rekommendera att övervakning med kontinuerlig EEG används rutinmässigt på hjärnskadade patienter för att tidigt kunna detektera epileptisk aktivitet eller prognostisera mortalitet. Ett begränsat underlag kan dock anses föreligga för att utsläckt sömnarkitektur på cEEG kan prognostisera neurologiskt utfall, men det är i nuläget oklart hur detta påverkar terapimöjligheterna.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.