Kronisk tromboembolisk pulmonell hypertension (CTEPH) kan diagnostiseras sent på grund av vaga symtom.
CTEPH bör misstänkas hos patienter med kvarstående dyspné efter en akut lungemboli.
Alla patienter med CTEPH bör evalueras för kirurgi, ballongangioplastik och/eller läkemedelsbehandling.
Kirurgi har potential att bota CTEPH.
Kronisk lungembolism, eller kronisk tromboembolisk pulmonell hypertension (CTEPH), är en subtyp av pulmonell hypertension som drabbar ca 0,5–4 procent av patienter som insjuknat i akut lungembolism [1-5] och obehandlad leder till tidig död. Förutom de patienter som haft verifierade akuta lungembolier eller djupa ventromboser kan man hos cirka en fjärdedel av patienterna med CTEPH inte vare sig anamnestiskt eller via journaluppgifter fastställa någon tromboembolisk händelse som grund till sjukdomen. Via metaanalys av tillgängliga lungemboli- och CTEPH-studier har man sett att patienter med oprovocerad lungemboli eller upprepade djupa ventromboser har en högre risk att utveckla CTEPH [4]. Ytterligare riskfaktorer för att utveckla CTEPH är koagulopatier så som antifosfolipidsyndrom och förhöjda nivåer av faktor VIII, cancer, tidigare splenektomi, inflammatoriska tarmsjukdomar och infektioner i centrala infarter eller pacemakersystem [1].
I Sverige registreras patienter med CTEPH i det svenska registret för pulmonell arteriell hypertension (SPAHR), som inkluderar patienter med pulmonell arteriell hypertension (PAH) och CTEPH [6]. Enligt SPAHR:s senast publicerade årsrapport fanns det vid utgången av 2018 ca 225 levande patienter med diagnostiserad CTEPH i Sverige [7].
Patofysiologi
Tromboembolier i lungartärerna leder till fibrotisering, obstruktion och remodellering av lungartärerna med stigande pulmonella arteriella (PA) blodtryck och stigande pulmonell vaskulär resistans (PVR) [1, 8, 9]. Även gamla trombrester kan fibrotisera och leda till ocklusioner eller intravasala nät. De exakta cellulära mekanismerna är fortfarande inte klarlagda. Det relativt sett höga blodflödet till icke-avstängda lungsegment tros bidra till mikrovaskulär remodellering som kan likna den vid pulmonell arteriell hypertension och ytterligare förvärra situationen [1]. Symtom såsom konditionsnedsättning, försämrad arbetsförmåga och tilltagande dyspné utvecklas, liksom svår högersidig hjärtsvikt, vilken obehandlad kan leda till en tidig död.
Symtom och kliniska fynd
Patienterna söker med ospecifika symtom som dyspné, nedsatt ork och tilltagande uttröttbarhet [10]. Patienterna kan uppvisa tecken till klinisk högerkammarsvikt med t ex perifera ödem. Även symtom som hemoptys och synkope förekommer. Det är viktigt att observera att även patienter utan tidigare anamnes på djup ventrombos eller lungemboli kan drabbas av CTEPH. Eftersom symtomen är ospecifika diagnostiseras CTEPH ofta sent.
Diagnostik
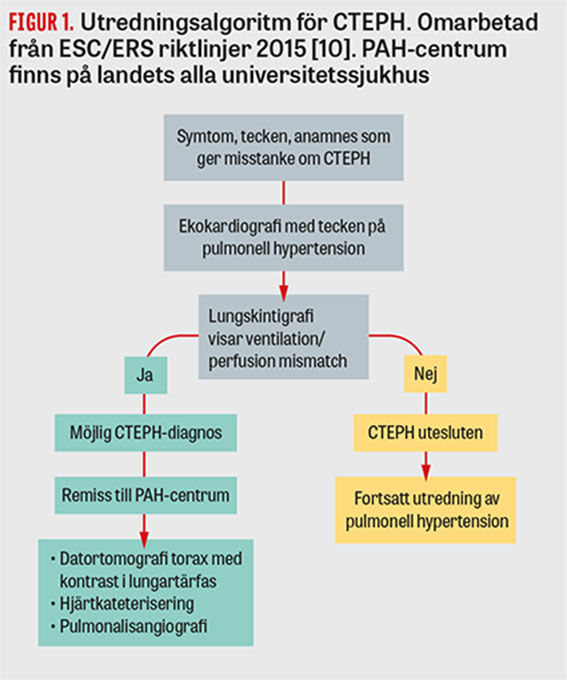
Definitionen av CTEPH beskrivs i Fakta 1 och utredningsgången visas i Figur 1. För att ställa diagnosen CTEPH krävs först 3–6 månaders behandling med antikoagulation för att kunna särskilja CTEPH från subakut lungembolism. Transtorakal ekokardiografi utgör ett första screeningverktyg och kan påvisa tecken till förhöjda PA-tryck, det vill säga en förhöjd tryckgradient mellan höger kammare och höger förmak, samt nedsatt högerkammarfunktion. På lungskintigrafi bör det finnas minst en segmentell perfusionsdefekt. Bilddiagnostik med DT inklusive DT-angiografi eller pulmonalisangiografi bör visa typisk bild av CTEPH med förändringar som intravasala nät, ringformade stenoser eller ocklusioner i lungartärer [1, 10]. DT samt spirometri används för att utesluta annan lungsjukdom som orsak till pulmonell hypertension. Magnetkameraundersökning av hjärtat kan användas som komplement för att utesluta intrakardiella shuntar samt karakterisera bilden av den pulmonella hypertensionen. Ytterligare bör medelartärtrycket i lungkretsloppet vara ≥25 mm Hg och pulmonellt inkilningstryck ≤15 mm Hg vid hjärtkateterisering. Dessutom används 6 minuters gångtest, WHO-funktionsklass, NT-proBNP samt den kliniska symtombilden med tecken på högersvikt eller synkopeepisod för att karakterisera sjukdomens svårighetsgrad hos patienten. Möjlighet till kirurgisk åtgärd av förändringarna i lungartärerna bedöms framför allt med hjälp av pulmonalisangiografi.
Behandling
Patienterna behandlas livslångt med warfarin. Än så länge finns inget starkt vetenskapligt stöd för användandet av nya orala antikoagulantia vid behandling av CTEPH, men i praktiken används dessa läkemedel i stor utsträckning ändå.
Kirurgisk behandling av CTEPH med pulmonella endartärektomier (PEA) är förstahandsbehandling för operabla patienter enligt Europeiska kardiologföreningens behandlingsriktlinjer från 2019 [1, 10]. PEA är en kurativt syftande behandling som förbättrar patienternas arbetsförmåga och botar eller lindrar invalidiserande symtom som svår dyspné [11-13]. Under förutsättning att förändringarna i lungartärerna är tillräckligt centralt belägna för att möjliggöra kirurgi så görs en bedömning av operabilitet genom att väga samman patientens riskprofil. De absoluta kontraindikationerna för PEA är få, men kraftigt nedsatt lungfunktion medför en förhöjd operationsrisk.
Patienter som är icke-operabla på basen av distalt belägna lesioner eller har kvarstående eller återkommande pulmonell hypertension efter kirurgisk behandling kan behandlas med specifika läkemedel för pulmonell arteriell hypertension, varav riociguat, som stimulerar lösligt guanylatcyklas, har starkast evidens [1]. Såväl PDE5-hämmare som endotelinreceptorantagonist används dock på klinisk indikation.
Ballongvidgning av lungartärer (balloon angioplasty, BPA) är under stark utveckling och kan i selekterade fall utföras om patienten är inoperabel. Resultaten från BPA är uppmuntrande och många patienter upplever symtomlindring; man kan också se lägre PA-tryck efter procedurerna [1, 14]. BPA görs i ett par kärl åt gången för att minska risken för komplikationer som reperfusionsödem, som kan inträffa om för många kärl öppnas vid ett tillfälle. Därför krävs vanligen upprepade behandlingstillfällen. Blödning från lungartär är en potentiellt allvarlig komplikation till BPA-behandling. Tidigare interventionell vana och erfarenhet är därför nödvändig vid etablering av BPA på högspecialiserade PAH-centrum.
Historia
Pulmonell endartärektomi, även kallad trombendartärektomi av lungartärerna, utvecklades som behandlingsmetod i San Diego från och med 1970-talet. 1980 publicerade Daily et al en serie med 3 patienter som opererats via sternotomi, med hjälp av kardiopulmonell bypass och i djup hypotermi med intermittent cirkulationsarrest [15]. Tidigare operationsstrategier innebar bland annat laterala torakotomier för åtkomst av lungartärer och användning av hjärt–lungmaskin, men trots det hade man problem med visualiseringen av operationsfältet på grund av bronkialcirkulationen. När PEA var i sin linda var dubbel lungtransplantation det enda kurativa behandlingsalternativet för patienter med CTEPH. I takt med att tekniken och resultaten för PEA markant förbättrats är lungtransplantation inte längre ett rimligt första alternativ. År 1993 kunde Jamieson et al publicera resultat för 150 opererade patienter [16, 17]. 2003 presenterades resultat från 1 500 opererade patienter i San Diego [18]. Under denna tidsperiod har den perioperativa mortaliteten sjunkit från 17 procent till 4,4 procent [18], trots att man opererat allt sjukare patienter med mer svåråtkomlig distal sjukdom i lungartärerna. Operationsmetoden fick spridning under tidigt 1990-tal, och metoden togs till Sverige och Karolinska universitetssjukhuset av professor Kjell Rådegran, som själv varit i San Diego för att lära sig den nya metoden. I Sverige utfördes den första operationen med PEA 1992 på Karolinska sjukhuset. Resultat från en tidig serie av dessa patienter publicerades i Läkartidningen 2004 av Kolsrud et al [19].
San Diego är i dag världsledande inom PEA med en perioperativ mortalitet på under 2 procent och över 4 000 ingrepp gjorda. I Europa är Papworth Hospital i Cambridge en av de största enheterna som erbjuder PEA och även nationellt centrum i Storbritannien med 880 opererade patienter mellan 1997 och 2012. Även där har man utmärkta operationsresultat och numera en perioperativ mortalitet på 2,4 procent [20]. Framsteg i intensivvård och ökad kunskap om hanteringen av dessa svårt sjuka patienter har gjort att man nu kan operera allt svårare sjuka patienter.
Kirurgisk behandling – pulmonell endartärektomi
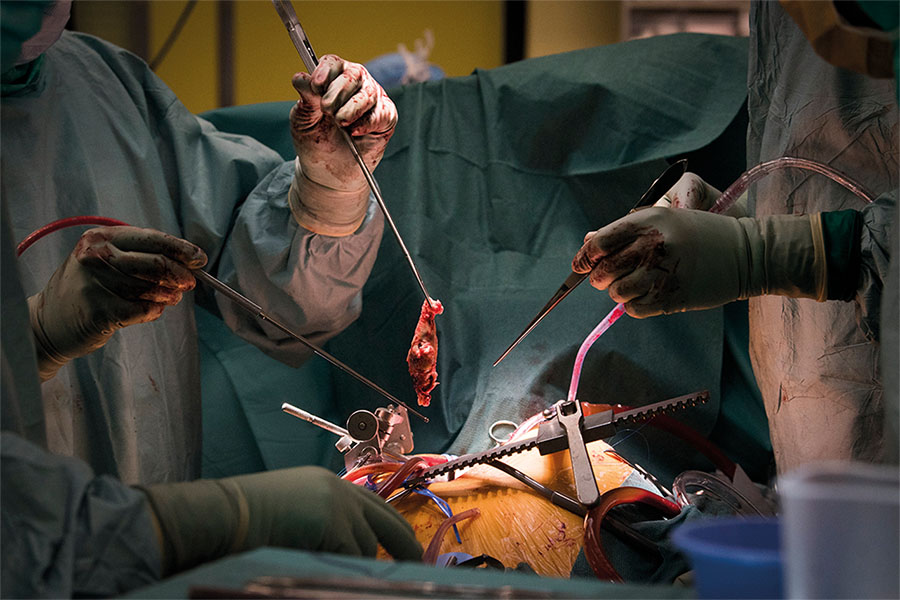
Operationen genomförs via median sternotomi, och med hjälp av hjärt–lungmaskin kyls patienten ner till 18–20 °C. I djup hypotermi inleds cirkulatorisk arrest, och en längsgående incision görs i den intraperikardiella delen av höger respektive vänster lungartär. Man skapar en dissektionsyta mellan lamina intima och media, och därifrån jobbar man sig successivt mer distalt i kärlträdet gren för gren och genomför endartärektomin (Figur 2 och 3). Om man inte lyckas identifiera korrekt dissektionslager i kärlet riskerar man antingen inkomplett PEA eller perforation av lungartär med risk för fatal lungblödning. Arrestperioderna varar högst 20 minuter, varefter kroppen åter perfunderas med hjälp av hjärt–lungmaskinen i cirka 10 minuter. Arrestperioderna upprepas tills man genomfört en så komplett trombendartärektomi bilateralt som ter sig möjlig [13, 15, 18, 21].
Intensivvård
Den tidiga postoperativa vården kräver avancerad toraxintensivvård och erfarenhet av att behandla svår hjärtsvikt och särskilt högersvikt. Hemodynamiken övervakas med intrakardiell tryckmätning (med PA-kateter). En form av dialys, kontinuerlig veno-venös hemofiltration, används för att minska vätskevolymen och därmed risken för reperfusionsödem. Tillgång till Ecmo (extrakorporeal membranoxygenering) är nödvändig vid svåra fall då både hjärt- och lungsvikt kan inträffa postoperativt.
Resultat på Karolinska universitetssjukhuset
Mellan 1997 och 2018 har 100 patienter genomgått PEA på Karolinska universitetssjukhuset. Medelålder vid operation var 62 år, och 39 procent var kvinnor. Nästan samtliga patienter var svårt symtomatiska motsvarande WHO-funktionsklass 3 eller 4 i samband med operationen. De flesta (86 procent) hade en normal vänsterkammarfunktion men en kraftigt påverkad högerkammarfunktion. Förekomsten av förmaksflimmer var 19 procent. Medelvärdet av det preoperativa systoliska lungartärtrycket var ca 80 mm Hg. Majoriteten av patienterna hade normal lung- och njurfunktion. 30-dagarsmortalitet (död oavsett orsak inom 30 dagar) var 7 procent och 5-årsöverlevnaden var 80 procent. För de patienter som överlevde den tidiga postoperativa perioden (30 dagar) var prognosen god med en 1-, 5- och 10-årsöverlevnad på 98 procent, 86 procent respektive 74 procent. Våra resultat finns närmare beskrivna i en nyligen publicerad artikel där vi även rapporterade överlevnaden efter PEA jämfört med en matchad svensk generell population [22]. Vi fann att den förväntade överlevnaden efter PEA var kortare jämfört med en matchad normalbefolkning, men skillnaden var inte så stor. Relativ överlevnad efter 10 år hos patienter som överlevde det tidiga postoperativa förloppet var 91 procent (95 procents konfidensintervall 75–100 procent).
Diskussion
Prognosen för patienter med odiagnostiserad och obehandlad CTEPH är dyster. Patienter som genomgår framgångsrik operation har dock en mycket god funktionsnivå och prognos.
SPAHR-registrets årsrapport 2018 visar en 5-årsöverlevnad för patienter som genomgått PEA på 83 procent, medan icke-opererade patienter har en 5-årsöverlevnad på 58 procent [7]. Dessa grupper är naturligtvis inte jämförbara då den icke opererade gruppen till stor del består av patienter som är inoperabla antingen på grund av distalt belägna lesioner i lungartärerna eller på basen av en omfattande samsjuklighet.
I det europeiska CTEPH-registret redovisas en mortalitet under sjukhusperioden på 4,7 procent hos patienter som genomgått PEA och 3-årsöverlevnad på 89 procent hos opererade CTEPH-patienter, jämfört med en 3-årsöverlevnad på 70 procent hos patienter som inte genomgått PEA [23]. Kraftigt förhöjt PVR (1 000-1 200 dyn × s × cm⁻⁵) [24], och hög NYHA-klass (IV jämfört med III) är prognostiskt ogynnsamma faktorer som korrelerar med högre mortalitet och morbiditet även peri- och postoperativt [23]. Det gäller alltså att identifiera patienter med CTEPH tidigt, innan de drabbats av irreversibla skador.
Århus universitetssjukhus i Danmark är Nordens största PEA-centrum med 239 opererade patienter mellan 1994 och 2016. Den totala 30-dagarsmortaliteten rapporterades till 8,4 procent för hela kohorten, men under det senare årtiondet har mortaliteten sjunkit från 22,6 procent till 4,3 procent [12]. 5-årsöverlevnaden var 77 procent och 10-årsöverlevnaden var 62 procent. Även om det är svårt att jämföra mortalitetssiffror mellan olika kliniker i olika länder, utan att samtidigt ta hänsyn till patienternas samtidiga komorbiditetsbörda, så kan man översiktligt säga att de initiala resultaten från Århus och Stockholm är jämförbara. En gemensam uppföljning av patienterna mellan dessa två centrum vore därför av stort värde, vilket också planläggs via en gemensam framtida databas.
Sammanfattning
PEA är en potentiellt kurativ behandling för en svår sjukdom som orsakar mycket lidande och en förtida död. Patienter med CTEPH som opereras med PEA har en förbättrad överlevnad jämfört med de patienter som inte kan eller blir opererade. Medelartärtrycket i lungkretsloppet, 6 minuters gångtest och patienternas livskvalitet förbättras. Alla patienter med misstänkt CTEPH bör därför remitteras till ett PAH-centrum för evaluering, utredning och ställningstagande till kirurgisk behandling.
Potentiella bindningar eller jävsförhållanden: Göran Rådegran är och har varit prövare i PAH-studier för Actelion Pharmaceuticals, Bayer Health Care, Glaxo Smith Kline, Pfizer och United Therapeutics samt i hjärttransplantationsstudier för Novartis. Göran Rådegran har också varit engagerad i rådgivande kommittéer för Actelion Pharmaceuticals, Bayer Health Care, Glaxo Smith Kline, Eli Lilly och Sanofi samt erhållit föreläsararvoden från Actelion Pharmaceuticals, Bayer Health Care, Glaxo Smith Kline och Nordic Infucare.
Fakta 1. Diagnostiska kriterier för CTEPH [10]
Antikoagulation minst 3 månader
mPAP ≥ 25 mm Hg
PAWP ≤ 15 mm Hg
Lungskintigrafi med perfusionsdefekt
Bilddiagnostik med typisk bild för CTEPH
Förklaring:
CTEPH = kronisk tromboembolisk pulmonell hypertension
mPAP (mean pulmonary artery pressure) = medelartärtrycket i lungartär
PAWP (pulmonary artery wedge pressure) = pulmonellt inkilningstryck