Syftet vid behandling av KOL är att lindra symtom och förebygga exacerbationer.
Läkemedelsbehandling vid KOL baseras på luftrörsvidgande behandling som både ger symtomlindring och förebygger exacerbationer.
Tillägg av inhalationskortikosteroider (ICS) ges till dem som trots luftrörsvidgande behandling har fortsatta exacerbationer.
Upprepad mätning av eosinofiler i blod kan utgöra en vägledning för bedömning av indikation för ICS.
Blodeosinofiler ≥0,3 × 109/l ger ökat stöd för behandling med ICS.
Vid samtidig astma föreligger alltid indikation för behandling med ICS.
Vid uppföljning av patienter med KOL som behandlas med ICS bör indikationen för fortsatt ICS-behandling bedömas.
Kroniskt obstruktiv lungsjukdom (KOL) karakteriseras av en kronisk luftvägsobstruktion med sänkt FEV1/FVC-kvot efter bronkdilatation och med symtom från luftvägarna [1, 2]. Sjukdomen är i flertalet fall en följd av mångårig tobaksrökning. För patienter med KOL har primärvården i dag ett huvudansvar för utredning, behandling och uppföljning. Dessa patienter är också ofta multisjuka, vilket ställer stora krav på omhändertagandet. När det gäller den farmakologiska behandlingen av KOL har rekommendationerna de senaste åren successivt ändrats. Sedan Läkemedelsverkets behandlingsrekommendationer utkom 2015 har internationella styrdokument uppdaterats årligen och nu senast 2020 [1, 2]. Internationella rekommendationer omfattar därför nya och viktiga kunskaper från studier som publicerats efter 2015, vilka saknas i de svenska rekommendationerna. Framför allt innebär de internationella rekommendationerna ett mer komplext synsätt på val av behandling. Det finns därmed ett behov av en uppdatering av de svenska rekommendationerna i syfte att etablera tydliga och aktuella behandlingsalgoritmer med målsättningen att erbjuda bästa möjliga behandling till varje patient.
Hur ser läkemedelsförskrivningen ut?
I Sverige behandlas allt fler patienter med KOL med en kombination av långverkande antikolinergika (long-acting muscarinic antagonists, LAMA), långverkande beta-2-agonister (LABA) och inhalationskortikosteroider (ICS), så kallad trippelbehandling. I PRAXIS-studien från Mellansverige hade andelen patienter, oberoende av vårdnivå, som regelbundet behandlades med ICS/LABA/LAMA ökat från 29 procent år 2005 till 40 procent år 2014 [3]. Studien visade att andelen med trippelbehandling 2014 var högst i gruppen med hög symtombörda och anamnes på upprepade eller svåra exacerbationer det senaste året, det vill säga motsvarande grupp D enligt GOLD (Global Initiative for Chronic Obstructive Lung Disease)-kriterierna (Figur 1). I den gruppen hade hälften av patienterna trippelbehandling. Av de patienter som hade låg symtombörda och enstaka eller inga exacerbationer det senaste året, det vill säga motsvarande GOLD grupp A, behandlades en femtedel med en kombination av ICS/LABA/LAMA. Dessa patienter bör enligt GOLD endast behandlas med bronkdilaterare eller inte ha någon farmakologisk behandling alls.
KOL eller astma eller både och?
Ibland kan det vara svårt att skilja mellan KOL och astma, och många patienter kan uppvisa kliniska, fysiologiska och inflammatoriska förändringar som är förenliga med båda sjukdomarna. Ungefär en fjärdedel av patienter med KOL-diagnos i Sverige har även (eller har haft) en astmadiagnos [4, 5]. Cirka 20 procent av dem med svår KOL uppvisar också karakteristika som är typiska för astma [6]. Tillstånd med samtidig KOL och astma kallas ibland astma–KOL-överlappning (asthma-COPD overlap, ACO), men den praktiska nyttan av begreppet har ifrågasatts. I det senaste dokumentet från GOLD framhålls att de två traditionella diagnoserna KOL och astma bör användas i stället för ACO, eftersom det är helt klart att ACO inte utgör en enhetlig patientgrupp [2].
De karakteristika hos patienter med KOL som ska leda tankarna till samtidig astma är
- tidig sjukdomsdebut
- stor symtomvariation
- triggerfaktorer (allergen, ansträngning, kyla m m) som utlöser symtom
- variabel luftvägsobstruktion
- stor reversibilitet (> 400 ml)
- normal lungröntgen
- en hög koncentration av eosinofiler i blod.
Dessa karakteristika är inte specifika för astma. Stora variationer i symtom och luftvägsobstruktion samt luftvägssymtom till följd av yttre exponering talar för astma men förekommer även vid KOL.
Det är också viktigt att påpeka att reversibel luftvägsobstruktion är minst lika vanlig vid KOL som vid astma [7].
Den viktigaste skillnaden mellan astma och KOL är att KOL-patienten aldrig uppnår normal lungfunktion. Luftvägsobstruktionen vid KOL är kronisk och FEV1/FVC-kvoten efter bronkdilatation är alltid lägre än 0,7, men utveckling av kronisk luftvägsobstruktion kan även förekomma vid astma. Det kan röra sig om patienter med astma som har rökt under många år och som därför utvecklar KOL och därmed har båda sjukdomarna. Vid en viss typ av astma utvecklas kronisk luftvägsobstruktion av okända orsaker, utan att rökning har förekommit. Till skillnad från KOL har dessa patienter som regel inte emfysem, utvecklar sällan respiratorisk insufficiens och dör oftast inte i förtid på grund av sin luftvägssjukdom. Det är viktigt att särskilja dessa två tillstånd, astma med kronisk luftvägsobstruktion respektive KOL, eftersom det är två olika sjukdomstillstånd med olika patofysiologi, klinisk bild, prognos och mortalitet.
Att koncentrationen (»antalet«) av eosinofiler i blod ligger högt inom det angivna referensintervallet är vanligt vid astma men förekommer ibland också vid KOL (se även nedan). Vid både KOL och astma kan antalet eosinofiler i blod dessutom variera mycket över tid [8-10].
Vad behandlar vi vid KOL?
Syftet vid behandling av KOL är att lindra symtom, förbättra lungfunktion och förebygga exacerbationer [1, 2]. En exacerbation definieras som en akut behandlingskrävande försämring av patientens symtom [2]. Trots definitionen kan det vid bedömning av den enskilda patienten i vissa fall vara svårt att korrekt värdera en exacerbation. De vanligaste symtomen vid en exacerbation är andnöd, ökad sputumproduktion och missfärgning av sputum. Exacerbationer är oftast orsakade av virala eller bakteriella luftvägsinfektioner. Att förebygga exacerbationer vid KOL är viktigt, eftersom en ökad exacerbationsförekomst är kopplad till sämre prognos och ökad mortalitet [11, 12]. Två eller flera KOL-exacerbationer, alternativt en KOL-exacerbation som leder till sjukhusinläggning, under ett år definieras som betydande exacerbationsproblematik [1, 2]. I PRAXIS-studien 2014 noterades att 26 procent av slumpvis utvalda KOL-patienter från primärvården i Uppsala–Örebro-regionen hade sökt sjukvård akut senaste halvåret på grund av en KOL-exacerbation. Motsvarande siffra för sjukhusmottagningar var 40 procent [13]. Enligt Luftvägsregistrets årsrapport från 2018 hade 10 procent av patienterna i primärvården och 31 procent av patienterna från sjukhusmottagningar haft två eller fler exacerbationer det senaste året. Exacerbationer är således ett reellt problem som behöver kartläggas hos varje enskild patient.
Grundläggande principer för läkemedelsbehandling
Läkemedelsbehandlingen vid KOL baseras på luftrörsvidgande behandling med LAMA eller LAMA tillsammans med LABA som både ger symtomlindring och förebygger exacerbationer. Tillägg av ICS ges till de patienter som trots denna behandling har upprepade exacerbationer [1, 2].
Symtomlindrande behandling
Både för LAMA och LAMA/LABA finns ett flertal alternativ som levereras i olika typer av inhalatorer. För vissa patienter kan också kortverkande bronkdilaterare inhaleras vid behov för behandling vid tillfällig ökning av symtom [1, 2].
Ett flertal studier har visat god effekt av LAMA och LABA på vanliga KOL-symtom såsom andnöd, samt på hälsorelaterad livskvalitet och fysisk prestationsförmåga [1, 2]. Kombinationsbehandling med LAMA/LABA, »dubbel bronkdilatation«, ger bättre effekt på symtom än varje läkemedel var för sig [1, 2]. Luftrörsvidgande läkemedel ökar prestationsförmågan hos patienter med KOL, vilken kan bedömas med 6-minuters gångtest [1, 2]. Till patienter som, trots dubbel bronkdilatation med LAMA/LABA, har svåra symtom av sin KOL med stor påverkan på upplevd livskvalitet men få exacerbationer kan tillägg med ICS prövas [1, 2, 14]. Effekten av denna behandling ska sedan alltid utvärderas, förslagsvis efter tre månader [14].
Exacerbationsförebyggande behandling
Behandling med ICS används vid KOL för att förebygga exacerbationer. ICS ska vid KOL alltid ges i kombination med en LABA eller som så kallad trippelbehandling tillsammans med LAMA/LABA [1,2]. Kombinationen av ICS och LABA har i olika studier visats reducera antal exacerbationer med 20–30 procent jämfört med behandling med enbart ICS respektive LABA [1]. Flera varianter av en fast kombination av ICS/LABA och ICS/LAMA/LABA är tillgängliga i Sverige.
Vilka patienter bör erbjudas inhalationssteroider?
Enligt internationella och nationella riktlinjer bör tilläggsbehandling med ICS övervägas för patienter med KOL motsvarande GOLD grupp C och D, dvs de patienter som har haft två eller fler exacerbationer eller minst en sjukhusvårdkrävande exacerbation det senaste året (Tabell 1) [1, 2]. Med tillägg av ICS kan de här patientgrupperna förutom en exacerbationsförebyggande effekt även uppnå bättre hälsostatus och lungfunktion [1, 2]. På grund av svårigheter att ibland klart kunna avgöra vad som är en exacerbation och vad som »endast« är en stor symtombörda kan även patienter som inte har kliniskt dokumenterade exacerbationer, men betydande symtom, bli föremål för behandling med ICS. Hos patienter med KOL och samtidig astma föreligger det dock alltid en indikation för behandling med ICS. Vid KOL finns dock ingen påvisad samvariation mellan grad av reversibilitet och positivt behandlingssvar på inhalationssteroider.
Betydelsen av eosinofiler i blod
Senare års studier talar för att en något högre koncentration av eosinofiler i blod kan indikera risk för framtida exacerbationer samt förebyggande behandlingseffekt av ICS vid KOL [1, 2, 15-17]. Det bör observeras att det här sambandet hos patienter med KOL gäller nivåer av eosinofiler i blod som ligger inom referensintervallet som brukar anges för friska. Den sammantagna bilden är att den förväntade nyttan av behandling med ICS ökar när koncentrationen av eosinofiler i blod är lika med eller överstiger 0,30 × 109/liter, dvs ligger högt inom det normala referensintervallet [1, 2]. I det internationella dokumentet från GOLD gör man följande specifika tolkning av aktuell litteratur:
Om koncentrationen av eosinofiler är < 0,10 × 109/liter så har man sannolikt ingen nytta av inhalationssteroider.
Om koncentrationen av eosinofiler är ≥ 0,30 × 109/liter och om patienten har upprepade exacerbationer så rekommenderas behandling med ICS i kombination med långverkande bronkdilaterare.
Om koncentrationen av eosinofiler är lika med eller över 0,10 × 109/liter men under 0,30 × 109/liter och patienten har upprepade exacerbationer bör behandling med ICS övervägas.
Mätning av eosinofiler i blod görs enkelt med differentialräkning av blodceller till en låg kostnad. Antal eosinofiler i blod varierar över tid, och i GOLD-dokumentet rekommenderas att upprepad mätning av eosinofiler i blod görs hos patienter med KOL och exacerbationer, men det saknas ännu konsensus kring hur ofta detta bör ske [2]. För dessa patienter kan analys av eosinofiler i blod utgöra en vägledning för bedömning av indikation för behandling med ICS (Tabell 1).
Annan exacerbationsförbyggande behandling
Hos patienter med svår KOL, samtidig kronisk bronkit och exacerbationshistorik minskar risken för medelsvåra till allvarliga exacerbationer om de behandlas med roflumilast, en fosfodiestesras-4-hämmare [1, 2, 18, 19]. Peroral behandling med roflumilast ges oftast som tillägg till behandling med LAMA, LABA och ICS. Gastrointestinala biverkningar av roflumilast är vanliga, framför allt under insättningsfasen, men kan minskas om behandlingen påbörjas med små doser som sedan successivt höjs [1].
Ett förenklat behandlingssätt vid KOL
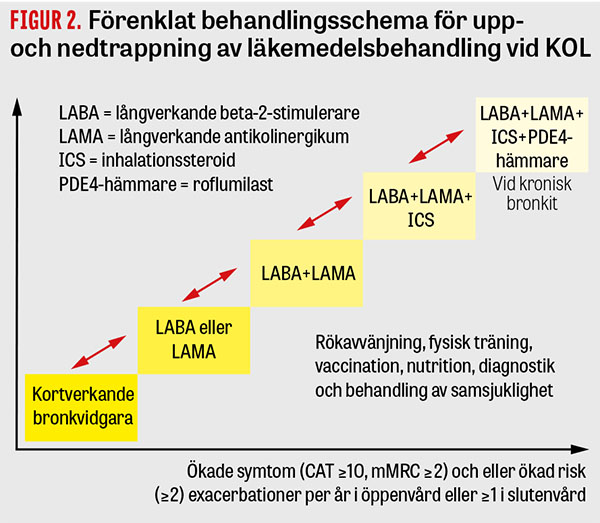
I figur 2 presenteras ett förenklat behandlingsschema för upp- och nedtrappning av läkemedelsbehandlingen vid KOL. Medan upptrappning är beroende på symtom och benägenhet för exacerbationer kan nedtrappning bli aktuell om ICS är insatt på felaktiga grunder.
En eller flera inhalatorer
Nackdelen med att förskriva flera inhalatorer av sinsemellan olika typ är att inhalationstekniken för respektive inhalator ofta är olika, vilket ökar risken för handhavandefel [20]. Användning av flera inhalatorer ger dock en ökad flexibilitet vid val av dosering och läkemedelssubstans för de patienter som har nytta av det. Att använda ICS i en separat inhalator kan ge en möjlighet att sätta ut ICS vid utebliven behandlingseffekt eller vid eventuella bieffekter. Dosen kan också justeras vid eventuella lokala biverkningar.
Den stora fördelen med en fast trippel, när detta är indicerat, är enkelheten i handhavandet av en inhalator, vilket sannolikt ökar följsamheten till behandlingen och minskar risken att patienten använder en felaktig inhalationsteknik.
Uppföljning av läkemedelsbehandling vid KOL
Att ordinerad behandling följs upp och utvärderas är en väsentlig del av god läkekonst. Av praktisk betydelse är att inte bara kartlägga vilka läkemedel som patienten har ordinerats utan också vilka läkemedel som har använts och hur de använts, dvs också kontrollera inhalationstekniken. Bristfällig inhalationsteknik är en vanlig orsak till dåligt behandlingsresultat [21]. Såväl inhalationsteknik som enkla principer för behandling kan behöva repeteras flera gånger för att uppnå ett tillfredsställande resultat. Detta kräver att ansvariga vårdenheter erbjuder regelbundna återbesök både till intresserade och kunniga läkare och astma/KOL-sjuksköterskor [22].
När standardbehandlingen enligt riktlinjer inte fungerar trots god följsamhet till ordinerad läkemedelsbehandling och en korrekt inhalationsteknik är det viktigt att komma ihåg att rekommendationer och riktlinjer för behandling varken är absoluta eller definitiva och att varje patient behöver bedömas individuellt.
Skillnader mellan rökare och icke-rökare
Det är väl dokumenterat att fortsatt tobaksrökning har en negativ effekt på samsjuklighet och långtidsprognos vid KOL. Det är därför som rökstopp också är en mycket kostnadseffektiv behandling ur hälsoekonomisk synpunkt. Det är också väl känt att effekten av läkemedelsbehandling med ICS är sämre hos patienter med astma som röker än hos dem som inte röker. Kunskapen om huruvida denna skillnad även gäller vid KOL är tyvärr mer begränsad.
Risker med ICS-behandling
För behandlande läkare är det alltid viktigt att väga för- och nackdelar med att behandla KOL-patienter med ICS. Förutom att överbehandling innebär en ökad läkemedelskostnad föreligger även ökad risk för bieffekter. Både svenska och internationella studier har visat att det finns en ökad risk för pneumoni hos patienter med KOL som behandlas med ICS [23, 24]. I den svenska ARCTIC-studien var användning av ICS associerad med en 20–30 procent ökad pneumonirisk för KOL-patienter med FEV1 > 50 procent av förväntat värde jämfört med dem som inte behandlades med ICS. Även risken för biverkningar i form av blåmärken, munkandidos och heshet ökar vid ICS-behandling [25]. Vissa studier har också påvisat en ökad risk för osteoporos och frakturer vid ICS-behandling vid KOL medan andra studier inte har kunnat konfirmera detta [26, 27].
När bör utsättning av ICS övervägas?
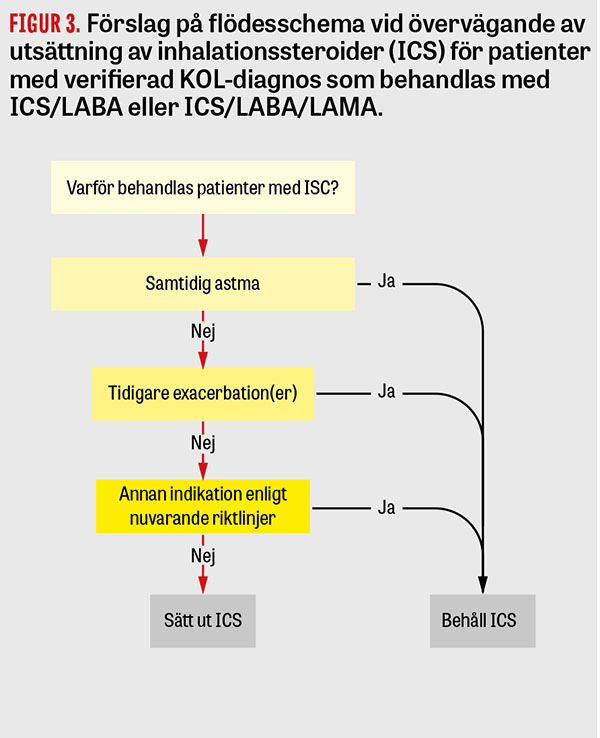
Vid uppföljning av patienter med KOL som behandlas med ICS bör man noggrant bedöma indikationen för fortsatt ICS-behandling. Det finns studier som tyder på att det förekommer en överbehandling med inhalationssteroider vid KOL och att det finns en grupp patienter där behandling med ICS kan sättas ut och ersättas med enbart behandling med bronkdilaterare utan risk för sjukdomsförsämring [28-30]. Flödesschemat i figur 3 kan då vara till hjälp för att identifiera de patienter där detta är möjligt [31]. Faktorer som bör bedömas är samtidig astma, eosinofiler i blod, tidigare anamnes på exacerbationer eller annan indikation för ICS-behandling enligt nuvarande riktlinjer. Vid utsättning av ICS bör patienten alltid ges optimal bronkdilatation. En planerad uppföljning är alltid en viktig del efter en förändring av läkemedelsbehandling. Detta kan ske antingen med telefonuppföljning eller med mottagningsbesök. Användandet av frågeformulär som CAT (COPD assessment test) kan då underlätta bedömning av eventuell symtomförsämring.
Potentiella bindningar eller jävsförhållanden: Björn Ställberg har erhållit arvoden för föreläsningar och utbildningsaktiviteter arrangerade av Astra Zeneca, Boehringer Ingelheim, Novartis, Meda, Chiesi och Teva samt deltagit i referensgrupper arrangerade av Astra Zeneca, Boehringer Ingelheim, Novartis, Meda och Glaxo Smith Kline. Christer Janson har erhållit arvoden för föreläsningar och utbildningsaktiviteter arrangerade av Astra Zeneca, Boehringer Ingelheim, Novartis, Meda, Chiesi och Teva samt deltagit i referensgrupper arrangerade av Astra Zeneca, Boehringer Ingelheim, Novartis, Meda och Glaxo Smith Kline. Anders Lindén har deltagit i referensgrupper arrangerade av Astra Zeneca, Boehringer Ingelheim, Chiesi, Novartis, och Glaxo Smith Kline, erhållit ersättning för utbildningsaktiviteter arrangerade av några av nämnda företag samt erhållit forskningsstöd från Astra Zeneca, Boehringer Ingelheim och Glaxo Smith Kline. Karin Lisspers har erhållit arvoden för föreläsningar och utbildningsaktiviteter arrangerade av Astra Zeneca, Novartis, Boehringer Ingelheim, Chiesi samt deltagit i och erhållit ersättning för rådgivande kommittéer arrangerade av Novartis, Astra Zeneca, Glaxo Smith Kline och Boehringer Ingelheim. Kjell Larsson har deltagit i rådgivande kommitté och/eller föreläst/deltagit i utbildningar arrangerade av Astra Zeneca, Boehringer Ingelheim, Chiesi, Glaxo Smith Kline, Mylan, Sanofi, Orion, Novartis och Teva.
Arbetet om inhalationssteroiders roll vid behandling av KOL initierades av läkemedelsföretaget Boehringer Ingelheim, och en ersättning har utgått för en mindre del av arbetet. Artikeln är skriven av en oberoende arbetsgrupp bestående av samtliga författare. Artikelns innehåll har utformats av författarna utan påverkan från företaget.