Diagnosen hjärtamyloidos bör övervägas vid hjärtsvikt, ofta med bevarad ejektionsfraktion, restriktivitet och biventrikulär hypertrofi.
Hjärtamyloidos på basen av lätta kedjor (AL) kräver snabb diagnos och handläggning, medan hjärtamyloidos orsakad av transtyretin (ATTR) har ett långsammare förlopp.
Vanliga övriga manifestationer är karpaltunnelsyndrom, spinal stenos och neuropati vid ATTR-amyloidos och försämrad njurfunktion vid AL-amyloidos.
Utredning innefattar ekokardiografi, skintigrafi, biokemisk analys av lätta kedjor samt ofta bukfetts- eller hjärtmuskelbiopsi.
Flera hjärtsviktsbehandlingar, såsom betablockad och ACE-hämmare, tolereras dåligt vid hjärtamyloidos.
Riktad behandling vid ATTR-amyloidos och cytostatika vid AL-amyloidos handläggs i samråd med erfarna centrum.
Amyloidos är en heterogen grupp av tillstånd som karakteriseras av vävnadsinlagringar av proteinfibriller, vilka orsakar organdysfunktion. En särskilt allvarlig manifestation är hjärtamyloidos, som karakteriseras av hjärtsvikt, ofta med bevarad ejektionsfraktion, retledningshinder och arytmier [1]. De diagnostiska och terapeutiska möjligheterna har varit begränsade, vilket bidragit till underdiagnostik och dålig prognos [2]. Under senare år har dock betydande framsteg gjorts. Som en konsekvens av nya möjligheter har vi märkt ett ökat intresse och att allt fler remisser anländer till våra hjärtmottagningar, särskilt avseende transtyretinamyloidos. Syftet med denna artikel är därför att presentera en uppdaterad bild av kunskapsläget och rekommendationer för utredning, behandling och nivåstrukturering vid hjärtamyloidos.
Patofysiologi
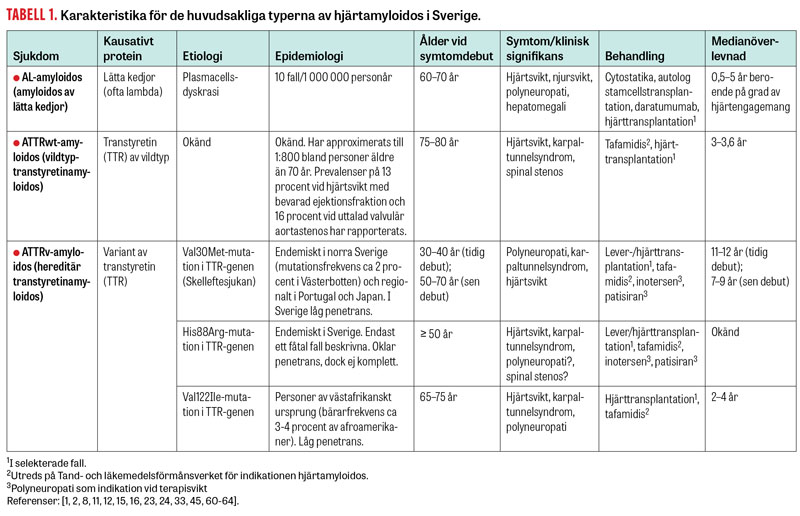
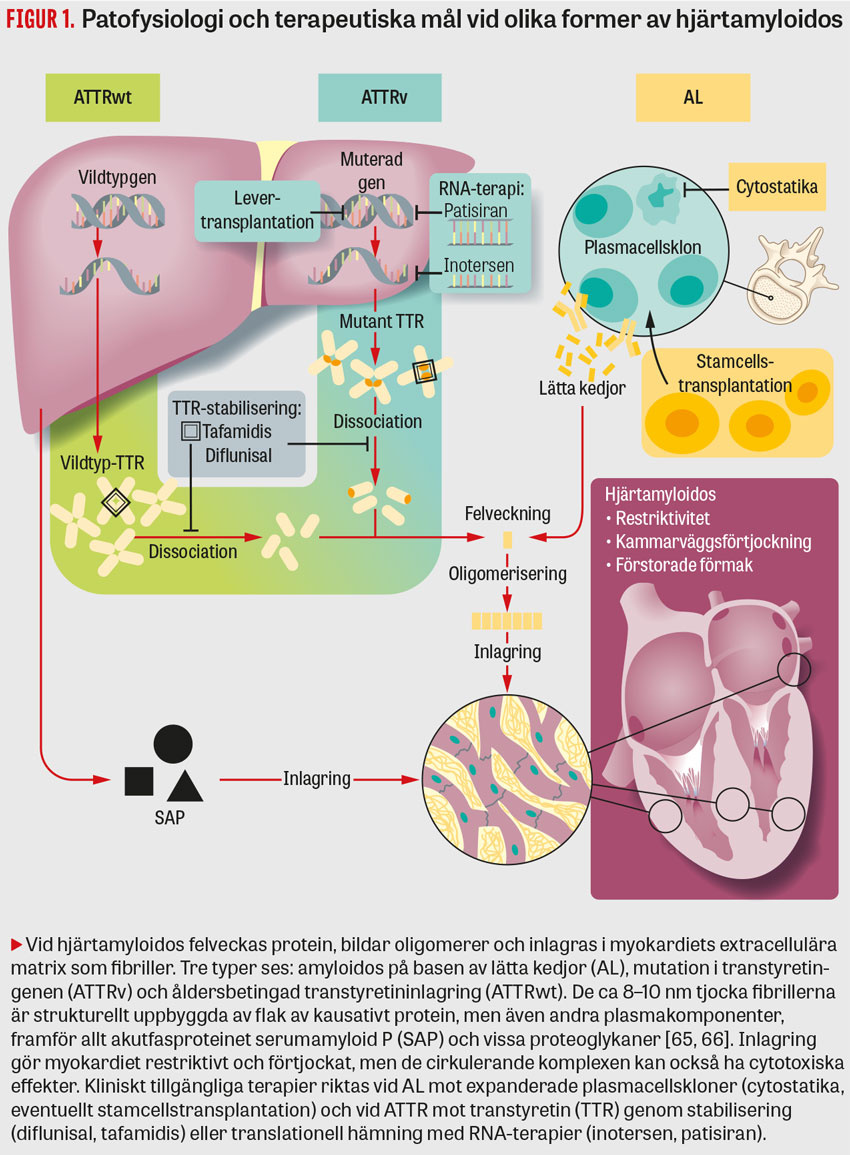
Mekanismer bakom amyloidos sammanfattas i Figur 1. Av de > 30 proteiner som beskrivits som orsaker till hjärtamyloidos dominerar två [3]: lätta immunglobulinkedjor (AL-amyloidos) och transtyretin (ATTR-amyloidos) (Tabell 1) [4].
Etiologin till AL-amyloidos utgörs av klonal plasmacellsdyskrasi vid till exempel monoklonal gammopati av oklar signifikans (MGUS), Waldenströms makroglobulinemi och multipelt myelom.
Hjärtamyloidos av ATTR-typ kan vara ärftlig (ATTRv [ATTR-variant]) eller förvärvad (ATTRwt [ATTR-vildtyp]). Vid båda formerna monomeriserar det tetrameriska plasmaproteinet transtyretin (TTR), varefter det felveckas och bildar aggregat (Figur 1) [5, 6]. ATTRv orsakas av mutationer i transtyretingenen och ärvs autosomalt dominant med varierande penetrans [7, 8]. Den vanligaste orsaken till ATTRv-amyloidos i Sverige är Skelleftesjukan, som också orsakar polyneuropati (Tabell 1). I avancerade stadier av ATTRv-amyloidos ses oftast både polyneuropati och hjärtamyloidos [5]. Vid ATTRwt föreligger ingen genetisk mutation [9], och symtombilden domineras av hjärtamyloidos [1]. Etiologin till detta tillstånd är fortfarande oklar.
Epidemiologi
Förekomsten av AL- och ATTR-amyloidos sammanfattas i Tabell 1. AL-amyloidos är den vanligast diagnostiserade formen av hjärtamyloidos med en årsincidens på 10 fall per 1 000 000 personår [10], varav ca 70–80 procent utvecklar hjärtamyloidos [11]. ATTRv-amyloidos är ovanligt, men ca 400 personer lever med diagnosen i Sverige. Förekomsten av hjärtamyloidos av ATTRwt-typ i befolkningen är okänd, men flera studier indikerar förhållandevis hög prevalens, bland annat vid hjärtsvikt med bevarad ejektionsfraktion (13 procent) [2], vid aortaklaffstenos (15 procent) [12, 13] och hos obducerade 85-åringar (25 procent) [14], och att tillståndet är underdiagnostiserat. En svensk studie av patienter med betydande vänsterkammarförtjockning och hjärtsvikt av oklar etiologi påvisade en prevalens av ATTRwt på knappt 20 procent inklusive redan kända patienter med ATTRwt [15]. Över hälften av fallen diagnostiserades i samband med studien.
Medelåldern vid diagnos är 65 år för AL-amyloidos och 77 år för ATTRwt-amyloidos, och vid såväl AL-amyloidos som ATTR-amyloidos är män kraftigt överrepresenterade (67 respektive 71–97 procent) [10, 11, 16-21].
Hjärtamyloidos har beskrivits som en av de kardiomyopatier som har sämst prognos [22], till stor del på grund av den dåliga prognosen vid hjärtamyloidos av AL-typ. Det är huvudsakligen graden av hjärtpåverkan som är avgörande för prognosen [10]. Nuvarande medianöverlevnad vid hjärtamyloidos är för AL 0,5–5 år beroende på grad av hjärtengagemang [11] och för ATTRwt ca 3,6 år [23]. Medianöverlevnaden utan behandling vid ATTRv är 7–11 år, och prognosen försämras kraftigt när symtom på hjärtamyloidos uppkommer [24].
Klinisk bild
Symtomen vid hjärtamyloidos är ospecifika och tillkommer progressivt, ofta över flera år. Det biventrikulära engagemanget medför att patienterna sällan utvecklar lungödem eller interstitiellt vätskeutträde i lungorna, utan oftare trötthet, träningsintolerans, muskeltrötthet samt en bild som vid högerkammarsvikt med underbensödem, ascites och leverstas. Vid hjärtamyloidos av AL-typ ses ett snabbare insjuknande, och ofta engageras flera organsystem, bland annat njurar [11, 25, 26]. Ortostatism förekommer frekvent vid både ATTR och AL [1]. Vanliga fynd vid ATTR är bilateralt karpaltunnelsyndrom, spinal stenos och senruptur, vilka ofta föregår symtomgivande hjärtsvikt med flera år [27]. Andra tecken som kan inge misstanke om hjärtamyloidos sammanfattas i Fakta 1.
Diagnostik
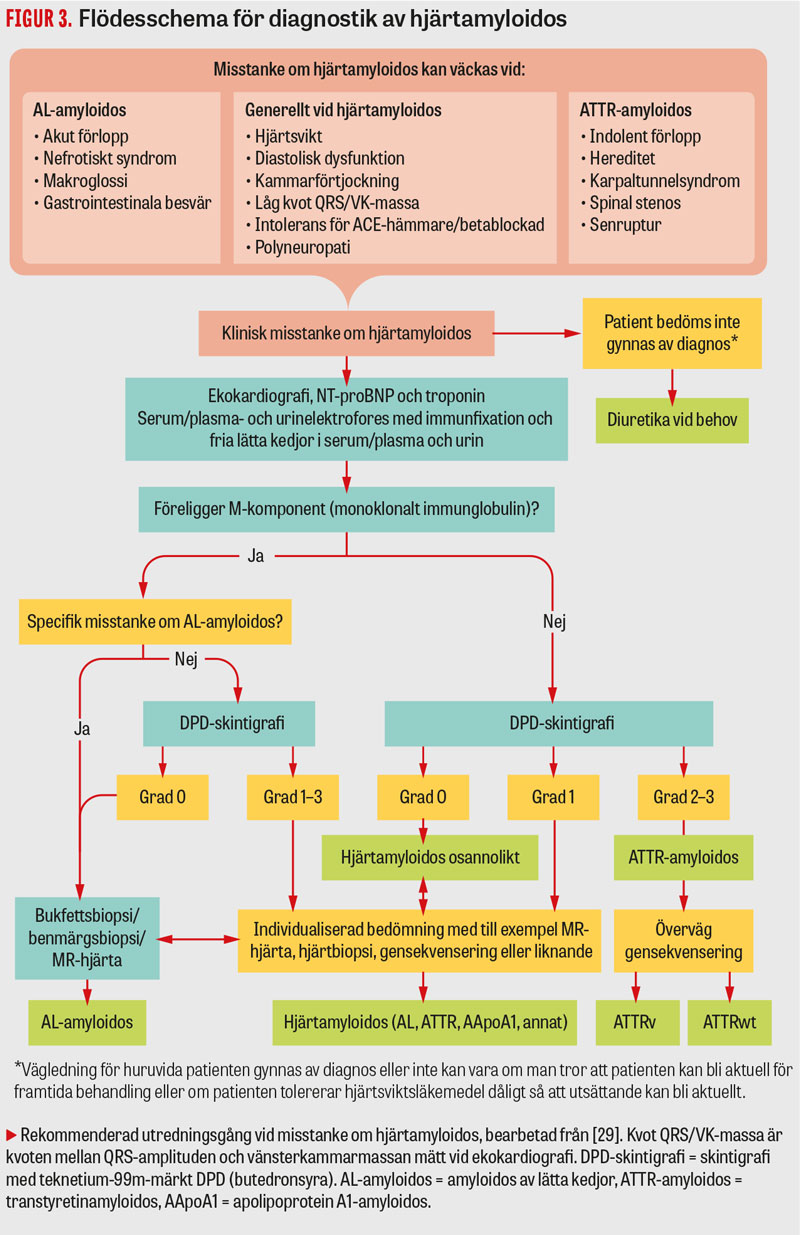
Hjärtamyloidos är på grund av sin ospecifika kliniska bild svårdiagnostiserad. Misstanke väcks inte sällan vid ekokardiografi (Figur 2). Förslag på utredningsgång presenteras i Figur 3. Initialt bör man på grund av dess aggressiva förlopp utesluta hjärtamyloidos av AL-typ, vilket görs biokemiskt. MGUS ses hos upp till 5 procent hos äldre [28] och förekommer frekvent som bifynd vid hjärtamyloidos av ATTR-typ, varför biopsi krävs för att AL-typen ska bekräftas. Om AL uteslutits bör skintigrafi göras med teknetium-99m-märkt DPD (butedronsyra) (som även används vid skelettskintigrafi), vilken har hög sensitivitet (> 99 procent) och specificitet (100 procent) för hjärtamyloidos av ATTR-typ om AL-amyloidos uteslutits [29]. För patienter med tidigt insjuknande i polyneuropati på grund av Skelleftesjukan är sensitiviteten emellertid låg även vid samtidiga hjärtbesvär [30]. Vid skintigrafin graderas isotopupptag (0–3) subjektivt [31] (Figur 2). Vid hjärtamyloidos av AL-typ kan visst kardiellt isotopupptag förekomma [29], varför biokemiskt uteslutande av AL-amyloidos är viktigt. Accidentellt fynd av misstänkt hjärtamyloidos vid skelettskintigrafi motiverar remiss till kardiolog. MR-hjärta kan användas som stöd i diagnostiken och har god specificitet (94 procent) men lägre sensitivitet (80 procent) för hjärtamyloidos [32]. Typiska fynd vid MR och ekokardiografi sammanfattas i Fakta 1. Sekvensering av transtyretingenen är det enda sättet att skilja ATTRv från ATTRwt. Sådan rekommenderas vid insjuknande före 70 års ålder och kan övervägas även vid diagnos senare.
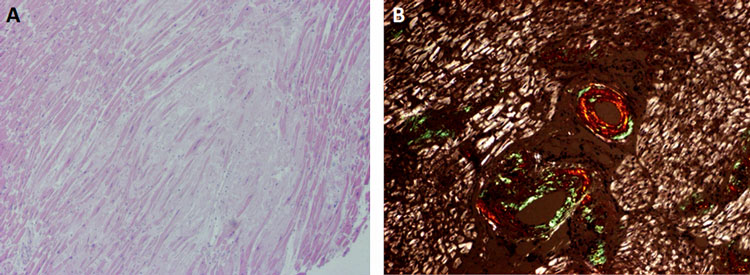
Vid misstanke om hjärtamyloidos av AL-typ rekommenderas biopsi av bukfett och benmärg, som kombinerat ger en sensitivitet på ca 85 procent [33]. Bukfettsbiopsi har en betydligt lägre sensitivitet för påvisande av ATTR-amyloidos [34, 35]. Hjärtbiopsi görs vid oklarheter i diagnostiken. Infärgning med kongorött ger en patognomon histologisk bild (Figur 4). För identifiering av subtyperna AL och ATTR krävs immunhistokemi eller masspektrometri [1].
Behandling
Behandlingen inriktas mot kausativt protein och symtomlindring. Amyloidinlagring leder till irreversibel skada på hjärtat, och kausativ behandling har bäst effekt om den sätts in tidigt i sjukdomsförloppet. Ingen generellt amyloidlösande behandling finns tillgänglig även om flera potentiella preparat har prövats [36-40], men fas 2- och 3-studier pågår [38].
För konventionella hjärtsviktsläkemedel saknas evidens, och betablockerare och ACE-hämmare/angiotensinreceptorblockerare kan ge hypotoni och försämring på grund av fixerade och reducerade slagvolymer. Vid behov av frekvensreglering kan försiktig dostitrering av betablockerare alternativt amiodaron prövas [1]. Kalciumkanalblockerare och digoxin anses relativt kontraindicerade [1, 41]. Diuretika, särskilt loopdiuretika och mineralkortikoidreceptorantagonister, rekommenderas för symtomlindring [1]. Pacemaker ska användas frikostigt på grund av betydande risk för hjärtblockering. ICD (implanterbar defibrillator) kan övervägas som sekundärprevention vid ventrikulära arytmier och förväntad överlevnad > 1 år, särskilt hos patienter med kausativ behandling [42]. Vid uttalad aortastenos och hjärtamyloidos kan perkutant klaffbyte vara av värde [43]. I palliativ fas kan i selekterade fall peritonealdialys användas för ödemkontroll samt kontakt med palliativ enhet vara av stort värde, om inte förr så vid återkommande behov av inneliggande vård.
AL-amyloidos. Vid AL-amyloidos bör patienten skyndsamt remitteras till hematologisk specialist för behandling riktad mot underliggande plasmacellsdyskrasi. I Sverige rekommenderas, vid låg risk (utan hjärtengagemang), aggressiv cytostatikabehandling (melfalan i hög dos) med efterföljande autolog stamcellstransplantation, eventuellt föregånget av induktionsbehandling. Hos högriskpatienter (NYHA-klass III–IV) och patienter över 65–70 års ålder ges bortezomib, steroid och eventuellt melfalan. Vid hjärtamyloidos med intermediär risk (NYHA-klass I–II) rekommenderas induktionsbehandling, för att patienter vid god organrespons ska kunna bli aktuella för högdosbehandling och autolog stamcellstransplantation [44]. I utvalda fall kan hjärttransplantation övervägas, men för flertalet är varken transplantation eller autolog stamcellstransplantation aktuell. Den monoklonala antikroppen daratumumab används i Sverige vid behandling av multipelt myelom och har i småskaliga studier visat god effekt även vid AL-amyloidos [45].
ATTR-amyloidos. Vid ATTR-amyloidos inriktas behandlingen mot transtyretinets produktion och stabilitet. Levertransplantation kan övervägas vid ATTRv-amyloidos [46, 47], och i selekterade fall kan ATTRv med hjärtamyloidos bli föremål för kombinerad hjärt- och levertransplantation [48, 49]. De senaste åren har två transtyretinstabiliserande läkemedel (diflunisal och tafamidis) och två mRNA-inhiberande läkemedel (patisiran och inotersen) visat gynnsamma effekter vid ATTR-amyloidos i kliniska studier [50-53].
Både diflunisal och tafamidis har i randomiserade studier visats minska sjukdomsprogress och bevara livskvalitet hos patienter med polyneuropati på grund av ATTRv [50, 51].
Avseende hjärtamyloidos av ATTR-typ visades tafamidis i ATTR-ACT-studien från 2018 [54] ge 30 procents reduktion av såväl mortalitet som sjukhusinläggningar jämfört med placebo under 2,5 år. Inga särskilda biverkningar rapporterades. Evidensen för diflunisal begränsas till mindre fallserier [55, 56]. Tafamidis är godkänt för behandling av hjärtamyloidos, men är mycket kostsamt [57] och ännu inte förmånsberättigat. Dispens för behandling med diflunisal beviljas i normalfallet inte eftersom tafamidis är godkänt. Internationella riktlinjer rekommenderar användning av tafamidis vid hjärtamyloidos av ATTR-typ [58].
De mRNA-inhiberande läkemedlen orsakar nedbrytning av transtyretin-mRNA och båda har visats gynnsamma vid polyneuropati [52, 53]. Kliniska studier vid hjärtamyloidos pågår.
Nivåstrukturering och uppföljning
Misstanke om hjärtamyloidos väcks vid symtom och typiska kliniska fynd enligt Fakta 1 och handläggs enligt Figur 3. Vid misstanke om hjärtamyloidos av AL-typ ska akut remiss skickas till hematologisk enhet som ansvarar för behandlingen i samråd med kardiolog.
Nya framsteg inom terapi för hjärtamyloidos av ATTR-typ aktualiserar ett behov av genomtänkt diagnostik eftersom de behandlingar som kan bli godkända har mycket höga beräknade årskostnader (> 1 miljon kronor/patient/år), varför det troligen inte kommer att anses hälsoekonomiskt försvarbart att behandla alla patienter. Konventionella hjärtsviktsterapier och behandling av förmaksflimmer i denna grupp bör hanteras med försiktighet. Vi rekommenderar av dessa skäl att behandling av hjärtamyloidos sker i samråd med specialiserade enheter, företrädesvis vid universitetssjukhus, vilket är förenligt med att hjärtamyloidos ingår bland de områden som utreds av Socialstyrelsen för nationell nivåstrukturering [59].
Klinisk uppföljning syftar till optimering av sviktbehandling, eventuell amyloidspecifik behandling samt understödjande vård och palliation. För hjärtamyloidos av AL-typ baseras uppföljningen vid hematologienheter på särskilda organresponskriterier och analys av cirkulerande lätta kedjor [44]. För hjärtamyloidos av ATTR-typ saknas långtidserfarenhet av nya behandlingar, men regelbunden uppföljning på halvårsbasis avseende NT-proBNP, troponin, njurfunktion och funktionsklass har visats ha prognostiskt värde [17, 23]. Värdet av uppföljning med ekokardiografi med longitudinell deformationshastighet (strain rate), skintigrafi, PET och MR är föremål för vetenskaplig utvärdering. Utöver att uppföljningen koncentreras till specialiserade centrum är det angeläget att samla erfarenhet och långtidsuppfölja nya terapier på nationell nivå genom registerföring. Sådana register är under utarbetande.
Konklusion
Vi har beskrivit att hjärtamyloidos troligen är ett underdiagnostiserat tillstånd som obehandlat har dålig prognos, sammanfattat kunskapsläget och givit rekommendationer för diagnostik och behandling. Vi vill särskilt uppmärksamma typiska fynd som inger misstanke om hjärtamyloidos, moderna diagnostiska modaliteter samt att bruket av nya terapier och råd avseende hantering av konventionell sviktmedicinering bör ske i samråd med specialiserade enheter, företrädesvis universitetssjukhus. Det är vår förhoppning att dessa rekommendationer ska bidra till ökad detektion samt ett förbättrat och mer enhetligt omhändertagande vid hjärtamyloidos.
Potentiella bindningar eller jävsförhållanden: Björn Pilebro har deltagit i rådgivande kommittéer och föreläst för Pfizer och Alnylam avseende diagnostik och behandling av hjärtamyloidos; arvoden har gått till arbetsgivare. Per Eldhagen har deltagit i rådgivande kommitté samt erhållit föreläsningsarvoden för Pfizer och Alnylam avseende diagnostik och behandling av hjärtamyloidos. Gerhard Wikström har deltagit i rådgivande kommitté för Pfizer, Astra Zeneca, Vifor Pharma samt erhållit föreläsararvoden från Orion Pharma och Astra Zeneca. Gustav Smith har deltagit i rådgivande kommitté samt erhållit föreläsningsarvoden för Pfizer avseende diagnostik och behandling av hjärtamyloidos.
Fakta 1. Fynd som inger misstanke om hjärtamyloidos
Kliniska fynd
- Oftast ålder > 65 år, ofta manligt kön
- Hereditet för Skelleftesjukan
- Neuropati
- Karpaltunnelsyndrom, särskilt bilateralt
- Biceps- eller akillessenruptur
- Periorbitala blödningar och makroglossi
- Spinal stenos
- Förhöjt NT-proBNP och persisterande låggradig förhöjning av troponin utan dynamik
- Intolerans mot betablockad och ACE-hämmare eller angiotensinreceptorblockerare
- Låga QRS-amplituder på EKG i förhållande till kammarväggstjocklek vid ekokardiografi
- Förmaksflimmer, främre fascikelblock och AV-block
Ekokardiografiska fynd
- Kammarväggsförtjockning i såväl vänster som höger kammare och förmaksseptum; riktmärke diastolisk septumdiameter > 14 mm.
- Generellt hyperekogent, ibland »sparkling«, myokardium
- Diastolisk dysfunktion
- Förmaksdilatation
- Reducerad slagvolym och global longitudinell deformation (strain) som ofta är relativt bevarad apikalt
- Aortastenos (låg klaffarea) med liten tryckskillnad över klaffen och liten slagvolym
Fynd vid MR-hjärta
- Koncentrisk kammarväggsförtjockning
- Förmaksdilatation och septumförtjockning
- Förhöjd extracellulärvolym vid T1-mappning
- Generell eller fläckvis gadoliniumförstärkning
- Vid kontrastanalys nedsläcks myokardsignalen före eller samtidigt som blodsignalen nedsläcks
Fynd vid skelettskintigrafi
- Ökat kardiellt isotopupptag (teknetium-99m-märkt DPD [butedronsyra], PYP [pyrofosfat], HDMP [hydroximetylendifosfonat])



![Figur 2. Bilddiagnostik vid hjärtamyloidos. Transtorakal ekokardiografi från apikal fyrkammarvy visar symmetrisk förtjockning av myokardium (överst) i såväl vänster som höger kammare och förmaksseptum samt högekogent (»sparkling«) myokardium. Nedre bilder är från skintigrafisk undersökning av fyra olika patienter med teknetium-99m-märkt DPD (butedronsyra). Från vänster ses myokardiellt upptag subjektivt graderat enligt [31]: 0 (icke synligt upptag), 1 (mindre upptag än skelett), 2 (upptag som skelett) och 3 (mer upptag än skelett). Bilder från Carl Meurling, Lund, och Björn Pilebro, Umeå.](https://lakartidningen.se/wp-content/uploads/2021/04/wFig2.jpg)