Lungultraljud har visat god precision och reproducerbarhet som diagnostiskt komplement till klinisk undersökning vid akut dyspné.
Lungultraljud utförs bedside och är relativt lätt att lära sig, men kräver träning och strukturerat utförande för att inte resultera i felaktiga diagnoser.
Lungultraljud baseras till största delen på tolkning av artefakter. Vid en normalt luftfylld lunga bildas horisontella reverberationsartefakter kallade A-linjer. Vid extracellulärt vätskeutträde uppstår vertikala B-linjer, vilka reducerar de normala A-linjerna.
Lungultraljud med räkning av antal B-linjer har visat sig vara lovande för värdering av interstitiellt ödem vid hjärtsvikt, men ytterligare studier behövs.
Ultraljud är en medicinsk bildgivningsmetod som har fått stort genomslag inom många kliniska områden. Hjärtat var det första organ där metoden fick klinisk användbarhet genom pionjärarbete av fysikern Hellmuth Hertz och kardiologen Inge Edler från Lund, följt av obstetriska och gynekologiska ändamål, andra bukorgan och blodkärl. Lungan ansågs länge vara utom räckhåll för ultraljudsdiagnostik, eftersom den höga lufthalten medför att ultraljudet inte reflekteras. Dock har det visat sig att de tekniska artefakter som bildas både i den friska lungan men framför allt vid sjukdomar med minskad lufthalt kan användas för att diagnostisera tillstånd såsom interstitiellt vätskeutträde, pneumotorax och lunginflammation. Ultraljud har också länge använts för att värdera pleuravätska och vägleda pleurocentes.
Här vill vi ge en överblick över möjligheter med lungultraljud och särskilt framhålla lungultraljud som en lovande metod för bedömning av akut dyspné på akutmottagningen samt värdering av kvarvarande extracellulärt lungvatten hos inneliggande patienter med akut dekompenserad hjärtsvikt och hos patienter med kronisk hjärtsvikt som diuretikabehandlas i öppenvårdssituationen. Vi vill också belysa att metoden, som är lättillgänglig och relativt lätt att lära sig, har både begränsningar och svårigheter.
Medicinskt ultraljud – en kort historik
Bröderna Curie i Paris upptäckte piezoelektriciteten på 1880-talet [1]. En piezoelektrisk kristall ändrar form, börjar vibrera i hög hastighet och producerar ett ultraljud när den utsätts för varierande elektrisk energi. Ljudet reflekteras när det träffar ett objekt, och avståndet till det undersökta objektet kan då beräknas. Ibland studsar ekot fram och tillbaka mellan två ekotäta strukturer och ger upphov till flera bilder av samma struktur men på olika djup, så kallad reverberation. Den första medicinska användningen av ultraljud skedde i Lund under 1940-talet inom toraxkirurgin, där mitraliskirurgi med dilatation av mitralisstenos var ett centralt ingrepp. Resultaten var goda hos de patienter som hade en isolerad stenos men mindre lyckade hos de med samtidig insufficiens. Ansvarig för den preoperativa utredningen med hjärtkateterisering var kardiologen Inge Edler, som var intresserad av icke-invasiva alternativ. Tillsammans med fysikern Hellmuth Hertz utvecklade Edler den medicinska ultraljudstekniken inom kardiologin. Användningen inom andra medicinska discipliner tog snart fart och utvecklades parallellt med ekokardiografin i Lund, först av neurokirurgen Lars Leksell som tog fram ekoencefalografin, som under många år var rutinundersökning för patienter med misstänkta intrakraniella blödningar, följt av obstetrikern Bertil Sundén som utvecklade ultraljudets roll inom fosterdiagnostiken och publicerade den första ultraljudsbilden av tvillingar 1962 [2, 3].
Lungan ansågs före 90-talet inte åtkomlig för ultraljudsdiagnostik, eftersom lufthalten i den normala lungan absorberar ultraljudsvågorna och det bara är pleura som ger upphov till ett eko. I en fallbeskrivning från 80-talet skapades begreppet »kometsvansartefakt« (comet tail artefact), ett reverberationsfenomen som noterades vid ultraljudsundersökning av en patient med skottskada i levern [4]. Fenomenet undersöktes vidare inom intensivvården och beskrevs vid lungultraljud hos patienter med radiologiskt diagnostiserad lungsjukdom av Lichtenstein 1996 och kallades då lungkometer [5]. Sedan dess har lungultraljudmetoden utvecklats, och lungkometerna kallas enligt internationell konsensus i stället för B-linjer [6]. När lufthalten i lungan minskar vid olika sjukdomstillstånd kan ultraljudet till viss del reflekteras och ger då en bild. I takt med att lungan blir mindre luftförande uppkommer mer och mer detaljerade bilder och i en konsoliderad lunga som vid till exempel pneumoni kan lungparenkymet visualiseras helt.
Ultraljudsundersökning som ett komplement till klinisk undersökning har på senare tid fått allt mer utrymme, och patientnära ultraljud (POCUS, point of care-ultraljud) ingår i de europeiska gemensamma kunskapsbaserna för akutsjukvård sedan 2017 och för invärtesmedicin sedan 2019 [7]. Som del i POCUS används lungultraljud för diagnostik vid akut dyspné och respiratorisk insufficiens. Särskilt under coronaviruspandemin framhålls nu potentialen av POCUS för att minska risken för smittspridning samt påskynda den initiala diagnostiken på akutmottagningen. POCUS ska då utföras av en och samma kliniker med bärbar ultraljudsapparat under plastskydd för att ersätta såväl undersökning med stetoskop (svårare att sterilisera) som lungröntgen (transport av patient och ny lokal att smittstäda) [8].
Utförande av lungultraljud
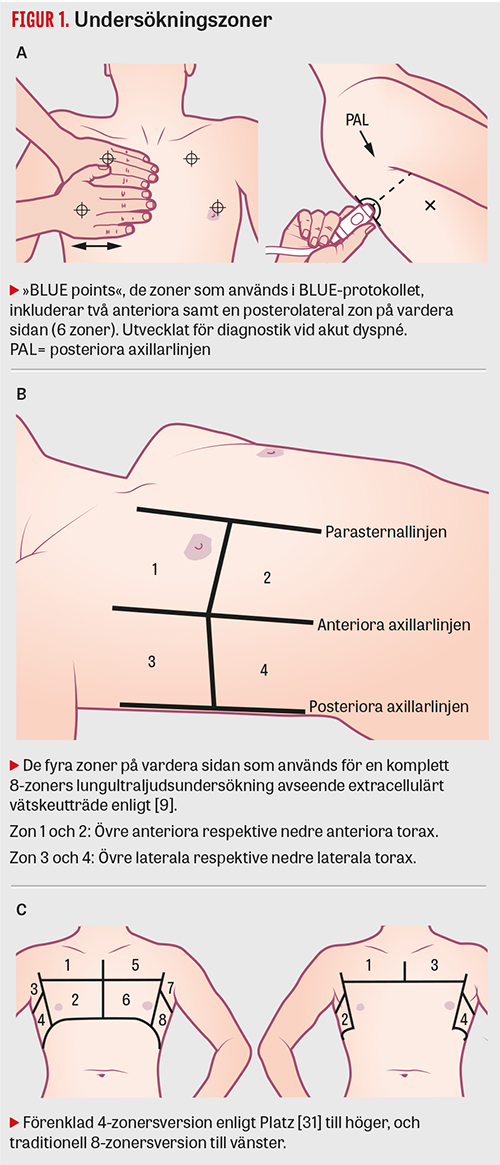
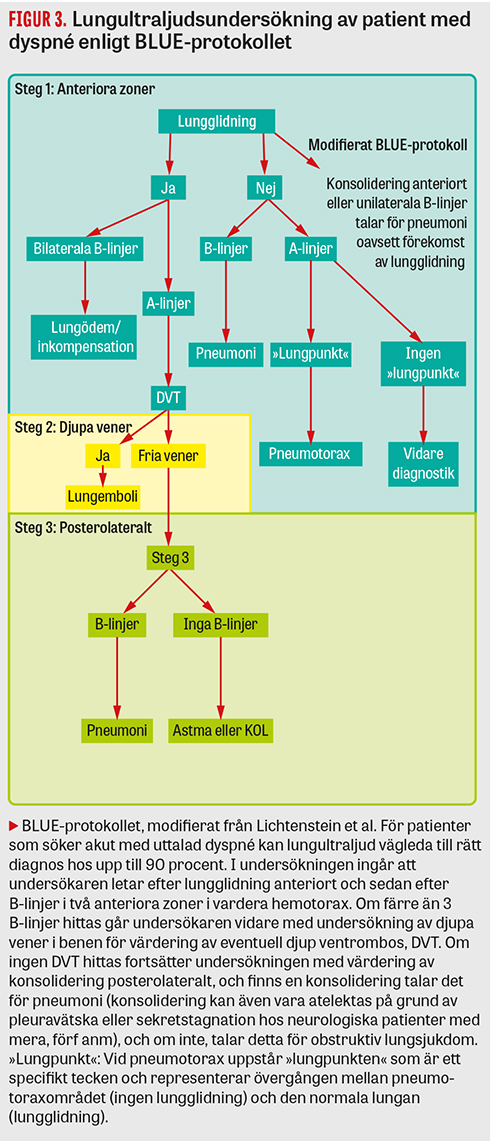
Lungultraljud kan utföras med patienten sittande eller liggande [9] och inleds med val av ultraljudssändare (prob) och justering av fokusdjup. Höga ultraljudsfrekvenser ger bättre upplösning men absorberas lättare och når därför inte lika djupt. När enbart pleura ska avbildas kan således en linjär kärlprob (8–12 MHz) användas eftersom den ger högre ytupplösning, och fokusdjupet ställs då kring ca 5 cm. För övrig undersökning av lungan ställs fokusdjupet på 18 cm, och en bukprob med låg frekvens (kurvlinjär/konvex, 3–5 MHz) är att föredra, eftersom den ger bättre vävnadspenetration. En hjärtprob eller mikrokonvex prob (»phased array«, 3,5–4 MHz) kan också användas; den har bäst åtkomlighet interkostalt på grund av litet avtryck och kan på så vis bättre undvika revbensskuggor, och har samtidigt god penetration. Proben placeras interkostalt i sagittal- eller transversalplanet, och lungytan undersöks systematiskt enligt specifika zoner (Figur 1). Antalet zoner som granskas varierar mellan 4 och 28 i de flesta publicerade studier. Lichtenstein publicerade 2008 en utredningsalgoritm (BLUE protocol) baserad på 6 zoner [10.] Optimalt antal zoner är relaterat till frågeställningen, där en mer noggrann avsökning av parenkymet krävs framför allt för pneumoni, samt till undersökningssituationen: vid värdering av oselekterade patienter på akutmottagningen kan färre zoner vara att föredra och användas med god sensitivitet och specificitet.
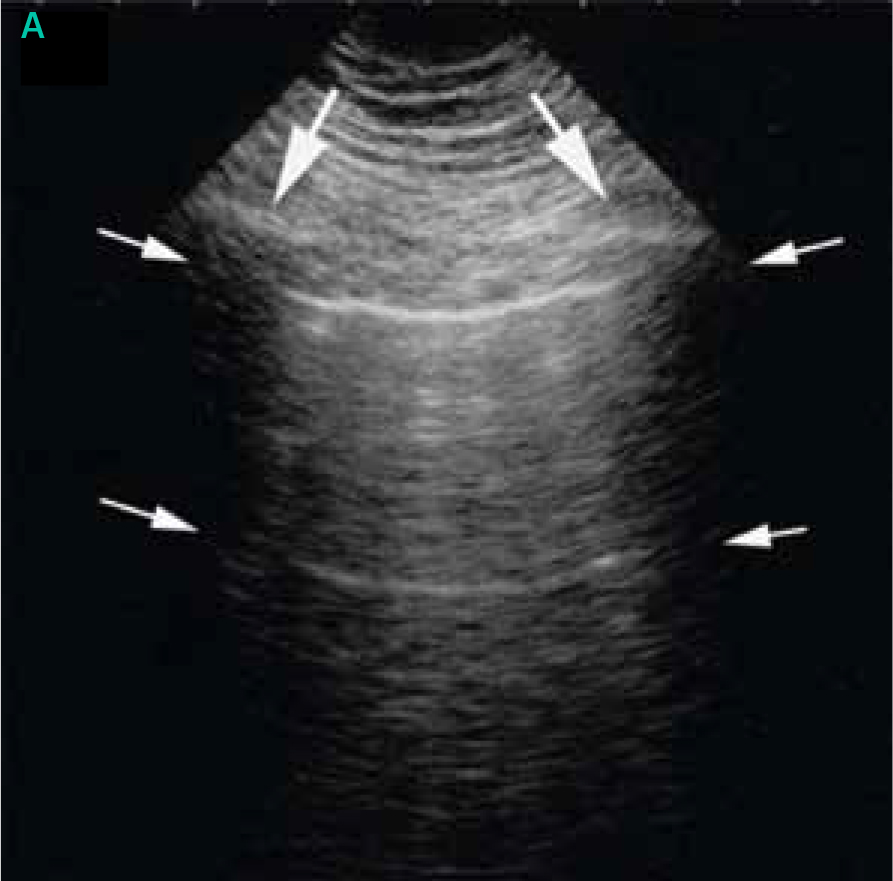
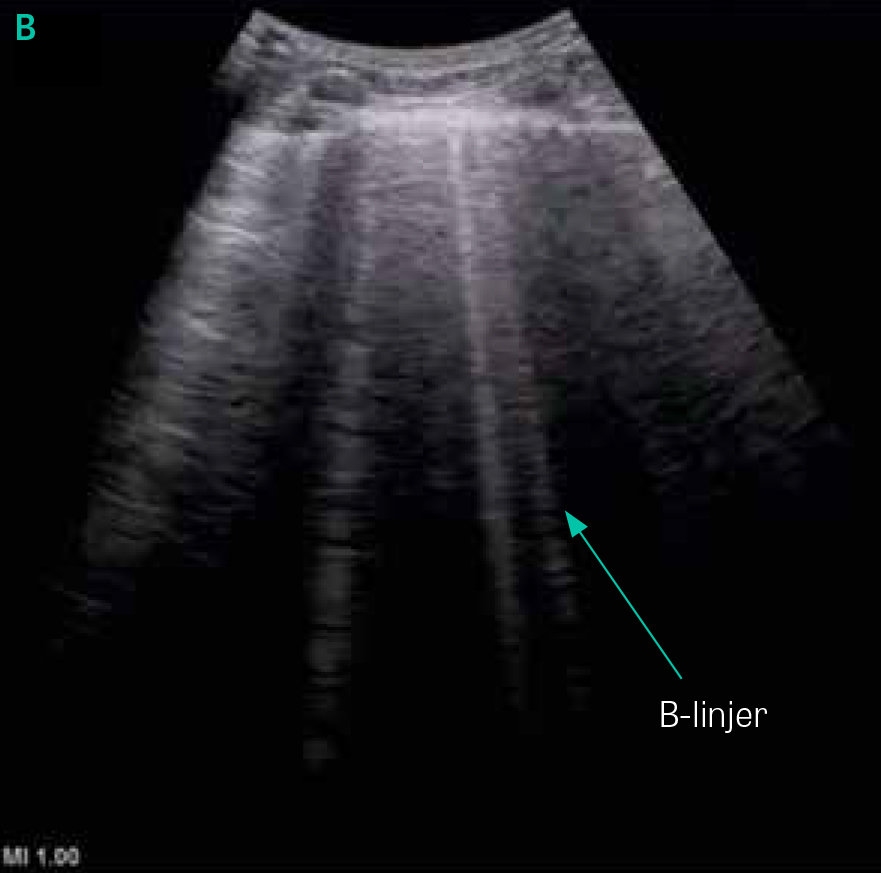
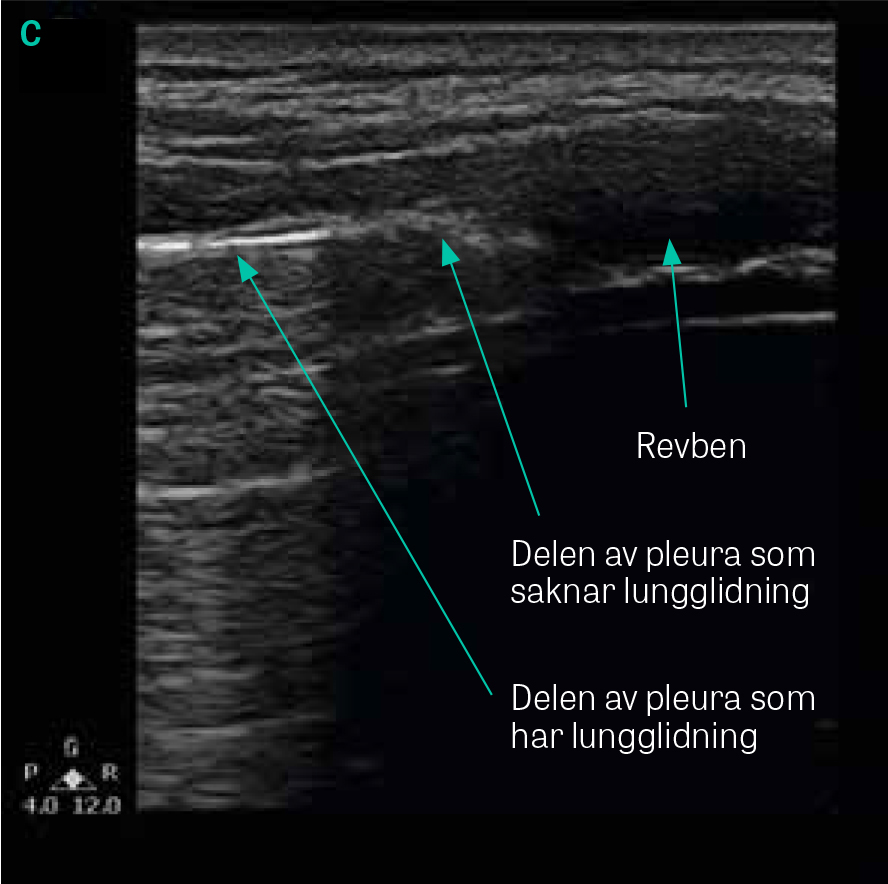
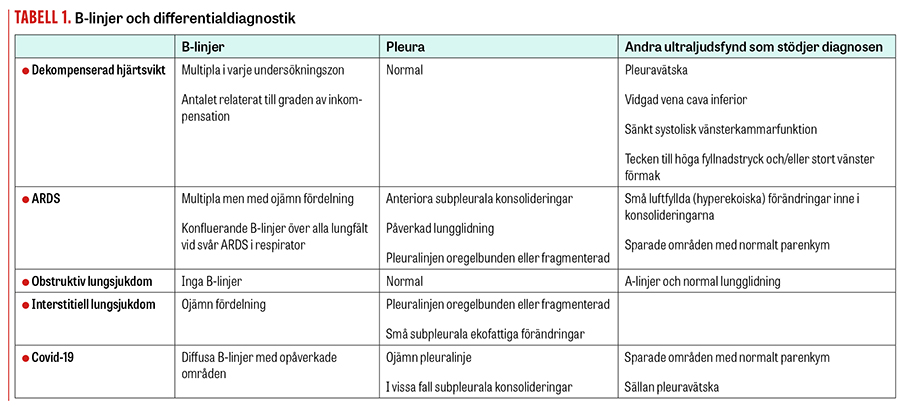
Tolkningen av lungultraljud baseras till största delen på artefakter, och en normal undersökning innefattar två fynd: lungglidning (»lung sliding«) samt A-linjer [9]. När proben placeras vinkelrätt mot revbenen identifieras pleuralinjen genom det så kallade fladdermustecknet (»bat sign«), där tre ekogena linjer motsvarande utsidan av två revben och pleuralinjen däremellan tillsammans bildar någonting som kan liknas vid en flygande fladdermus (Figur 2). Förekomst av lungglidning noteras därefter. Lungglidning är inte någon artefakt utan den rörelse som ses i takt med andningen i den normalt luftfyllda lungan. Förutsättningen för lungglidning är en intakt pleura utan luft mellan pleurabladen; den ses normalt som ett glitter över pleuralinjen då det viscerala pleurabladet glider längs det parietala. Förekomst av lungglidning utesluter pneumotorax i det undersökta området. Frånvaro av lungglidning kan förekomma även vid adherenser, pleurodes, omfattande lobär konsolidering och frånvaro av lungventilation (t ex felintubation). Ibland kan man upptäcka den för pneumotorax patognomona så kallade lungpunkten (lung point) där ett område med lungglidning förekommer precis bredvid ett område utan lungglidning (Figur 2) [11]. A-linjer är horisontella artefakter som skapas då luften reflekterar ultraljudsvågorna upprepade gånger. Då maskinmjukvaran skapar 2D-bilden utifrån den tid det tar för ljudet att återvända till proben, resulterar reflektionen i att flera artefakter liknande pleuralinjen framträder på samma avstånd från varandra som den riktiga linjen från proben. A-linjer är ett normalfynd (Figur 2). B-linjer är vertikala hyperekogena artefakter som ses då lufthalten i lungan minskar och sannolikt uppstår då interlobärsepta är förtjockade och ödematösa och därför ger upphov till ett eko (Figur 2) [9]. B-linjer startar vid pleuralinjen och sträcker sig hela vägen ned till slutet av skärmen utan att minska i styrka, suddar oftast ut A-linjerna och rör sig i takt med andningen. Djupet på skärmen är viktigt vid beskrivning av B-linjer; oftast anges 18 cm djup. Ju mindre luft i lungan, desto fler B-linjer, vilka således ökar med ökande inkompensation. Det finns internationell konsensus om att 3 eller fler B-linjer i ett revbensspatium definierar »interstitiellt syndrom«, ett samlingsnamn för lungödem, interstitiell pneumoni/pneumonit och lungfibros [6]. Bilaterala B-linjer ses vid dekompenserad hjärtsvikt, ARDS (akut svår lungsvikt), interstitiella lungsjukdomar och har nyligen även beskrivits vid covid-19 (Tabell 1). B-linjer finns även vid till exempel pneumoni, men då oftast unilateralt. Enstaka B-linjer kan även ses i nedre delen av lungorna hos friska individer [6, 11]. Det är viktigt att särskilja B-linjer från Z-linjer, som är en vanlig artefakt som ses hos >80 procent och är helt utan patologisk valör. Z-linjer är, precis som B-linjer, vertikala och ser ut att börja vid pleuralinjen, men de fyller inte hela skärmen, är mer diffusa, suddar inte ut A-linjer och rör sig inte i takt med andningen.
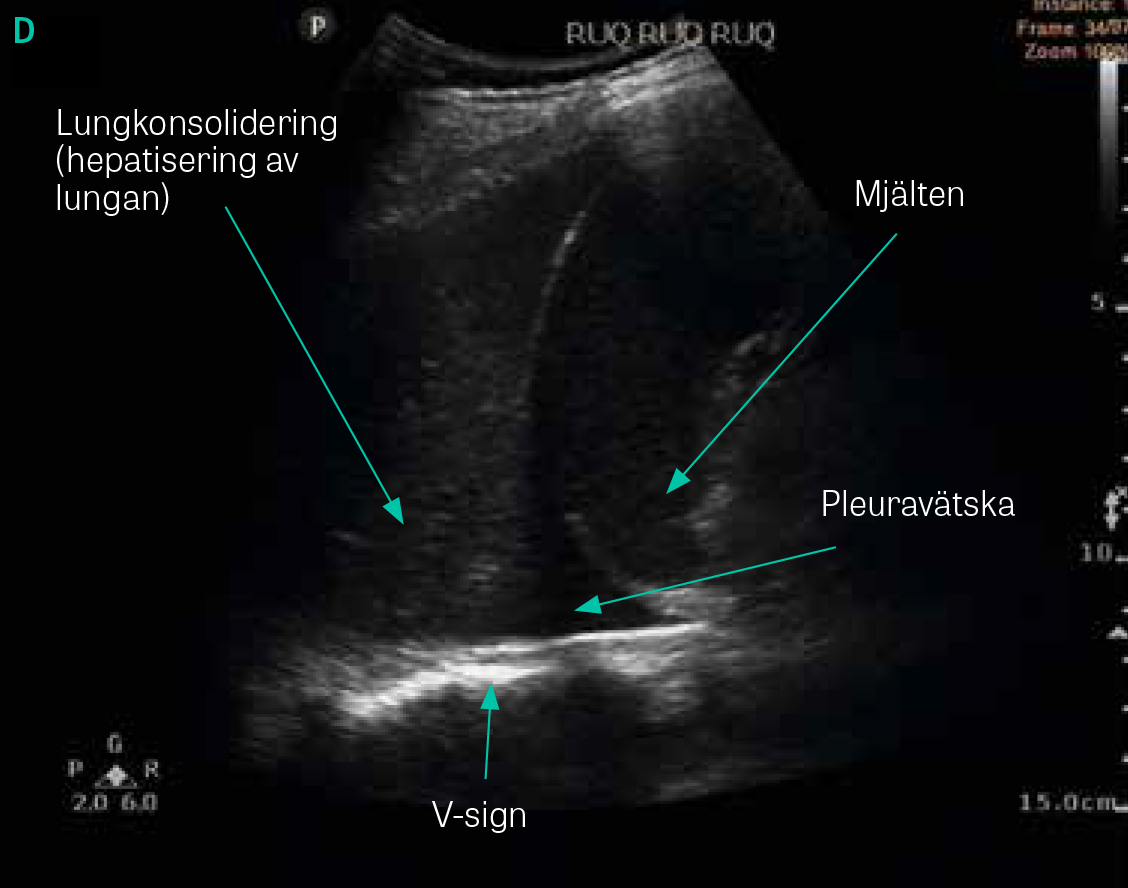
Pleuravätska syns oftast som ett svart område kranialt om diafragman, men vid hemotorax kan vätskan (blodet) ha ett grått och inhomogent utseende. En atelektatisk del av lungan kan ofta skymtas i vätskan. Konsoliderad lunga har ett grått utseende med liknande ekogenicitet som levern, varför fenomenet kallas hepatisering av lungan. Vid pleuravätska eller lungkonsolidering penetrerar ultraljudet lättare och ända till kotpelarna, vilka då kan synas kranialt om diafragman (så kallat »vertebral sign« eller »V-sign/spine sign«) (Figur 2).
Lungultraljud framhålls som en lätt metod att lära sig och implementera (en dags handledd undersökning eller 25 undersökningar). Samtidigt finns flera studier som pekar på divergerande resultat mellan undersökare och olika prober, ibland även varierande resultat då samma undersökare utför eller tolkar samma undersökning på nytt [12,13]. Det faktum att lungultraljudsundersökningar sällan sparas och granskas har också gett upphov till en del kritik. Generellt är det viktigt att vara medveten om att lungultraljud inte utesluter patologi som inte når pleura; detta är särskilt viktigt då det gäller konsolideringar, eftersom dessa kan finnas medialt i lungan och ibland vara omgivna av luftfylld lunga och därmed svåra att se.
Vetenskaplig erfarenhet vid diagnostik av dyspné
Tolkning av fynd enligt BLUE-protokollet illustreras i Figur 3. Med denna algoritm kunde lungultraljud bidra till en korrekt bedside-diagnos hos drygt 90 procent av de 260 patienter med akut dyspné som inkluderades i studien [10]. En metaanalys från 2019 med fokus på prestandan av lungultraljud vid akut diagnostik visade sensitivitet på 85–95 procent och specificitet på 75–90 procent för pneumoni, sensitivitet på 78 procent och specificitet på 94 procent för KOL/ astma samt sensitivitet på 75–90 procent och specificitet på 80-90 procent för akut hjärtsvikt [14]. Flera studier som utvärderar en kombinerad undersökning med lungultraljud + översiktligt eko +/- bedömning av vena cava inferior (vissa studier begränsade sig till hjärta + lungor utan vena cava inferior) visar att denna variant av POCUS presterar bättre än enbart lungultraljud, med både sensitivitet och specificitet på 84–100 procent för akut hjärtsvikt [15-18]. Viktigt att nämna i sammanhanget är att detta gäller för patienter som inte är i respirator eller har pågående icke-invasiv ventilation eller kontinuerligt positivt luftvägstryck. Vena cava inferior-diametern går inte att bedöma vid övertrycksandning.
Dekompenserad hjärtsvikt – kliniska utmaningar
Ett område där lungultraljud kan ha potentiellt mycket stor betydelse och utbredd användning kan vara motiverad är handläggning av hjärtsvikt. Hjärtsvikt är ett vanligt tillstånd med en prevalens på 2–3 procent i befolkningen och en av de vanligaste orsakerna till behov av sjukhusvård. Akut försämring (dekompensation) och sjukhusinläggning vid hjärtsvikt orsakas av olika faktorer som ökar belastningen på hjärtat, resulterande i ökade intrakardiella tryck, vilka fortplantas till lungvenerna och orsakar vätske- och saltretention samt extravasering av vätska till lunginterstitiet, vilket kan leda till fulminant lungödem [19]. En stor andel, ca 20–30 procent, av de patienter som vårdats för akut dekompenserad hjärtsvikt återinläggs inom 2 månader [20]. En bidragande faktor till detta är svårigheten att kliniskt uppskatta ökade lungvenstryck, vätskeretention och vätskeutträde samt begränsad kunskap om behandlingsmål baserat på sådana parametrar, varför patienterna inte sällan skrivs hem innan de är färdigbehandlade. I en studie där kliniska symtom jämfördes med invasiva hemodynamiska mätningar hos 50 patienter med uttalat sänkt vänsterkammarfunktion (ejektionsfraktion 18 ± 6 procent) saknades de klassiska symtomen på dekompenserad hjärtsvikt (lungrassel, perifera ödem och halsvensstas) hos 18 av 43 patienter med förhöjt lungvenstryck estimerat med inkilningstryck (PAWP, pulmonary arterial wedge pressure) [21]. Samtidigt som det är svårt att bedöma lungvenstryck och lindrigare grad av vätskeutträde i lungorna är det viktiga parametrar; patienter som hade kvarvarande inkompensation bedömt med en implanterad tryckmätare i lungartären vid hemgång har rapporterats återinläggas i högre utsträckning, och diuretikabehandling baserad på sådan mätning resulterar i mindre behov av sjukhusvård [22-24]. Intrakardiella tryck kan också uppskattas med ekokardiografi [25] eller MR [26] och kräver inte hjärtkateterisering, men det är oklart huruvida lungvätska eller intrakardiella tryck är mest informativt med avseende på försämring. Höga intrakardiella tryck är relaterade till ökad mortalitet och kan, men måste inte, ge upphov till vätskeutträde i lungorna med resulterande interstitiellt och alveolärt ödem – och det kan dröja dagar till veckor efter det att fyllnadstrycken börjat stiga och vätskeutträdet i lungorna påbörjats innan kliniska symtom uppkommer [22]. Flera metoder för bedömning av extracellulärt lungvatten finns tillgängliga, baserade på t ex DT, MR, termodilution eller PET, men eftersom en metod behöver vara allmänt tillgänglig och möjlig att utföra i akutsituationen har lungröntgen behållit sin plats som huvudsaklig undersökningsmetod för bedömning av inkompensation och lungödem [27, 28]. Lungröntgen är dock ett trubbigt instrument, och inkilningstrycket kan vara förhöjt utan att radiologiska fynd på vätskeutträde föreligger [29].
Vetenskaplig erfarenhet vid hjärtsvikt
Det finns flera studier avseende lungultraljuds användbarhet för bedömning av akut dekompensation hos patienter med hjärtsvikt, och ett mindre antal som tyder på att ökat antal B-linjer hos hjärtsviktspatienter vid utskrivning och i öppenvården ökar risken för återinläggning och mortalitet. I en systematisk översikt som inkluderade 6 studier (n = 1 827) där lungultraljud jämfördes med lungröntgen hos patienter med akut dekompenserad hjärtsvikt uppvisade lungultraljud bättre sensitivitet (relativ risk 1,2; 95 procents konfidensintervall, 1,08–1,34) och likvärdig specificitet [30]. Platz et al genomförde också en prospektiv kohortstudie vid två centrum av 349 patienter med akut dekompenserad hjärtsvikt [31]. Alla patienter genomgick lungultraljud (4 zoner i stället för ordinarie 8 eller 16) i anslutning till sjukhusinläggning, och av dessa genomgick 132 även lungultraljud inför hemgång. Patienter som hade ≥10 B-linjer vid ankomst uppvisade ett fyrfaldigt större behov av inotropt stöd. De patienter som hade högre antal B-linjer vid undersökningen i anslutning till hemgång uppvisade ökad risk för död och återinläggning. Samma forskargrupp följde en mottagningskohort med 185 hjärtsviktspatienter med lungultraljud vid rutinbesök [32]. Av dessa patienter hade 32 procent ≥3 B-linjer, och 81 procent av dessa hade inga auskultatoriska fynd. Under uppföljningstiden nådde 27 procent av samtliga patienter det primära utfallet (död eller återinläggning), och den tertil som uppvisade ≥3 B-linjer hade en fyrfaldigt ökad risk. Justering av diuretikadoser baserad på lungultraljudsfynd ökade diuretikaanvändning och gångsträcka samt minskade behovet av akuta besök för dekompenserad hjärtsvikt, vilket visades i den relativt lilla spanska studien LUS-HF (123 patienter); dock sågs ingen säkerställd nedgång i behovet av återinläggning [33]. Även vid andra tillfällen då hydreringsstatus behöver bedömas, såsom vid bestämning av torrvikt hos en dialyspatient, har lungultraljud visat sig vara värdefullt, och flera studier visar att antal B-linjer korrelerar väl med genomförd ultrafiltration och bioimpedansmätningar [34-36]. På ett liknande sätt har en övervikt av B-linjer visat sig vara till nackdel vid avvecklande av respiratorn hos intuberade intensivvårdspatienter [37].
Framtiden för lungultraljud inom hjärtsviktsvården
Det finns således flera studier som talar för lungultraljuds användbarhet för bedömning av akut och kvarvarande inkompensation hos patienter med hjärtsvikt, men det vetenskapliga underlaget för bred implementering av lungultraljud för värdering av kvarvarande inkompensation och risk/nyttoprofilen av riktad behandling är begränsat. Lungultraljud behöver också jämföras med andra existerande verktyg för bedömning av dekompensation, såsom noggrann klinisk undersökning inklusive värdering av vätskeretention, ekokardiografi med bedömning av fyllnadstryck samt analys av natriuretiska peptider.
Vi har därför tagit initiativ till en prospektiv multicenterstudie (FLUID-AHF; Clinicaltrials.gov NCT04901039) i Skåne, för att bygga upp erfarenhet av lungultraljud och utvärdera effekten mot andra modaliteter med mått på extravaskulär vätska, fyllnadstryck och vätskeretention för bedömning av hjärtsvikt. Andra studier av lungultraljud vid hjärtsvikt pågår också; Clinicaltrials.gov har ett drygt tiotal registrerade som pågående. Det är möjligt att dessa studier ytterligare kan bidra till att föra fram lungultraljud som en ersättare till Laënnecs, till en början liksom lungultraljudet starkt ifrågasatta, stetoskop från 1819 [38].
Läs även författarintervju: 5 frågor till Caroline Heijl
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2021-06-15)