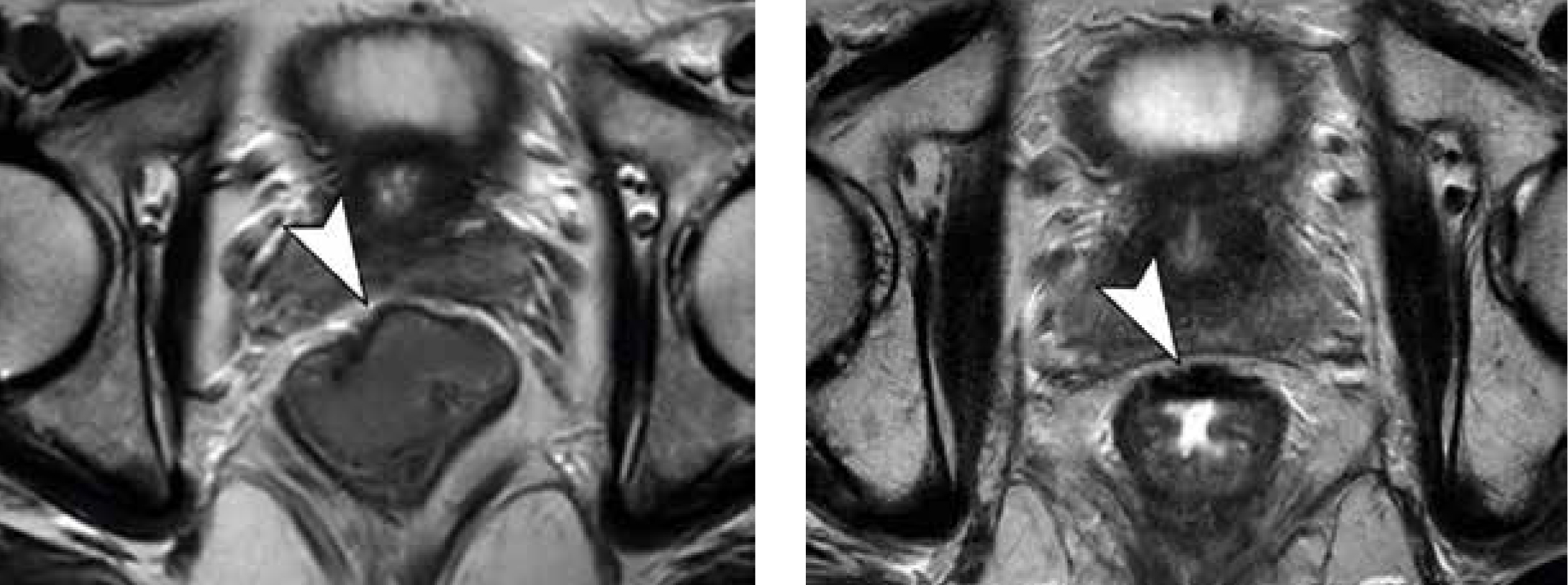
Samtliga patienter med rektalcancer ska utredas med datortomografi av torax–buk, MRT av rektum, tumörmarkör (CEA), endoskopi av primärtumör och om möjligt av hela kolon.
Samtliga patienter med rektalcancer ska diskuteras på multidisciplinär terapikonferens.
För att bedöma svar på genomförd terapi ska patienter som erhållit neoadjuvant behandling efter cirka sex veckor genomgå en ny utredning enligt ovan.
Vid tecken till klinisk komplett respons ska patienten erbjudas ett centraliserat omhändertagande och alternativet att avvakta med operation och i stället följas upp tätt inom ramen för ett prospektivt »watch and wait«-protokoll vid en klinik som erbjuder sådan uppföljning.
Rektalcancer diagnostiseras hos cirka 2 000 personer årligen i Sverige. Tumörformen är något vanligare hos män än hos kvinnor med förhållandet 1,3:1, och medianålder vid diagnos är cirka 70 år. Incidensen har ökat gradvis under de senaste decennierna för såväl män som kvinnor [1]. Alla patienter med anala besvär, blödning och/eller slem per rektum eller smärtor från anus och rektum måste undersökas med rektalpalpation, proktoskopi och rektoskopi. Unga patienter utgör inget undantag från denna regel, eftersom rektalcancer förekommer även i 20-årsåldern, även om det är ovanligt. Under 2012–2016 diagnostiserades 4 procent av all koloncancer och 5 procent av all rektalcancer hos patienter yngre än 50 år [2]. Vid välgrundad misstanke om rektalcancer ska vidare utredning ske inom ramen för standardiserat vårdförlopp (SVF).
Omhändertagandet av patienter med rektalcancer har genomgått genomgripande förändringar de senaste 20–25 åren. Det förändrade omhändertagandet innefattar den preoperativa utredningen, i vilken magnetresonanstomografi (MRT) nu är central, behandlingen före operation, det vill säga neoadjuvant strål- och cytostatikaterapi, den kirurgiska tekniken, den histopatologiska undersökningen av operationspreparatet och uppföljningen av behandlingsresultaten. Sedan drygt tio år finns ett nationellt vårdprogram som anger riktlinjer för utredning, behandling och uppföljning. Svenska kolorektalcancerregistret ligger till grund för de detaljerade rapporter avseende handläggning och behandlingsresultat på nationell basis som årligen publiceras av Regionala cancercentrum i samverkan (RCC).
Fram till i mitten av 1990-talet var risken för lokala tumöråterfall i bäckenet 25–30 procent. Som ett resultat av ovanstående förbättringar har risken minskat till cirka 5 procent, och även överlevnaden har förbättrats.
I den senaste kvalitetsregisterrapporten är den relativa överlevnaden närmare 70 procent för patienter i stadium I–III [3]. Tidigare fick drygt 50 procent av patienterna en permanent kolostomi mot i dag knappt 30 procent.
Ett ökat fokus finns nu även på funktionellt utfall, där förbättringar avseende tarm- och urogenital funktion kan skönjas.
Behandling
Alla patienter som diagnostiseras med rektalcancer ska diskuteras vid en multidisciplinär teamkonferens (MDK) med deltagande av radiologer, kirurger, patologer, onkologer och koordinerande sjuksköterskor innan behandling rekommenderas.
Den traditionella behandlingen av rektalcancer var kirurgisk med avlägsnande av ändtarmen, med eller utan anläggande av permanent stomi. För att, i första hand, minska risken för lokala recidiv har strålbehandling använts sedan i början av 1980-talet. Strålbehandlingen ges numera nästan uteslutande före operationen. Beroende på utfall av den preterapeutiska utredningen kan denna behandling ges som kort behandling (5 fraktioner om 5 gray [Gy] under en vecka) eller som konventionellt fraktionerad strålning (25–28 behandlingar om 1,8–2 Gy under cirka 5 veckor) och kan kombineras med cytostatika. Andelen patienter med rektalcancer som får strålbehandling, och hur den ges, varierar i olika länder beroende på lokala traditioner; i Sverige får cirka 60 procent av patienterna strålbehandling före operationen.
Om strålningen ges som 5 × 5 Gy görs operation antingen direkt, 2–4 dagar efter avslutad strålning, eller fördröjt, 8–10 veckor efter avslutad strålning. Om man väljer fördröjd operation görs cirka 6–8 veckor efter genomförd behandling en ny utvärdering med MRT, datortomografi (DT) torax–buk, rektoskopi och MDK inför den planerade kirurgin. MRT vid uppföljning ska vara en riktad undersökning där flera parametrar, såsom högupplösta T2-viktade och diffusionsviktade bilder, vägs samman för att bedöma svar på behandlingen. Beroende på såväl tumör- som patientfaktorer kan operation med anastomos eller permanent stomi rekommenderas.
Komplett respons
Det primära syftet med neoadjuvant terapi är att lokalt krympa tumören och slå ut eventuella mikrometastaser inom bäckenhålan. Ibland opereras patienter och man kan inte återfinna någon viabel tumör i operationspreparatet. Detta kallas patologisk komplett respons (pCR) och visar att den neoadjuvanta terapin i vissa fall kan eliminera tumören fullständigt.
Genom att validera tumörrespons med MRT, rektalpalpation och endoskopisk undersökning efter genomförd neoadjuvant terapi kan en komplett respons påvisas redan innan operation utförts, så kallad klinisk komplett respons (cCR). cCR definieras som inga tecken till kvarvarande tumör på MRT samt ingen synlig eller palpabel tumör vid endoskopisk undersökning och rektalpalpation (Figur 1 och 2).
Andelen patienter som får cCR varierar kraftigt i olika rapporter: från 10–15 procent upp till 78 procent. Att andelen med cCR är så olika beror på vilken behandling som givits, vilka tumörer som behandlats samt vid vilken tidpunkt utvärdering av respons görs i relation till strålterapins avslutande. Givna stråldoser varierar i olika studier, och huruvida strålning och cytostatika givits som kombinationsbehandling varierar också. Generellt kan sägas att andelen tumörer som svarar med cCR ökar ju högre stråldos och ju mer cytostatika som ges. Tidiga tumörer begränsade till tarmväggen (T1–T2) svarar oftare med cCR än mer avancerade tumörer. Sannolikt har olika tumörer också olika biologiska egenskaper och svarar därför olika väl på given terapi. I dag saknas prediktiva markörer för detta.
Vad göra vid cCR?
Om den neoadjuvanta behandlingen leder till cCR och ingen kvarvarande tumör kan ses eller palperas uppstår frågan om patienten måste opereras.
Den första kirurg som ifrågasatte om operation behövdes var Angelita Habr-Gama från Brasilien, som redan 1998 publicerade en studie av patienter som inte opererats efter cCR [4]. Som alla pionjärer med nya idéer blev hon starkt ifrågasatt. Med tiden ökade dock intresset för så kallad organsparande behandling, där man avstod från operation vid en konstaterad cCR efter förbehandling. Ett program där man avvaktar med operation och i stället kontrollerar patienterna mycket noga med upprepad klinisk undersökning, innefattande rektalpalpation och endoskopisk undersökning av rektum, samt MRT av rektum utvecklades. Denna organbevarande strategi benämns ofta »watch and wait« (W&W), och operation utförs endast vid tecken till lokal tumöråterväxt, definierad som endoskopiskt eller palpatoriskt diagnostiserad ny tumörväxt på platsen för tidigare tumör.
Vid jämförelse mellan patienter med pCR som opererats och de som ingått i W&W-protokoll har man inte sett några signifikanta skillnader i överlevnad [5, 6]. Under de senaste tio åren har ett flertal publikationer redovisat resultat av W&W-strategi, och man kan i dag säga att detta är ett accepterat behandlingsalternativ, under förutsättning att patienten accepterar att inte opereras och i stället genomgå täta kontroller under lång tid. Sedan 2015 finns ett internationellt register (International Watch & Wait Database, IWWD) som inkluderar patienter med cCR från 15 olika länder, inklusive Sverige.
Så vanlig är cCR och här är resultaten
I en metaanalys från 2018 av 17 publikationer redovisas en incidens av cCR hos 22,4 procent av 2 973 patienter som fått neoadjuvant behandling. Under uppföljning av dessa 692 patienter utvecklade 153 (22,1 procent) lokal tumöråterväxt. Hos 147 av 153 patienter (96 procent) upptäcktes återväxten inom tre år, en kumulativ incidens av tumöråterväxt på 21,6 procent vid tre år. Endast 57 (8,2 procent) av patienterna diagnostiserades med fjärrmetastaser, och av dessa hade 35 patienter inga tecken till lokal tumöråterväxt. Överlevnad vid tre års uppföljning var 93,5 procent [7]. Resultat från IWWD-registret, baserat på 880 patienter, rapporterade 2018 liknande resultat: lokal tumöråterväxt vid 2 år på 25,2 procent, varav 88 procent upptäcktes inom 2 år, 8 procent diagnostiserades med fjärrmetastaser, 5-årsöverlevnad var 85 procent och sjukdomsspecifik överlevnad 94 procent [8].
Bland de W&W-patienter där lokal tumöråterväxt uppträder kvarstår som regel möjligheten att då utföra kirurgi. I publicerade serier har kurativt syftande kirurgi kunnat utföras hos 78–100 procent, och det onkologiska utfallet med 3- och 5-årsöverlevnad på 88–95 procent indikerar att W&W-protokollet är säkert även för de patienter där tumören återväxer efter initial cCR [9].
Så handläggs patienter med cCR i Sverige
Vetskapen om att neoadjuvant strålbehandling, med eller utan cytostatika, kan ge cCR hos patienter med rektalcancer har spridit sig även i Sverige. Sedan 2015 har Karolinska universitetssjukhuset initierat ett centraliserat och standardiserat omhändertagande av dessa patienter i Stockholm–Gotland-regionen. Cirka sex veckor efter neoadjuvant behandling ska samtliga patienter genomgå en ny DT av torax–buk, en ny MRT av rektum och bäckenet samt en ny klinisk undersökning med rektalpalpation och rektoskopi. Om det föreligger tydliga tecken på cCR och inga tecken till fjärrmetastaser ska patienten erbjudas att ingå i ett W&W-protokoll och remitteras till Karolinska universitetssjukhuset för bedömning. Om cCR bedöms föreligga även vid upprepad undersökning, och patienten efter information vill delta, erbjuds ett standardiserat uppföljningsprogram på Karolinska universitetssjukhuset med avvaktan av kirurgi. Patienter som ej bedöms ha en cCR återgår till remitterande klinik för operation.
Uppföljningsprogrammet består av rektalpalpation, endoskopisk undersökning av rektum med fotodokumentation, MRT av rektum samt kontroll av tumörmarkör (CEA). Denna uppföljning görs var tredje månad under två år, var sjätte månad upp till fem år och därefter årligen upp till 10 år efter diagnos. Dessutom görs DT torax–buk efter ett och tre år, något som görs på alla patienter som opererats för rektalcancer. Vid återväxt av tumör opereras patienten efter behandlingsrekommendation på sedvanlig MDK.
Sedan starten av Karolinska universitetssjukhusets W&W-program har 142 patienter remitterats från sjukhus inom och utanför regionen och bedömts avseende cCR. Av dessa hade 88 patienter (33 kvinnor, 55 män) klarlagd cCR och inkluderades i det prospektiva protokollet. Efter en medianuppföljningstid på 103 (19–560) veckor hade 17 patienter (19 procent) utvecklat lokal tumöråterväxt. 16 opererades med avlägsnande av rektum och hos 15 var operationen potentiellt kurativ (R0-resektion). Endast en patient har diagnostiserats med fjärrspridning (para-aortala lymfkörtelmetastaser, utan föregående lokal återväxt) under uppföljningen.
Baserat på de positiva erfarenheterna från internationella W&W-protokoll och från Karolinska universitetssjukhuset startades 2018 implementeringen av ett svenskt nationellt protokoll för W&W där alla patienter med komplett respons erbjuds att deltaga (NCT03125343, huvudprövare Eva Angenete, Göteborg, Anna Martling, Stockholm). Deltagande centrum är Karolinska universitetssjukhuset i Stockholm, Sahlgrenska universitetssjukhuset/Östra i Göteborg, Akademiska sjukhuset i Uppsala, universitetssjukhusen i Örebro, Linköping, Malmö och Umeå samt Västmanlands sjukhus Västerås. Samtliga centrum erbjuder W&W med den uppföljning som beskrivits ovan. Ett nationellt register för prospektiv registrering av patienter med cCR har startats, och inom ramen för detta genomförs även mätningar av funktionella resultat och livskvalitetsmätningar [10].
Framtida utveckling av W&W-strategier
Om det finns indikation för att kombinera strål- och cytostatikabehandling, som vid lokalt avancerade tumörer, har behandlingarna tidigare givits som lång tids strålbehandling samtidigt med cytostatika under 5–6 veckor. Baserat på en nyligen rapporterad internationell studie (RAPIDO) rekommenderar nu det senaste svenska vårdprogrammet att man i stället ska ge 5 × 5 Gy följt av cytostatika. I RAPIDO-studien opererades alla patienter, och man såg då en patologisk komplett respons hos 28 procent av de patienter som fått 5 × 5 Gy följt av cytostatika.
Baserat på rapporter och metaanalyser av studier på patienter med cCR kan vi i dag rekommendera ett W&W-program med prospektiv uppföljning för de patienter som önskar avvakta med operation och i stället accepterar tät uppföljning. Data talar entydigt för att patientens prognos inte försämras om man avvaktar med operationen tills patienten får en lokal tumöråterväxt, och majoriteten av patienterna får aldrig någon återväxt efter cCR.
Nackdelen med en W&W-strategi är att patienten måste ingå i ett mycket omfattande uppföljningsprogram med ett flertal rektala undersökningar och MR-undersökningar. Detta är kostsamt och kan erbjuda logistiska problem med att tillhandahålla erforderliga undersökningar i rätt tid. Dessutom känner många patienter en stark oro för att man ska hitta tumöråterväxt i samband med nästa undersökning. Det händer att patienter föredrar en operation med avlägsnade av rektum i stället för en ständig oro för tumöråterväxt.
Majoriteten av patienterna med cCR vill dock inte opereras och eventuellt få en permanent stomi. Därför är det viktigt att behandlingen av rektalcancer utvecklas så att fler patienter kan ingå i W&W-protokoll och undvika en operation. Viktigt att notera är att vi i dag inte har ändrat på indikationerna för neoadjuvant terapi. I Sverige ges inte neoadjuvant behandling till patienter med rektalcancer i syfte att uppnå cCR, utan för att minska risken för lokala recidiv och metastaser. Det svenska vårdprogrammet för rektalcancer rekommenderar inte neoadjuvant behandling till patienter med tidiga tumörer begränsade till tarmvägg eller med begränsad genomväxt av tarmväggen, eftersom det onkologiska utfallet knappast påverkas av neoadjuvant terapi hos denna patientgrupp. Samtidigt vet vi att tidiga tumörer i högre utsträckning går helt i regress, cCR, efter neoadjuvant behandling. I valet mellan en rektumamputation med permanent stomi eller neoadjuvant behandling med en hög sannolikhet för cCR och ingen operation är det möjligt att många patienter skulle välja det senare alternativet. Dock föreligger här ett dilemma, eftersom åtminstone 50 procent av patienter med tidiga tumörer inte kommer att uppnå cCR efter neoadjuvant terapi och därför ändå måste genomgå operation. Den neoadjuvanta terapin har då givits »i onödan«, vilket inte bara är resurskrävande utan också ökar risken för komplikationer i samband med kirurgi och postoperativ funktionspåverkan. I dag saknas pålitliga prediktiva biomarkörer för att förutsäga svar på strålbehandling. Det är dock troligt att indikationerna för neoadjuvant behandling kommer att kunna ändras framöver, särskilt om respons på behandlingen kan komma att förutsägas utifrån genetiska analyser av provtagning från tumören.
Läs även författarintervjun: 5 frågor till Torbjörn Holm
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2021-07-07)