Utredning, behandling och uppföljning av ärftliga kardiovaskulära sjukdomar kräver multidisciplinärt omhändertagande.
För att utveckla arbetssättet kring dessa sjukdomar startades 2007 en klinikövergripande centrumbildning i kardiovaskulär genetik vid Norrlands universitetssjukhus, där kliniker samarbetar utan internremisser.
En hörnsten i verksamheten är familjemottagning, dit proband och nära släktingar med genetisk risk inbjuds.
Arbetssättet kräver en organisation som uppfyller krav på hantering av integritet och etiska dilemman avseende information både till individer och familjer.
β Verksamheten har hittills innefattat 325 familjemottagningar med 2 102 deltagare.
Dåtid. »Quinnan fanns efter kort bortavaro liggande med ansiktet i en källa, död; om i följd av svimning hvarför hon hade anlag.« (Utdrag ur Dorotea sockens dödbok i mitten av 1800-talet, funnet vid genomgång av släkt med kända fall av långt QT-syndrom, LQTS.)
Nutid. En 25-årig kvinna inkommer i ambulans under diagnosen misstänkt kramp. Hon är tidigare väsentligen frisk, har ett 6 månader gammalt spädbarn och har just avslutat en 3-veckors bantningskur. Kvinnan har sprungit uppför trappan för att ta upp sitt skrikande barn då maken hör en duns, skyndar dit och finner hustrun liggande på rygg okontaktbar med läppcyanos. Han påbörjar HLR, och kvinnan vaknar efter några minuter – hon blir snabbt helt kontaktbar och klar. Vilo-EKG på sjukhuset visar lång QT-tid; bedöms initialt som förlängd QTc efter kramp. Hon läggs in med EKG-övervakning och får samma natt ventrikeltakykardi. Diagnosen bedöms vara förenlig med LQTS. Betablockad sätts in och ICD implanteras. Hon remitteras för genetisk vägledning med information om sjukdomen och ärftlighetsgång. I samband med detta erbjuds hon diagnostisk screening av LQTS-generna.
Den genetiska analysen påvisar en patogen mutation i KCNH2-genen (LQTS2). Denna jonkanalsjukdom är förknippad med ventrikeltakykardi av typen »torsade de pointes« och plötslig död. Då ärftligheten är dominant (det vill säga 50 procents risk för förstagradssläktingar att bära det skadade anlaget) påbörjas en familjeutredning efter genetisk vägledning och kvinnan får ett familjebrev att distribuera i släkten.
Brevet leder till att 11 familjemedlemmar hör av sig. Efter specialistvårdsremisser från fyra sjukvårdsregioner genomförs genetisk vägledning via telefon. Flera i släkten anger tidigare oförklarade svimningar, som har tolkats som vasovagalt utlösta. Efter att skriftligt samtycke inhämtats, rekvireras kopior på EKG och journalhandlingar. Majoriteten av dessa EKG inger misstanke om LQTS. Blodprov tas på 6 olika orter i landet och anlagsbäraranalyserna påvisar 10 bärare, varav 6 barn, vilka samtliga efter bedömning och medicinsk rådgivning av barn-/vuxenkardiolog insätts på profylaktisk betablockad.
Denna familj är ett utmärkt exempel på de nya utmaningar sjukvården ställs inför när det gäller utredning, diagnostik samt behandling av ärftliga kardiovaskulära sjukdomar. Med dagens kunskapsmassa inom området är det omöjligt för en enskild läkare att behärska ett helhetsgrepp kring en kardiogenetisk sjukdom. För att möta de krav som sjukvården står inför, startades internationellt de första kardiogenetiska klinikerna under senare delen av 1990-talet [1]. Centralt för dessa kardiogenetiska kliniker är det nära samarbetet mellan flera olika specialiteter [2]. Specialister finns redan i dag på enskilda enheter, men till skillnad från annan vård erbjuder den kardiogenetiska kliniken en samlad multiprofessionell utredning, uppföljning och behandling av personer och släkter med dessa sjukdomar. Vid en sådan utredning förflyttas fokus snabbt från individen till att gälla en hel familj som kan vara spridd över hela landet. Den sedvanliga remissbaserade lagstafetten mellan olika specialister är mindre lämplig i en familjekontext. Instrumenteringen för ett välfungerande omhändertagande av dessa familjer underlättas av en dedikerad organisation i ett sömlöst och nära samarbete över etablerade klinikgränser.
Centrum för kardiovaskulär genetik (CKG)
CKG bedriver i dag utrednings- och mottagningsverksamhet för patienter och familjer med monogent nedärvda kardiovaskulära sjukdomar. Centrumbildningen är resultatet av ett nära samarbete mellan Barn- och ungdomscentrum, Hjärtcentrum, Medicincentrum och Laboratoriemedicin vid Norrlands universitetssjukhus. Verksamheten startade 2005, invigdes formellt år 2007 och har successivt utvecklats utifrån kriterierna att sjukdomar som utreds ska ha 1)
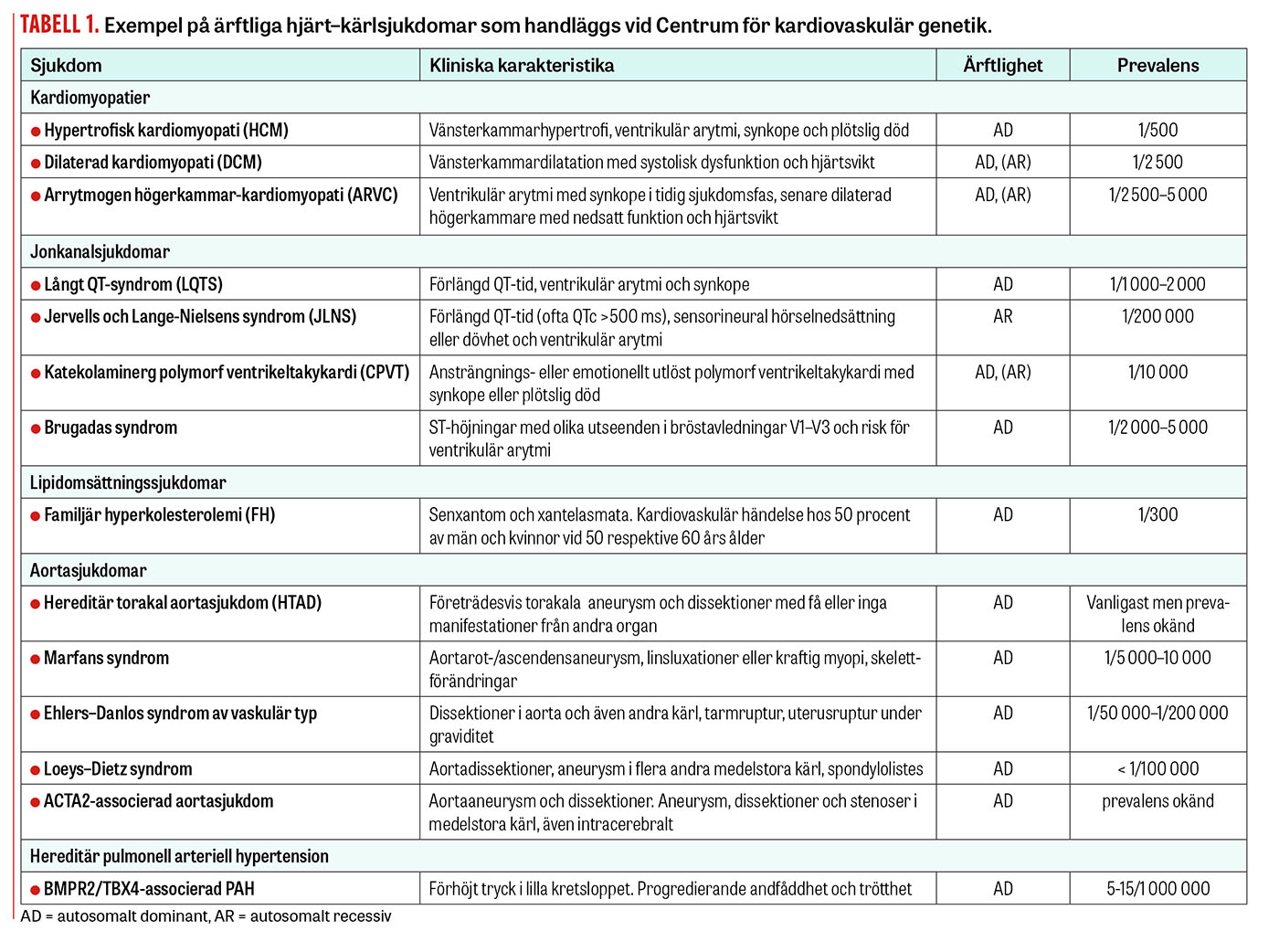
monogen nedärvning, 2) allvarlig klinisk karaktär, 3) tillförlitlig klinisk fenotypkarakterisering, 4) tillgång till genetisk diagnostik och 5) effektiv behandling. Exempel på de sjukdomsgrupper som handläggs framgår av Tabell 1.
Arbetssättet vid CKG innebär en kraftsamling över klinikgränserna syftande till att skapa en multidisciplinär erfarenhet och specialkompetens av dessa sjukdomar. Av särskild vikt är en centraliserad miljö, som tillåter ett naturligt möte mellan olika specialiteter och kliniker, där det finns en viktig sammanhållande kompetens i form av utredningskoordinatorer/genetiska vägledare. Detta är i linje med Socialstyrelsens rekommendationer i »Nationella riktlinjer för hjärtsjukvård« 2018.
För att skapa denna nya verksamhet krävdes det en klar målbild, ekonomiska medel och administrativa lösningar. Region Västerbotten utsåg CKG till ett prioriterat profilområde och har därför tillfört resurser. Administrativa och ekonomiska utmaningar med kliniköverskridande arbetssätt har handlagts konstruktivt, vilket lett till att arbetsformen kunnat utvecklas. Det har även från starten funnits en strävan att stimulera till forskningsaktivitet inom alla delar av verksamheten, vilket har genererat 6 avhandlingar, 60-talet artiklar, 4 pågående doktorandprojekt samt nationella och internationella forskningssamarbeten. CKG ingår i ett EU-samarbete i form av ett European Reference Network (ERN), nätverket GUARD–HEART, som initierar forskningsprojekt men även utbyter klinisk kunskap inkluderande en möjlighet till diskussion av särskilt komplicerade avidentifierade patientfall via en digital plattform.
Rondverksamhet
En av flera hörnstenar i arbetssättet är regelbundna ronder – både kliniska ronder och gemensamma ronder för bedömning av genetiska varianter. Vid de multidisciplinära kliniska ronderna deltar koordinatorer/vägledare, berörda kliniska specialister samt klinisk genetiker. Här diskuterar man både kliniska och genetiska data för att fastställa vilken diagnos som är mest sannolik och vilken utredningsgång som är lämplig i den aktuella familjen. Utfallet kan ibland bli att man behöver inhämta mer klinisk (eller genetisk) information innan en slutlig bedömning kan göras. Samspelet mellan de olika specialisterna vid dessa ronder är essentiellt ur kvalitetssynpunkt.
Vid de gemensamma ronderna för bedömning av genetiska varianter deltar sjukhusgenetiker, klinisk genetiker och patientansvarig kliniker. Antalet gener som analyseras per kardiogenetisk sjukdomsgrupp har ökat med införande av nya analysmetoder. Därav följer att antalet sekvensvarianter som påvisas efter den bioinformatiska filtreringen också ökar. Det är inte ovanligt att man vid en multigenpanel påvisar 5–10 genetiska varianter vars enskilda betydelse måste värderas. Tolkning av dessa är en av de största utmaningarna i dag. Den ansvarige sjukhusgenetikern presenterar de genetiska varianter som påvisats i den aktuella familjen. Det sker en samlad och strukturerad genetisk och medicinsk bedömning baserad på American College of Medical Genetics and Genomics (ACMG) riktlinjer [3]. Där värderas variantens betydelse utifrån ett antal olika kriterier, exempelvis om varianten tidigare finns rapporterad, om den är vanligt förekommande i normalpopulationen, algoritmer som predicerar variantens effekt samt anamnestiska och kliniska data om familjemedlemmar. Därefter klassificeras varianten in i någon av fem kategorier: patogen, sannolikt patogen, variant av oklar betydelse (VUS), sannolikt benign eller benign.
Utfallet av denna bedömning är av central betydelse, då resultatet har stora konsekvenser för kontrollprogram samt behandling, såväl för individen som för familjen och kommande generationer. Kliniskt kan det vara särskilt svårt att handlägga varianter av oklar betydelse, där man inte säkert kan uttala sig om deras eventuella roll som orsak till familjens sjukdom. Dessutom utvecklas ständigt kunskapen om genetik och dess betydelse inom det medicinska fältet. Detta leder ibland till att tolkningen av en variant omprövas, vilket kan få konsekvenser för familjen.
Familjemottagning
Vid en familjemottagning samlas släktingar från flera generationer för att få information om sjukdomens ärftlighet, symtom, behandlingsalternativ och uppföljning. Möjlighet till anlagsbärartest diskuteras. Familjen träffar ett team med hjärtläkare/internmedicinare, barnhjärtläkare, klinisk genetiker, genetisk vägledare och vid behov kurator eller dietist. Vid mottagningen informeras familjemedlemmarna samtidigt, vilket är en stor fördel och minskar risken för missförstånd i andra eller tredje hand. Till barn, som alltid erbjuds delta, ges åldersanpassad information. Samtalet präglas ofta av familjemedlemmarnas engagemang och delaktighet. Vid mottagningen föreslås individanpassade behandlings- och kontrollprogram. Ibland görs även kliniska undersökningar i anslutning till familjemottagningen.
Förutom den gemensamma informationen är det viktigt att erbjuda enskilda samtal till dem som så önskar.
Under en familjeutredning kan en rad etiska dilemman uppstå, som att probanden inte önskar informera släktingar på grund av dålig kontakt, önskan att inte oroa eller att man inte vill lämna ut sig själv som den som är upphov till sjukdomen i familjen. Släktingarna å sin sida får information om framtida hälsorisker, som de inte har efterfrågat. Familjemottagningen sker numera ofta via videolänk, då familjen befinner sig på sitt hemortssjukhus, på annan videokonferenslokal eller i hemmet och CKG:s personal befinner sig vid universitetssjukhuset. Mottagningen kan också genomföras genom att familjen kommer till universitetssjukhuset i Umeå, och om det rör sig om stora familjer kan ibland CKG:s personal resa till familjens hemortssjukhus och hålla mottagningen där.
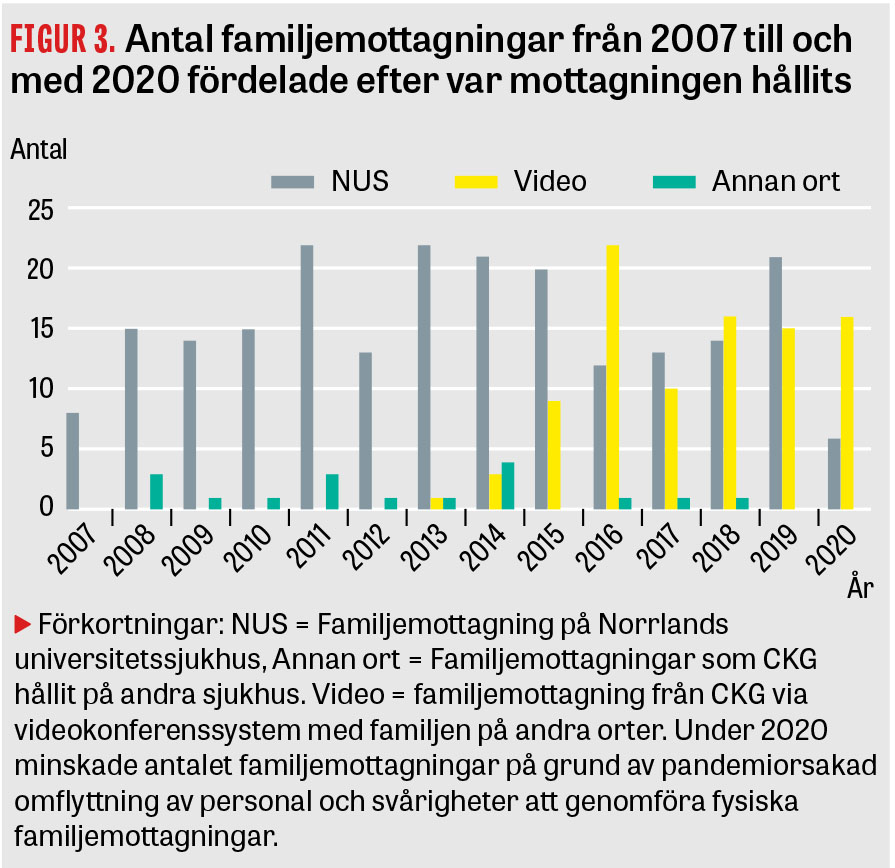
Till och med 2020 har vi haft sammanlagt 325 familjemottagningar med totalt 2 102 familjemedlemmar. Fördelning mellan olika år och mellan olika diagnoser framgår av Figur 1 och Figur 2. Eftersom personer i en släkt ofta är spridda över landet har vi sedan 2013 i allt högre utsträckning nyttjat rent digitala familjemottagningar, vilket även underlättat fortsatt arbete under pågående pandemi (Figur 3).
Utredningsgång vid CKG
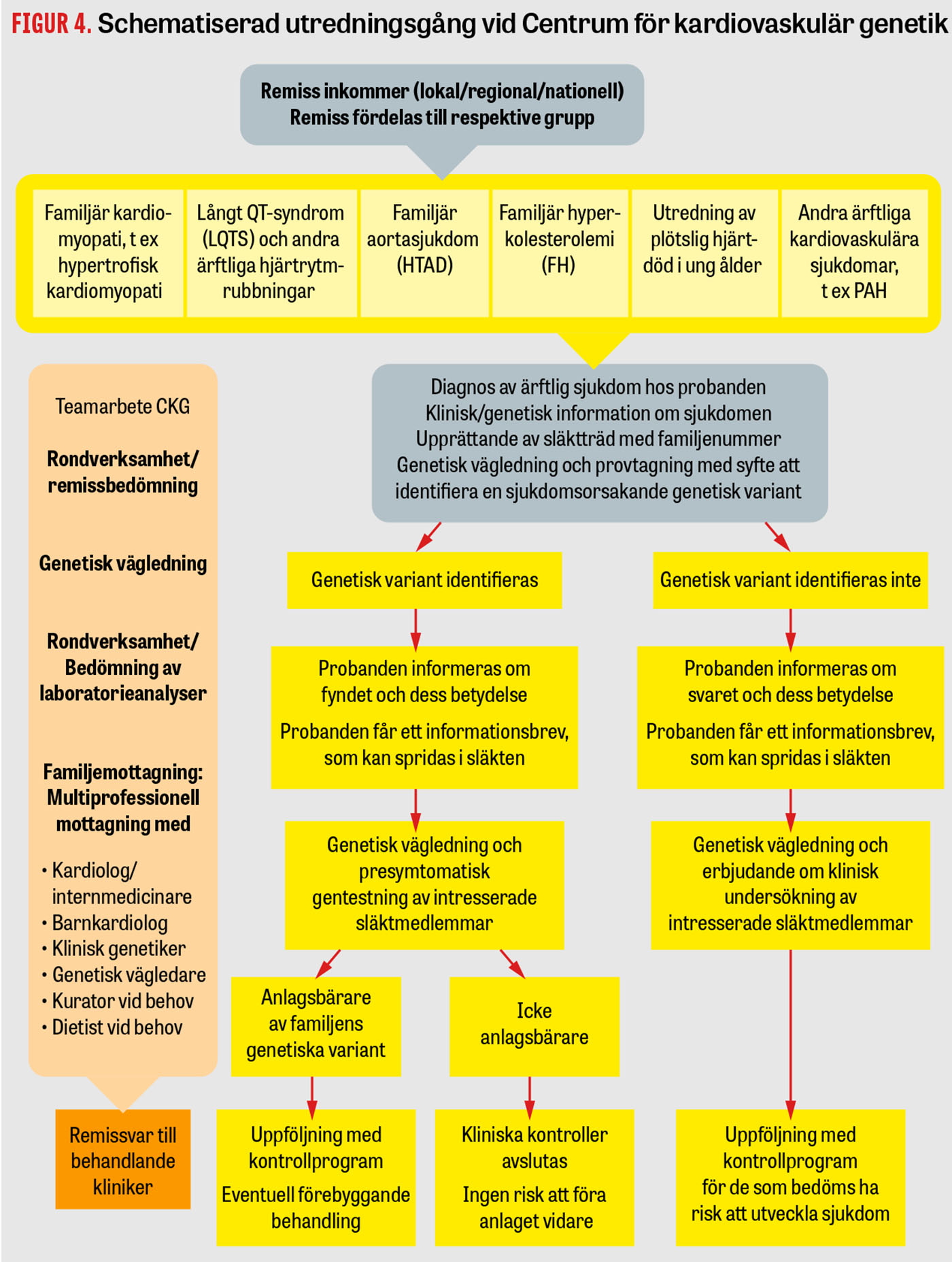
Personer med misstänkt ärftlig kardiovaskulär sjukdom remitteras från primärvård eller specialistvård till CKG för utredning. Denna person betecknas som proband i familjen (= den första som söker sjukvården). Behovet av genetisk utredning värderas, och i de fall det bedöms befogat initieras en familjeutredning (Figur 4).
1. Första steget i diagnostiserande av en familjär sjukdom omfattar probanden och förstagradssläktingar, vid vissa sjukdomar även andragradssläktingar. Här ingår kontakt med probanden, inhämtande av kliniska uppgifter och eventuella journalhandlingar på nära släktingar. Ett släktträd upprättas. Detta är ofta ett tidskrävande och grannlaga arbete som sköts av koordinator på CKG.
2. De inkomna uppgifterna bedöms vid multidisciplinär remissrond med kliniker, klinisk genetiker och koordinator. Om familjens sjukdom bedömes ärftlig erbjuds den med allvarligast fenotyp, vilket ofta är probanden, DNA-diagnostik av relevanta gener efter genetisk vägledning.
3. Förekomst av ärftlig sjukdom i släkten kan bekräftas antingen genom att genetisk analys påvisar en patogen avvikelse och/eller att man vid klinisk undersökning av förstagradssläktingar diagnostiserar fler fall i familjen.
4. Oavsett om en genetisk avvikelse påvisas eller ej så kan probanden erbjudas en familjemottagning. Denna mottagning är multidisciplinär, med kliniker, klinisk genetiker, genetisk vägledare och vid behov med dietist och/eller kurator. Probanden och intresserade familjemedlemmar får då samlad information om sjukdomens kliniska och genetiska aspekter. Om ett sjukdomsanlag har påvisats erbjuds presymtomatiskt genetisk analys efter genetisk vägledning. När genetisk analys är negativ men familjeanamnes och fenotyp talar starkt för genetisk sjukdom, erbjuds familjemedlemmar med risk för sjukdomen en klinisk utredning.
5. Probanden återremitteras till hemorten för fortsatta kliniska kontroller. Förstagradssläktingar omhändertas i enlighet med sin kliniska eller genetiska status. Anlagsbärare eller de med klinisk sjukdom inkluderas i kontrollprogram. De familjemedlemmar som vid anlagsbärartest inte visar sig bära på sjukdomsanlaget kan avskrivas från vidare kontroller. Personer som har konstaterad sjukdom eller är anlagsbärare som bor inom vårt närområde kan följas upp via CKG:s läkare men på respektive hemmaklinik.
Familjeutredningarna omfattar ofta individer med stor geografisk spridning, där en dedikerad organisation är nödvändig för att på ett effektivt sätt kunna hålla kontakt och samla information som är nödvändig för utredningen. Koordinatorerna fyller en mycket viktig roll – navet i verksamheten, där det multidisciplinära samarbetet mellan kliniker och genetiker är helt nödvändigt.
Informationsbehovet avseende kardiogenetiska sjukdomar är stort både hos allmänheten och professionen. För ett flertal av dessa diagnoser har CKG utarbetat informationsbroschyrer och information på 1177.se för patienter och deras familjer [4]. Syftet är att underlätta spridning av relevant sjukdomsinformation till medlemmarna i de drabbade familjerna. Dessa broschyrer används även av andra kardiogenetiska mottagningar i Sverige. För några diagnoser (HTAD, HCM, DCM, LQTS, FH; se Tabell 1) har vi också utarbetat mer ingående skriftlig information avsedd för professionen [5].
Sedan 2007 har familjemottagningarna utvärderats med en enkät som skickas till alla som deltagit i en familjemottagning. Utvärdering visar att modellen upplevs som välfungerande, och 96 procent av de tillfrågade anser sig nöjda med mottagningen.
Gemensamt för de sjukdomar som utreds och behandlas inom denna form av verksamhet är att de ofta drabbar unga, till synes friska individer, inte sällan med plötslig död som följd. Det finns en klinisk och (oftast) genetisk diagnostik för dessa tillstånd. Detta innebär att utredningen får en praktisk konsekvens för både den enskilda individen och familjen. Individer med en genetisk risk för sjukdom (anlagsbärare), som ännu inte utvecklat kliniska symtom, kan inkluderas i kontrollprogram med regelbunden klinisk uppföljning för att detektera tidiga sjukdomsmanifestationer, eventuellt sätta in förebyggande behandling och undvika dödsfall. Vår modell med vägledning, familjemottagningar och multidisciplinärt arbetssätt leder till att anlagsbärare och deras närstående engageras på ett mer aktivt sätt i beslut kring åtgärder, vilket leder till tidigarelagda diagnoser och interventioner jämfört med tidigare. Fler anlagsbärare upptäcks och de får förebyggande läkemedelsbehandling eller operationer för att förebygga dödsfall. Även den specifikt sjukdomsorsakande genvarianten påverkar individers uppföljning, operationsindikation för aortasjukdom, indikationer för implanterbar defibrillator, läkemedelsbehandling etc.
Lika viktigt är att de individer som inte visar sig bära på det i familjen identifierade sjukdomsanlaget kan ges lugnande besked och inte behöver gå på några ytterligare kontroller. Här finns också en klar hälsoekonomisk vinst, eftersom man statistiskt sett kommer att kunna avskriva hälften av familjemedlemmarna från vidare kontroller i de familjer där man har funnit den genetiska orsaken till sjukdomen.
Det finns vanligen i familjerna en stor oro både för risken att själv drabbas och att överföra ett sjukdomsanlag till sina barn. I dessa sammanhang är familjemottagning ett mycket kraftfullt instrument för information. Ett sätt att förebygga och hantera tänkbara etiska konflikter är att tidigt ta upp och diskutera möjliga problem. Vi har inte rätt att förbigå probanden och direkt kontakta släktingar, men vi kan stötta hen i att förmedla information. I enstaka fall har vi haft delade familjemottagningar på grund av interna konflikter i familjen.
I de nationella riktlinjerna för hjärtsjukvården från Socialstyrelsen 2018 lyfts åtgärder kring kardiovaskulär genetik fram [6]. Området har fått hög prioritet med tanke på möjligheterna att behandla och förebygga död och tidiga komplikationer. Det framgår även av de nationella riktlinjerna att verksamheten är komplex och att samarbete krävs för goda resultat. Svenskt kardiogenetiskt nätverk bildades 2014 för att gemensamt utveckla utredning och behandling av monogena hjärt–kärlsjukdomar. Möjligheter till utredning och behandling av sjukdomar inom detta område finns således på flera orter. Organisationsformerna varierar mellan sjukhusen. Det kan finnas risker i att enskilda kliniker använder genetiska analyser där det för tillfället är billigast och sedan på egen hand sköter diagnostik, utredning och behandling. Ur individens och familjernas perspektiv och för kommande generationer ger den samlade multidisciplinära kompetensen vid ett specialiserat kardiogenetiskt centrum större möjligheter till en säker och uppdaterad diagnostik, utredning och uppföljning.
Sammanfattningsvis är kardiogenetiken ett växande verksamhetsfält som under de senaste två decennierna genomgått en kunskapsexplosion. Området har utvecklats från att primärt vara ett forskningsområde till att bli en komplex högspecialiserad verksamhet i den kliniska vardagen. Det har skett en utveckling, från utredning av monogena familjära fall, till att nu omfatta familjescreening med presymtomatisk testning, riskvärdering och behandling. Den genetiska informationen har visat sig vara viktig – och under vissa förhållanden till och med kritisk – för behandlingsbeslut. Sjukhusgenetiker, kliniska genetiker och andra kliniska specialister i samarbete krävs för korrekt tolkning av dessa genetiska och kliniska resultat, med åtföljande rekommendationer om behandling och familjerådgivning. Den snabba utvecklingen inom genetisk diagnostik och bioinformatik ställer allt större krav på uppdaterad kunskap och erfarenhet hos teamet runt familjen för att kunna ställa rätt diagnos, optimera riskvärdering, ha beredskap för etiska dilemman och för att ta ställning till eventuell åtgärd eller presymtomatisk behandling.
Genetiska vägledare: Katarina Englund och Elisabeth Forsman.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2022-01-19)