Atelektaser är sammanfallna lungavsnitt som uppstår bakom avstängda luftvägar när alveoler töms på gas och kollapsar.
Höga syrgashalter är en förutsättning för atelektasutveckling i samband med anestesi.
Atelektaser ger upphov till shunt och försämrad syresättning.
Atelektaser kan bidra till utvecklingen av postoperativa lungkomplikationer.
Lungrekrytering och positivt slutexspiratoriskt tryck (PEEP) kan motverka atelektaser.
Vi behöver veta mer om hur patientfaktorer påverkar uppkomsten av atelektaser.
Efter en mångfasetterad forskargärning som sträcker sig över fem decennier har Göran Hedenstierna gått ur tiden (Fakta 1). Ett av hans viktigaste forskningsområden handlade om atelektaser under anestesi. I denna översiktsartikel sammanfattar vi det aktuella kunskapsläget kring mekanismerna bakom atelektasutveckling samt hur atelektaser kan motverkas i samband med generell anestesi.
Grundläggande fysiologiska begrepp framgår av Fakta 2.
Atelektaser och protektiv ventilation
Varje år genomförs mer än 300 miljoner operationer världen över, varav de flesta i generell anestesi [1, 2]. Hos nästan alla patienter som sövs utvecklas strax efter nedsövningen atelektaser i de ryggnära delarna av lungorna, närmast diafragma [3]. Dessa atelektaser bidrar till försämrad syresättning under anestesin [4] och kan bidra till uppkomsten av postoperativa lungkomplikationer, till exempel andningssvikt och pneumoni [5, 6]. Lungkomplikationer är mer vanligt förekommande än postoperativa hjärtkomplikationer och orsakar utöver ökad morbiditet och mortalitet även förlängda vårdtider och ökade sjukvårdskostnader. Även patientens hälsostatus och typ av kirurgiskt ingrepp spelar stor roll för risken att utveckla postoperativa lungkomplikationer, men dessa faktorer kan vara svåra att påverka systematiskt.
Mekanisk ventilation med övertrycksandning är sedan 1950-talet rutin när andningen behöver tas över hos patienter som sövs i samband med operation eller inom intensivvården. Länge har det också varit känt att ventilatorbehandlingen i sig själv kan vara skadlig för lungorna. Detta förklaras av att lungorna expanderar vid mekanisk ventilation med hjälp av övertryck, vilket kan ge upphov till skador på lungvävnaden. Risken för så kallad ventilatorinducerad lungskada är störst inom intensivvården, där ofta sjuka, inflammerade lungor ventileras, men förekommer även inom operationssjukvård där lungorna vanligtvis är friska. Skador associerade med atelektaser, atelektrauma, är en av flera identifierade skademekanismer, se Fakta 2. På senare år har begreppet »protektiv ventilation« introducerats för att beskriva den ventilationsstrategi som används för att minimera risken för att den mekaniska ventilationen orsakar skada på lungvävnaden. Strategins grundpelare är att undvika stora tidalvolymer samt att hålla lungan öppen och atelektasfri med hjälp av ett så kallat positivt slutexspiratoriskt tryck, PEEP (positive end-expiratory pressure), och vid behov rekryteringsmanövrar.
Historisk tillbakablick och nuvarande kunskapsläge
Redan tidigt i den moderna anestesins historia försökte man bringa klarhet i varför sövda patienter uppvisade försämrad syresättning, hypoxemi, vilken inte till fullo kunde förklaras av andningsdepression eller minskad hjärtminutvolym [7]. Att en tänkbar förklaring var shunt och venös tillblandning på grund av sammanfallna alveoler föreslogs bland annat av Torsten Gordh, den svenska anestesins fader [8]. I en viktig studie publicerad 1963 visade Bendixen och medarbetare att lungans syresättningsförmåga och även dess eftergivlighet (compliance) kunde återställas om man gav de sövda patienterna extra stora andetag [9]. Författarna konstaterade att resultatet talade för att atelektaser är vanligt förekommande under generell anestesi. Men trots starka indikationer på att så var fallet krävdes radiologiska framsteg för att kunna bevisa det. Göran Hedenstierna förstod tidigt att den nya tekniken med datortomografi (DT) öppnade upp för möjligheten att närmare kartlägga vad som händer i lungan i samband med anestesi. Den första studien som bekräftade att förtätningar i lungan uppstår som en direkt konsekvens av generell anestesi publicerades av Hedenstierna och medarbetare i en banbrytande artikel 1985 [10]. I artikeln benämns atelektaserna försiktigt som »pulmonella förtätningar«, eftersom författarna inte helt kunde utesluta alternativa förklaringar till fynden. Kompletterande studier visade att det verkligen rörde sig om atelektaser och att det förelåg ett tydligt samband mellan utbredningen av dessa atelektaser och storleken på den höger–vänstershunt som också till stor del kunde förklara hypoxemin hos sövda patienter.
I arbetet från 1985 studerades 20 sövda patienter. Kontrollgruppen som undersöktes i vaket tillstånd bestod av fyra frivilliga personer, alla tillika medförfattare till artikeln. Det är fascinerande att 36 år senare konstatera att flera av författarnas slutsatser fortfarande är giltiga. Senare forskning har dock reviderat några av slutsatserna rörande atelektasernas uppkomstmekanismer.
Men låt oss börja med de observationer som fortfarande anses gälla för patienter som sövs i ryggläge, utan PEEP och efter preoxygenering med 100 procent syrgas:
- Atelektaser uppstår hos nästan alla vuxna.
- Atelektaser bildas inom 5 minuter efter anestesistart.
- Atelektaser har störst utbredning dorsalt nära diafragma.
- Atelektaserna utgör i ett basalt DT-snitt cirka 5 procent av den totala lungytan.
- Lungcirkulationen är inte upphävd inom atelektatiska områden.
- Tillägg av ett PEEP på 10 cm H2O minskar eller eliminerar atelektaserna, som dock snabbt återkommer om utandningsmotståndet avlägsnas.
- Vid förflyttning från ryggläge till höger sidoläge minskar eller försvinner atelektaserna i den övre, vänstra lungan men kvarstår i den nedre, högra lungan.
Vad gäller de reviderade slutsatserna är följande numera klarlagt:
- Det finns ett samband mellan ålder och atelektasutveckling.
- Luftvägsavstängning är en viktig uppkomstmekanism.
- Syrgashalten under anestesins inledning är avgörande för atelektasutvecklingen.
- Atelektaserna är orsakade av absorption av gas bakom avstängda luftvägar snarare än kompressionskrafter.
Det är intressant att notera att de gynnsamma effekterna av PEEP beskrevs så här tidigt. Å andra sidan kan vi konstatera att det var först i en rad senare arbeten från »Hedenstierna-laboratoriet« man kunde påvisa syrgaskoncentrationens fundamentala betydelse för atelektasutvecklingen [11, 12]. Det är därför anmärkningsvärt att den inandade syrgashalten inte framställs som en särskilt viktig variabel i de stora randomiserade studier som på senare år publicerats rörande protektiv ventilation under anestesi [13-17].
Syrgashalt och V/Q-förhållanden
Syrgashaltens roll i atelektasutvecklingen hänger samman med förhållandet i lungan mellan ventilation och cirkulation (V/Q, ventilations/perfusionskvoten). Den tyske forskaren Lichtheim påvisade redan 1879 att i lungdelar som inte ventileras men som har cirkulation, och där V/Q-förhållandet alltså är 0, uppstår atelektaser i ett tidsförlopp beroende av sammansättningen på gasblandningen i de avstängda alveolerna [18]. De faktorer som påverkar uppkomsten av atelektaser kopplat till olika V/Q-kvoter och syrgashalter kunde på 1970-talet kartläggas teoretiskt med utgångspunkt från observationer gjorda med så kallad multipel inert gaseliminationsteknik (MIGET) [19, 20]. Beräkningar har visat att det i helt avstängda alveoler fyllda med luft, det vill säga huvudsakligen kvävgas, dröjer cirka 8 timmar innan atelektaser bildas. Kvävgas absorberas endast i mycket liten utsträckning och utövar alltså en stabiliserande effekt på alveolerna. Om kvävgasen i stället ersätts av syrgas, vilket sker i samband med preoxygenering inför anestesistart, blir effekten annorlunda: när ventilationen upphör eller minskar till delar av lungorna, tar det endast några få minuter tills atelektaser uppstår. Att en del alveoler är helt eller delvis avstängda efter induktionen beror på att anestesimedlen orsakar en sänkt vilolungvolym, vilket i sin tur leder till att små luftvägar stängs. Distalt om avstängningen kommer den passerande lungcirkulationen snabbt att absorbera syrgasen, varpå alveolen töms på gas och faller samman. Även i avsaknad av total luftvägsavstängning är denna kollaps av alveoler möjlig. Detta förklaras av att det för varje given syrgaskoncentration finns ett kritiskt V/Q-förhållande där kombinationen av förhöjd syrgashalt och minskad ventilation leder till en successivt minskad gasvolym i alveolen, som till sist sjunker ihop [21]. För 100 procent syrgas är denna kritiska V/Q-kvot 0,1, medan den vid luftandning är så låg som 0,001. Här ligger också förklaringen till att atelektaser i allmänhet inte uppstår vid luftandning, eftersom så låga V/Q-kvoter knappt förekommer i friska lungor. Under anestesi gäller alltså att områden i lungorna med luftvägsavstängning under hela andningscykeln (V/Q-kvot = 0) och högst blodgenomströmning kommer att kollapsa först, därefter områden med luftvägsavstängning under delar av andetaget och med kritiska V/Q-förhållanden i relation till förhöjda syrgashalter.
Även om det kan verka tilltalande att avstå från preoxygeneringen är det viktigt att komma ihåg att den syftar till att förlänga apnétoleransen och därmed öka säkerheten för patienten i samband med nedsövningen. Oförutsedda problem med luftväg och ventilation i inledningen av anestesin förekommer, om än sällsynt. Syrgasreserven i lungan skapar då extra tid att hantera och lösa dessa problem. I syfte att hitta en gyllene medelväg, med bibehållen apnétolerans och samtidigt minskad atelektasutveckling, studerade vår forskargrupp tillsammans med Hedenstierna atelektasutvecklingen efter preoxygenering med 80 procent syrgas. Det visade sig dock att det bildades i princip lika mycket atelektaser, men med viss fördröjning (den kritiska V/Q-kvoten uppnåddes alltså trots den lägre syrgashalten) [22]. Däremot påverkades apnétoleransen, som förkortades med 25 procent [23]. Rekommendationen att preoxygenera med 100 procent kvarstår därmed tills vidare [24]. Förklaringen till att atelektaser uppstår så snabbt vid anestesi är alltså att vi skapat optimala förutsättningar för detta genom att 1) fylla alla öppna alveoler med ren syrgas och 2) söva patienten så att luftvägsavstängning uppstår. Processen förstärks av att den höga syrgashalten och effekten av anestesimedel samtidigt minskar den hypoxiska vasokonstriktionen (HPV), som i vanliga fall starkt begränsar perfusionen till områden i lungan med låga V/Q-kvoter. Syrgasen påverkar alltså i sig fördelningen av V/Q-kvoter. Ytterligare bidragande faktorer är antagligen den sänkta hjärtminutvolymen som vanligen följer på anestesi-induktionen, samt en sänkning av blodtrycket i lungartärerna med effekt att en större andel av lungcirkulation styrs till de dorsala delar av lungorna där luftvägsavstängningen är som mest uttalad.
Hur kan atelektaser motverkas under anestesi?
I utvalda situationer används rekryteringsmanövrar som syftar till att blåsa upp lungan och därmed »rekrytera« sammanfallna alveoler. Nackdelen är att det krävs höga luftvägstryck med potentiella biverkningar i form av hemodynamisk påverkan och lungskada (pneumotorax). För att motverka att atelektaserna återuppstår efter en rekryteringsmanöver behövs också ett för situationen anpassat PEEP. Vid ett för lågt PEEP, eller för hög syrgashalt i inandningsluften, återkommer atelektaserna, vilket visades på lungfriska i ett arbete från Hedenstierna och medarbetare [25].
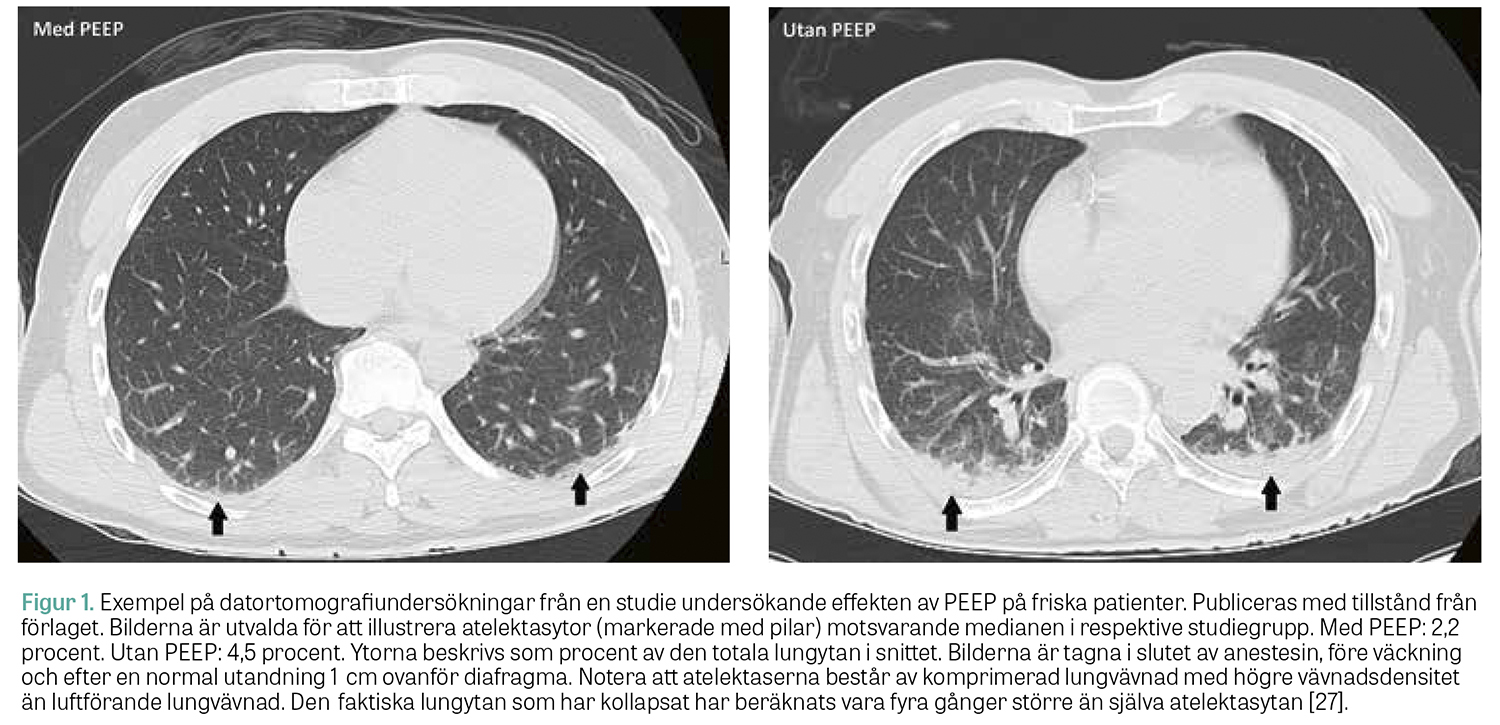
Vid mekanisk ventilation av sjuka/inflammerade lungor (i synnerhet vid ARDS) är lungrekrytering nödvändig för att kunna öppna upp sammanfallna lungavsnitt och förbättra gasutbytet i lungan. Vid anestesi av patienter med friska lungor är situationen annorlunda. Evidensläget är dock fortfarande otillräckligt för att kunna ge tydliga rekommendationer kring när, hur och hos vilka patienter som rekryteringsmanöver bör utföras [26]. En klinisk situation då lungrekrytering vanligen blir aktuell är när kraftigt överviktiga patienter opereras, i synnerhet vid större kirurgi. I gruppen friska, normalviktiga patienter som genomgår icke bukkirurgi har däremot flera studier från vår forskargrupp visat att rutinmässiga rekryteringsmanövrar inte behövs, utan enbart ett måttligt PEEP räcker för att lungorna ska vara i princip rena från atelektaser i slutet av anestesin, se Figur 1 [27]. Sannolikt verkar PEEP i detta sammanhang förebyggande om det appliceras tidigt, innan atelektaserna utvecklats till fullo. Möjligen har ett måttligt PEEP även en viss egen rekryterande effekt, förutsatt att lungvävnaden i övrigt är frisk och att atelektaserna är relativt nybildade. I Fakta 3 presenteras en strategi för att minimera atelektasutveckling under anestesi hos lågriskpatienter.
Tyvärr saknar vi fortfarande evidensbaserade rekommendationer för protektiv ventilation till högriskpatienter, de som löper störst risk för både atelektasutveckling, ventilatorinducerad lungskada och postoperativa lungkomplikationer. Det senaste decenniets stora randomiserade studier i ämnet har gett motstridiga resultat, och bästa praxis ligger för närvarande i handen på den enskilde anestesiologen. Troligen kommer det att förbli svårt att formulera allmängiltiga rutiner för denna patientgrupp. Ett optimalt omhändertagande av den enskilde riskpatienten kommer således att kräva en individualiserad mekanisk ventilation, vilket ställer krav på anestesiologens kompetens och förståelse för respirationsfysiologi.
Utforskandet och tillämpningen av sunda allmängiltiga respirationsfysiologiska principer var ett adelsmärke hos Göran Hedenstierna. Vi är säkerligen många som inspireras av att i hans anda fortsätta denna forskning i strävan efter att kunna erbjuda framtidens patienter en atelektasfri anestesi.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Göran Hedenstierna
Göran Hedenstierna (1941–2021), professor emeritus i klinisk fysiologi, var under många år aktiv forskare inom lungfysiologi, i synnerhet den lungfysiologi som är kliniskt relevant i samband med generell anestesi.
Fakta 2. Grundläggande begrepp
Apnétolerans: Hur länge en patient kan vara utan ventilation innan desaturation inträder (SpO2 <90 procent).
Atelektas: »Ofullständig utvidgning«, område med kollaberade alveoler och därmed upphävt gasutbyte.
Atelektrauma: Orsakas av repetitiv öppning och stängning av lungvävnad.
ARDS: akut svår lungsvikt (acute respiratory distress syndrome).
Barotrauma: Skador orsakade av höga inspiratoriska tryck eller höga drivtryck (skillnaden mellan PEEP och inspiratoriskt tryck).
Biotrauma: Frisättning av proinflammatoriska cytokiner från lungvävnaden med organ- och systempåverkan.
PEEP: Positivt slutexspiratoriskt tryck (positive end-expiratory pressure). Ett förhöjt utandningsmotstånd som ökar lungornas vilolungvolym.
Preoxygenering: Rutinen att ge 100 procent syrgas under några minuter före anestesistart.
Shunt: Venöst blod som når systemcirkulationens artärsida efter att ha passerat lungan utan gasutbyte.
Venös tillblandning: Summan av ren shunt och blod som inte syresatts tillräckligt efter att ha passerat områden i lungorna med försämrat gasutbyte.
Volutrauma: Skador orsakade av stora tidalvolymer.
Fakta 3. Minimering av perioperativa atelektaser hos lågriskpatienter
Gäller friska vuxna, BMI <30 kg/m2, ej stor bukkirurgi.
1. Preoxygenera med 100 procent syrgas i 3 min, eller tills utandad syrgashalt är >85 procent. Lätt höjd huvudända.
2. Applicera PEEP direkt efter intubation eller nedsatt larynxmask.
3. Använd PEEP 6 cm H2O om BMI <25 kg/m2, något högre om BMI ≥25 kg/m2.
4. Använd tidalvolym 6–8 ml/kg ideal kroppsvikt.
5. Använd som utgångsvärde under operationen en inandad syrgashalt på 35 procent.
6. Överväg lungrekrytering följt av individualiserat PEEP endast vid stark misstanke om betydande atelektasbildning, det vill säga syresättningsproblem utan annan förklaring.
7. Preoxygenera med 100 procent syrgas inför väckning och bibehåll PEEP.
8. Ge syrgas på uppvakningsavdelningen endast om perifer syremättnad (SpO2) är <94 procent.
Detta utgör en mindre modifiering av rekommendationen i [26). Modifieringen förklaras av att det rör en specifik grupp av patienter och att preoxygenering med 100 procent syrgas ingår som en integrerad del i omhändertagandet, i enlighet med gällande riktlinjer [24].