Eosinofila gastrointestinala sjukdomar hos vuxna är immunförmedlade och allergenutlösta tillstånd som kännetecknas av slemhinneeosinofili utan någon annan uppenbar orsak (till exempel infektion eller inflammatorisk tarmsjukdom, IBD).
Incidensen är som högst hos personer mellan 30 och 50 år.
Etiologin är okänd.
Den kliniska presentationen varierar, och symtomen kan vara ospecifika.
Klinisk misstanke, histologiska bevis och uteslutning av andra orsaker leder till diagnosen.
Eosinofila granulocyter är en typ av vita blodkroppar som ökar i antal och blir aktiva i samband med infektion eller allergi. Ett mindre antal eosinofila celler finns fysiologiskt i hela gastrointestinalkanalen förutom i esofagus. Eosinofilinfiltration av mag–tarmkanalen ses i varierande grad vid olika sjukdomar som parasitos eller bakteriella infektioner, inflammatoriska tarmsjukdomar, hypereosinofilt syndrom, bindvävssjukdomar, myeloproliferativa sjukdomar och läkemedelsöverkänslighet. De eosinofila granulocyterna har immunmodulerande funktioner, men kan också avdöda invaderande mikroorganismer och bidra till den fibros man ser vid den allergiska inflammationen. Utifrån lokalisation av infiltrationen delas eosinofila gastrointestinala sjukdomar in i eosinofil esofagit, eosinofil gastroenterit och eosinofil kolit.
Eosinofil esofagit
Eosinofil esofagit är en immunallergisk sjukdom med multifaktoriell etiologi. Den drabbar vuxna och har en incidens på 7,7/100 000 invånare och år [1]. Eosinofil esofagit är tre gånger vanligare hos män [2]. Mer än 65 procent insjuknar mellan 30 och 40 års ålder [3]. Prevalensen är högre i Europa och Nordamerika än i andra världsdelar [3]. Enligt en svensk studie av 1 000 icke-utvalda patienter som genomgick gastroskopi uppfyllde 1,1 procent de histologiska kriterierna för eosinofil esofagit [4]. Tidpunkten för diagnos varierar beroende på klimatzon och säsong och inträffar oftare under sommaren, särskilt i juni. Säsongsvariationerna är större i länder med kallare klimat [5].
Det spekuleras kring möjliga etiologiska mekanismer. En ökad permeabilitet i esofagusslemhinnan leder till antigenpresentation för det medfödda immunsystemet som framkallar aktivering av det förvärvade immunsystemet med en Th2 (T-hjälparceller typ 2)-inflammatorisk respons, som leder till ytterligare rekrytering och aktivering av eosinofila granulocyter. Antigener från genetiska och kemiska modifieringar som används vid odling, bearbetning och förpackning av livsmedel tros ha betydelse för insjuknande [6]. Likaså misstänks syrahämmande läkemedel leda till minskad nedbrytning av antigenerna som provocerar inflammation [7]. Lägre infektionsfrekvens av Helicobacter pylori är associerad med uppreglering av Th2 och inflammation [8]. Gastroesofageal refluxsjukdom leder till skada på intraepiteliala korsningar i esofagusslemhinnan, vilket ökar allergenpermeabiliteten och därmed risken för eosinofil esofagit [9].
Den kliniska presentationen av eosinofil esofagit varierar, men symtom som sväljningsbesvär, födoämnesobstruktion, kräkningar, bröstsmärta och svårbehandlad reflux dominerar hos vuxna [10]. Eosinofili i perifert blod (> 700 celler/mm3) har rapporterats [11], och hos barn med eosinofil esofagit kan specifikt immunglobulin E (IgE) mot livsmedel ibland hittas [12].
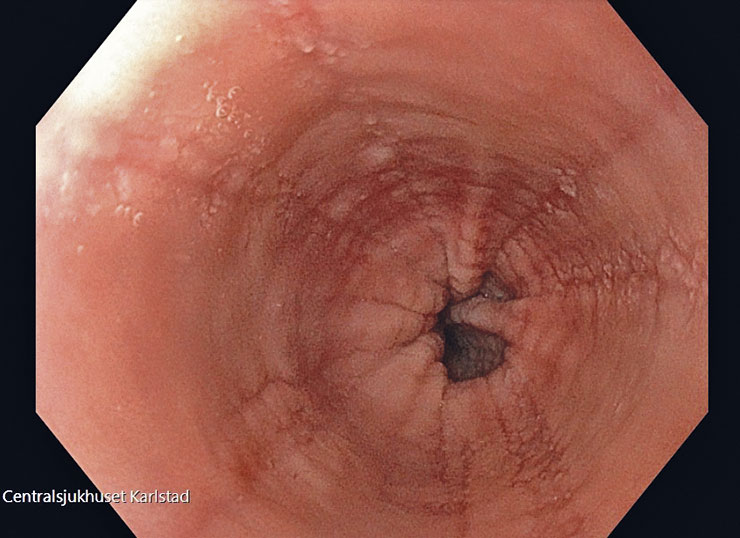
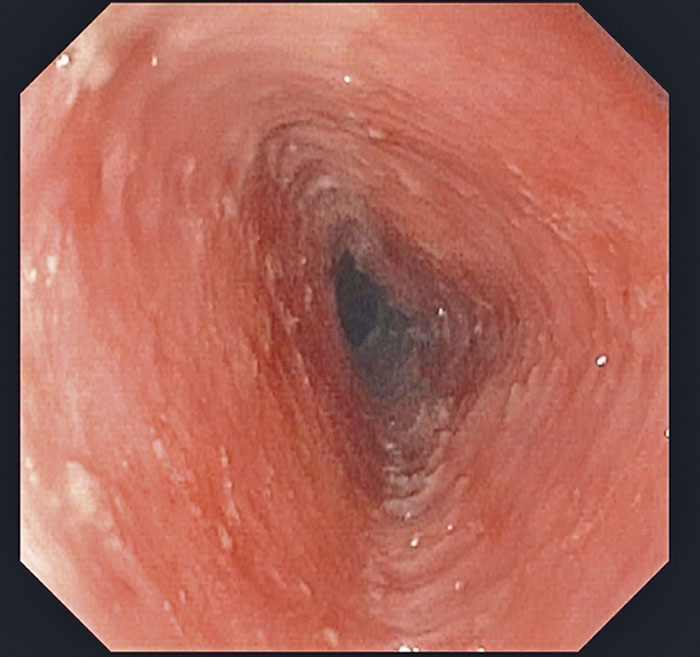
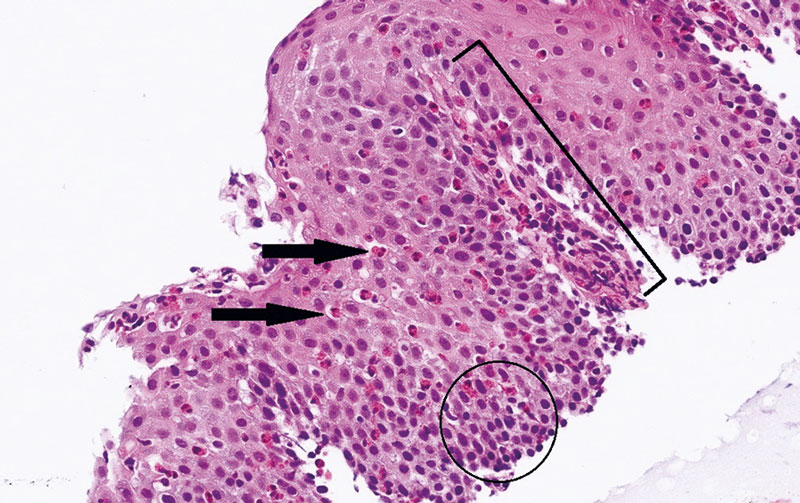
Etablerad standardmetod för att ställa diagnos är endoskopi med biopsi. Typiska endoskopiska tecken är longitudinella fåror, koncentriska ringar, vita exsudat som liknar candidainfektion, strikturer, smal esofagus (narrow caliber) och ytliga slemhinnesprickor efter endoskopintroduktion (Figur 1 och 2) [13]. Normal makroskopisk bild exkluderar inte diagnosen eftersom slemhinnan ser normal ut hos upp till 25 procent av patienter med eosinofil esofagit [14]. Vid klinisk misstanke om eosinofil esofagit bör därför biopsi göras även om slemhinnan makroskopiskt ser normal ut. Eftersom de inflammatoriska förändringarna i esofagusslemhinnan ofta är fläckvisa bör biopsier tas från den proximala, mellersta och distala tredjedelen av esofagus [15]. Studier har visat en sensitivitet på 100 procent när 6–9 biopsier tas från hela matstrupen [16]. Diagnosen ställs vid typisk histopatologisk bild av eosinofil infiltration med ≥ 15 eosinofila celler per högupplöst synfält (high power field, HPF) tagen åtminstone i mellersta eller proximala esofagus (Figur 3) i kombination med kliniska symtom (Fakta 1) [17]. Hos patienter med refluxsymtom kan 24-timmarsmätning av pH/impedansmätning övervägas för differentialdiagnos mellan eosinofil esofagit och gastroesofageal refluxsjukdom [18]. Tidigare ansågs esofaguseosinofili som försvann efter protonpumpshämmande behandling vara en särskild entitet, men senare studier tyder på att även dessa fall bör betraktas som eosinofil esofagit [19].
Behandlingsrekommendationerna baseras på klinisk erfarenhet och expertkonsensus. Målet med behandling är symtomfrihet och histologisk remission (< 15 eosinofila celler/HPF; djup remission ≤ 5 eosinofila celler/HPF). Behandlingsalternativ vid eosinofil esofagit är lokalt verkande (nedsvalda) kortikosteroider, protonpumpshämmare, eliminationsdieter och esofagusdilatation (i nämnd ordning). Behandlingssvaret varierar mellan patienter, trots att alla typer av behandlingar anses likvärdiga. Behandlingseffekten utvärderas endoskopiskt efter 6–12 veckor (induktionsbehandling) med esofagusbiopsier, eftersom det kan finnas diskrepans mellan kliniska symtom och graden av kvarvarande inflammation i slemhinnan. Underhållsbehandling med den lägsta möjliga effektiva dosen av läkemedlet anses vara motiverad i de flesta fall för att minska risken för långtidskomplikationer, framför allt esofagusstrikturer. Mer detaljerad information om praktiskt genomförande finns i det nya nationella vårdprogrammet för eosinofil esofagit hos vuxna från Svensk gastroenterologisk förening [20].
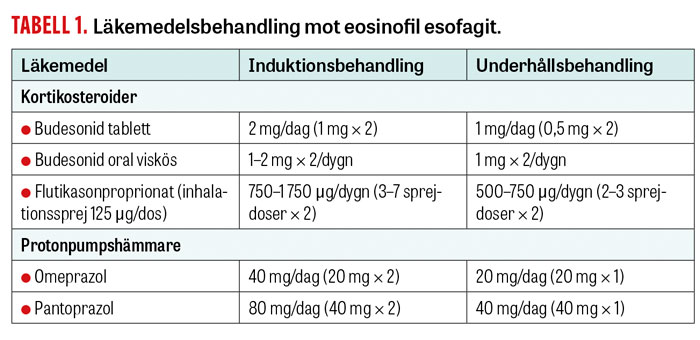
Bland kortikosteroider är det enda godkända läkemedlet för behandling av eosinofil esofagit budesonid munsönderfallande tablett 2 mg/dag fördelat på 2 doser [21] med 6 veckors induktionsbehandling. Behandlingen kan förlängas till 12 veckor vid utebliven remission [22]. I en nyligen genomförd klinisk prövning som jämförde budenosid i tablettform med placebo uppnåddes total remission hos 58 respektive 85 procent av patienterna vid behandling i 6 respektive 12 veckor. Total histologisk utläkning påvisades hos 95 procent av patienterna efter 12 veckor [22]. För att underhålla remission rekommenderas budesonid 1 mg/dag i tablettform (Tabell 1) [23]. Kortikosteroider i inhalationsform (budesonid, flutikason) och nässprej (flutikason, mometason) kan användas »off label«, och i en 5-årsuppföljning av 229 patienter var frekvensen av remission i inhalations- och nässprejgruppen bättre än hos dem utan behandling: för klinisk remission 31 vs 4,5 procent, endoskopisk remission 48,8 vs 17,8 procent, histologisk remission 44,8 vs 10,1 procent och total remission 16,1 vs 1,3 procent [24]. Esofageal candidiasis (5–30 procent) och binjureinsufficiens (16 procent) har beskrivits som de vanligaste komplikationerna vid steroidbehandling [25, 26]. Kliniska studier av behandling med monoklonala antikroppar såsom infliximab, mepolizumab och omalizumab har hittills inte visat god effekt mot eosinofil esofagit, och dessa rekommenderas därför inte. Det pågår dock ett flertal studier som prövar både steroider i andra beredningsformer och andra monoklonala antikroppar såsom cendakimab, dupilumab (fas 3, klinisk läkemedelsutveckling), vedolizumab och antolimab.
Protonpumpshämmare har såväl syrahämmande som antiinflammatorisk effekt i esofagus och rekommenderas i dosen 40–80 mg/dag fördelat på 2 doser som induktionsbehandling i 8 veckor (total remission 60,8 procent) och nedtrappning till 20–40 mg/dag som underhållsbehandling (total remission 83 procent) (Tabell 1) [27, 28].
Kostterapi är en icke-farmakologisk intervention och delas in i elementarkost, eliminationskost och eliminationskost baserad på allergitest.
Elementarkost innebär elimination av alla livsmedel, och i stället ges syntetiska aminosyror i form av dryck fri från intakta proteiner eller peptider, men innehållande kolhydrater, fett, mineraler och mikronäringsämnen. Den har visat sig vara lika effektiv som steroidbehandling vid eosinofil esofagit avseende symtomlindring och histologisk remission hos 90,8 procent av patienter [29].
Eliminationskost baseras på empirisk elimination av vanliga matallergener. Tidigare har »6-food elimination diet« varit den mest populära metoden, med borttagande av mjölk, vete, ägg, soja, nötter och fisk/skaldjur med histologisk remission hos 71,3 procent av vuxna patienter [29]. Mindre effektiva metoder som »4-food elimination diet« (mjölk, vete/gluten, ägg och baljväxter) och »2-food elimination diet« (mjölk och vete/gluten) har kommit på senare år, med uppnådd histologisk remission i 54 respektive 43 procent av fallen [30, 31]. Numera rekommenderas de mindre restriktiva metoderna som förstahandsval med tanke på bättre följsamhet.
Tillgängliga blod- och hudtest för matallergi är opålitliga för att förutsäga vilka livsmedel som är orsaken. Därför rekommenderas inte eliminationskost baserad på allergitest hos patienter med eosinofil esofagit, särskilt inte hos vuxna [32].
Hur omfattande eliminationskost som bedöms vara motiverad inledningsvis beror på svårighetsgraden av såväl symtom som endoskopiska förändringar i esofagus samt patientens önskan och motivation. Fler eliminerade livsmedel kan leda till sämre livskvalitet och följsamhet till behandling. Elimination av endast mjölk leder till förbättring hos en tredjedel av patienter med lindriga symtom och beskedliga endoskopiska fynd. Patienterna som inte svarar på mjölkfri kost kan rekommenderas utvidgad eliminationskost. Hos patienter med svåra symtom som inte är intresserade av farmakologisk behandling kan det vara bättre att direkt inleda behandling med »6-food elimination diet« eller elementarkost.
Hos patienter med dysfagi till följd av eosinofil esofagit med fibrotisering är esofagusdilatation en av de mest effektiva behandlingarna, med klinisk förbättring hos 95 procent av patienterna. Behandlingen är dock endast symtomlindrande och har ingen inverkan på den underliggande inflammationen [33]. Risken för perforation vid dilatation ligger mellan 0,3 och 0,4 procent och är associerad med riskfaktorer som aktiv inflammation, långvarig dysfagi med upprepade episoder av födoämnesobstruktion, tidigare dilatationer samt användning av endoskop för att trycka mat ned i ventrikeln. Kortikosteroidbehandling i minst 12 veckor rekommenderas innan esofagusdilatation övervägs [34].
Eosinofil gastroenterit och eosinofil kolit
Eosinofil gastroenterit och eosinofil kolit är mindre vanliga än eosinofil esofagit och karakteriseras av infiltration av eosinofila celler i magsäckens respektive tarmens vägg. Prevalensen är sannolikt underskattad på grund av bristande diagnostisering och rapportering, men beräknas vara 1–20 fall per 100 000 personer [35], med högst förekomst i 30–50-årsåldern [36, 37] för eosinofil gastroenterit samt hos nyfödda och unga vuxna för eosinofil kolit. Riskfaktorer tycks vara manligt kön, högre socioekonomisk status, europeiskt ursprung och övervikt. Sambandet mellan sjukdomen och grupper med högre socioekonomi liknar det vid inflammatoriska tarmsjukdomar och kan indikera en liknande teoretisk etiopatogenes med frånvaro av tidig antigenpresentation [38–40]. De flesta patienterna, upp till 70 procent, har egen eller familjär anamnes av atopiska sjukdomar som astma, eksem och läkemedels- eller matöverkänslighet [41, 42]. Några studier har visat ett samband med andra autoimmuna sjukdomar som celiaki [43], ulcerös kolit [44] och systemisk lupus erythematosus [45].
Patogenesen har visats vara beroende av IgE samt en fördröjd Th2-medierad allergisk mekanism. Dessutom spelar interleukiner (IL-4, IL-5, IL-13) och cytokiner (eotaxin-1 och integrin α4β7) en viktig roll i expansionen och rekryteringen av eosinofiler till gastrointestinalkanalen respektive infiltration i tarmväggen. De aktiverade eosinofilerna utsöndrar inflammatoriska mediatorer som leder till strukturella skador i tarmväggen [46-48]. Det vanligaste infiltrationsstället är slemhinnan, men också submukosa, yttre muskellagret (muscularis) och serosa kan drabbas med en hypotetisk centrifugal sjukdomsprogression [39].
Symtomen är inte sjukdomsspecifika och kan ses vid olika andra sjukdomar, vilket kan leda till omfattande utredning och fördröjning av diagnosen [49]. Utifrån eosinofilinfiltrationens lokalisation och djup presenterar sig sjukdomen kliniskt med olika symtom.
Sjukdom lokaliserad till slemhinnan (mukosa) ger ospecifika gastrointestinala symtom som buksmärta, illamående och kräkningar. Svårare symtom som blödning, malabsorption och proteinförlorande enteropati kan förekomma i vissa fall [50-52].
Infiltration av yttre muskellagret orsakar väggförtjockning som i sin tur leder till obstruktion. Eosinofilorsakad antrum- och pylorusstenos finns rapporterad hos vuxna [53, 54]. Tunntarmsobstruktion kan, mer sällsynt, förekomma i jejunum [55] och ileum [56]. Sjukdomspresentationen vid eosinofil kolit varierar från ett akut men självbegränsande blodigt diarrétillstånd till en kronisk kolit med buksmärtor och/eller kronisk diarré [57].
Den ovanligaste formen av eosinofil gastroenterit och eosinofil kolit är eosinofil infiltration i det yttersta lagret av tarmväggen (serosa) som typiskt presenterar sig kliniskt med antingen isolerad ascites eller en kombination av ascites och symtom som vid andra former, till exempel mukosa- eller muscularisinfiltration [58]. Eosinofil pleurit och/eller perikardit kan förekomma i samband med eosinofil ascites, som en multipel serös membranutgjutning, och kan vara första kliniska manifestation [59].
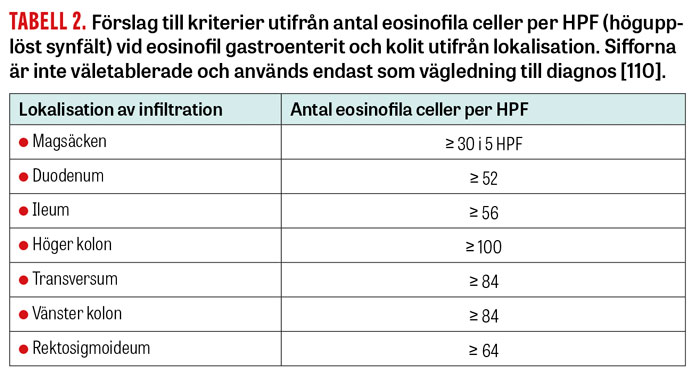
För att ställa diagnosen används tre kriterier: klinisk misstanke, histologiska bevis för eosinofil infiltration i ett eller flera områden av gastrointestinalkanalen eller närvaro av högt antal eosinofila celler i ascitesvätska samt uteslutning av andra orsaker till eosinofilinfiltration [60]. I nuläget saknas diagnostiska konsensusriktlinjer för eosinofil gastroenterit och eosinofil kolit. Förslag till diagnostiska kriterier utifrån grad av eosinofilinfiltration i olika delar av gastrointestinalkanalen listas i Tabell 2. Förslagen är dock endast baserade på resultat från en enskild studie och således inte väletablerade, men kan ge viss diagnostisk vägledning.
Anamnestiska uppgifter om särskilda mat- och andra allergier samt andra former av atopi som astma, rinit och eksem, tillsammans med blodprov för utredning av perifer eosinofili, är vägledande. Perifer eosinofili inträffar hos 20–30 procent av patienter med eosinofil gastroenterit, särskilt vid former med engagemang av serosa. Högre grad av perifer eosinofili med ≥ 700 celler/μl är indikation på underliggande eosinofil sjukdom [61, 62].
Allergiutredning för att identifiera specifika allergener som kan utlösa symtomen och bidra till sjukdomens patogenes kan göras, men användbarheten för eosinofil gastrointestinal sjukdom är begränsad på grund av att allergitestning utvärderar IgE-medierad respons, medan utveckling av eosinofil gastrointestinal sjukdom sannolikt är resultatet av en kombinerad IgE- och icke-IgE-medierad Th2-fördröjd respons [63, 64].
Etablerad standardmetod för att ställa diagnosen är histologi, varför endoskopisk undersökning med biopsi är avgörande. Makroskopiskt kan slemhinnan variera från normal till en bild av ospecifik gastrit eller enterit [65]. Det har rapporterats fynd som slemhinnerodnad, skörhet, sårigheter, förtjockning av slemhinnans veck (rugae gastricae) eller vita fläckar och polyper [66-68]. Även om endoskopi har en god detektionsgrad av avvikelser i slemhinnan [65] kan normal slemhinna maskera ca 60 procent av histologiskt verifierad sjukdom på grund av ojämn fördelningsprofil, varför åtminstone 5–6 biopsier bör tas från både endoskopiskt onormal och normal slemhinna [69]. Endoskopiskt ultraljud är användbart för att detektera muskel- och serosalt engagemang, eftersom det underlättar åtkomst till dessa vävnader för biopsi [70].
Ultraljud av buken är en användbar metod för att upptäcka tarmväggsförtjockning, ascites och peritoneala noduli som kan indikera eosinofil gastroenterit och vara vägledande för perkutan biopsi [71]. Dessutom kan datortomografi användas för att upptäcka obstruktion, både i magsäcken och tunntarmen, och för att utesluta tumör [72]. Röntgenundersökningar med bariumkontrast kan visa antrumstenos i varierande grad, oregelbundenhet i slemhinnan i magsäcken samt väggförtjockning i tunntarmen på grund av ödem [73, 74]. Radiologiska tecken är oftast ospecifika (i 60–70 procent av fallen), såsom nodularitet i tarmvägg, ringformiga väggförtjockningar, långsträckta väggförtjockningar från colon ascendens till descendens och »araneid limb-like sign« (spindelbenutseende på grund av diffust förtjockade slemhinneveck) i colon ascendens och transversum [75].
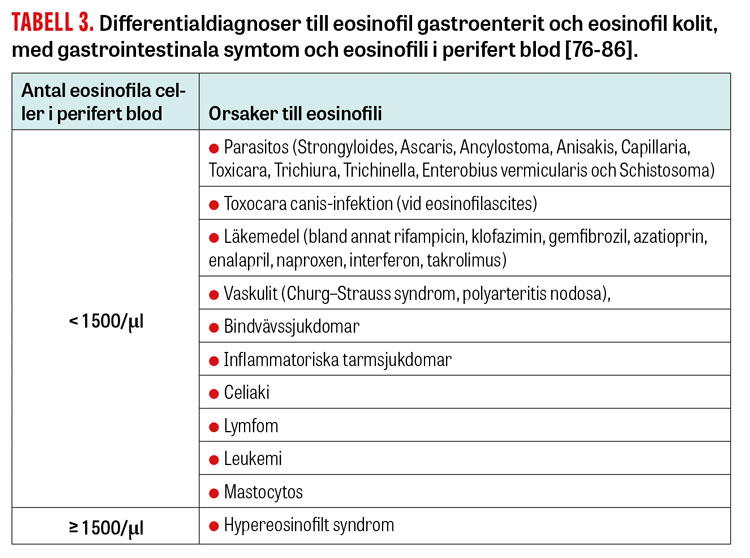
Differentialdiagnoser till eosinofil gastroenterit och eosinofil kolit, andra tillstånd som kan ge gastrointestinala symtom och vara associerade med eosinofili i perifert blod, presenteras i Tabell 3 [76-86].
Även om prevalensen av Helicobacter pylori-infektion är signifikant lägre hos patienter med eosinofil gastroenterit jämfört med normalbefolkningen [87], har behandling med protonpumpshämmare visats minska utbredning av duodenal eosinofilinfiltration hos patienter med eosinofil gastroenterit [88]. Dessutom har eradikeringsbehandling rapporterats ha en botande effekt [89].
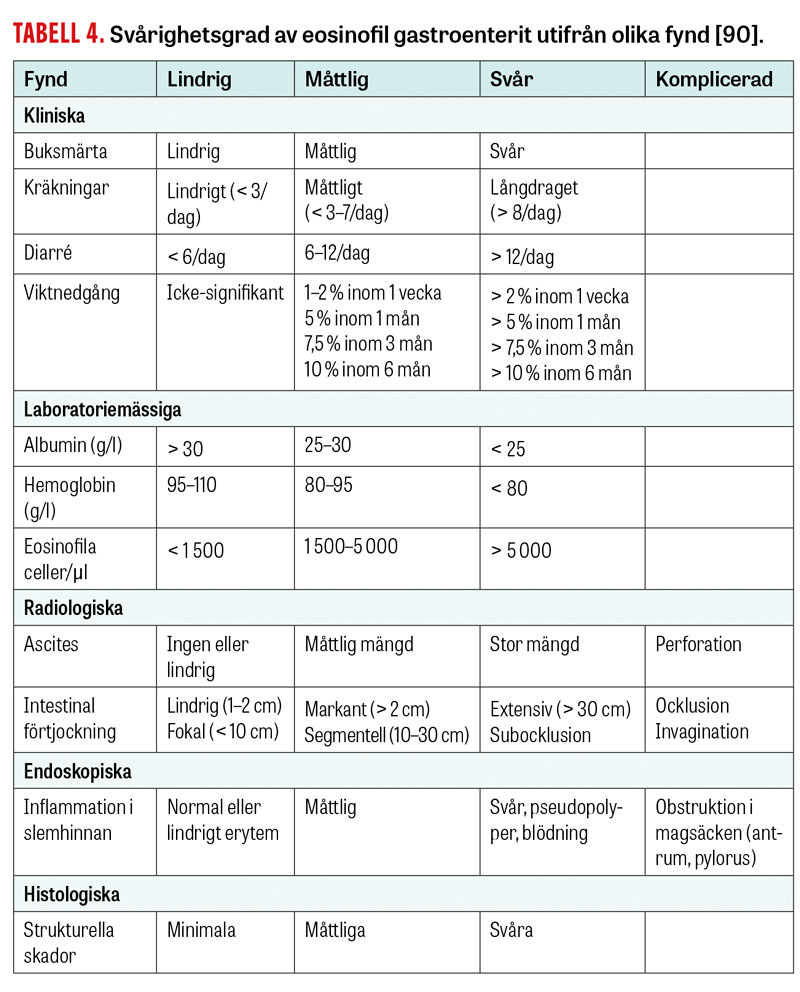
Indelning av eosinofil gastroenterit i fyra grupper enligt svårighetsgrad har föreslagits (Tabell 4) [90].
Riktlinjer för behandling av eosinofil gastroenterit och eosinofil kolit saknas på grund av brist på stora prospektiva kontrollerade studier; således är behandlingen empirisk och baserad på svårighetsgraden av kliniska, laboratoriemässiga, radiologiska, endoskopiska och histologiska fynd.
Eradikeringsbehandling mot H pylori bör erbjudas hos bärare av bakterien. I behandlingen ingår protonpumpshämmare. Dessutom har klaritromycin visats ha en immunmodulerande effekt och används därför som underhållsbehandling vid steroidberoende eosinofil gastroenterit som är i remission [91].
Elementar- och eliminationskost har effekt på kliniska symtom samt ger minskning av eosinofil infiltration hos patienter med eosinofil esofagit och används även vid eosinofil gastroenterit eller eosinofil kolit [92]. Om utredningen påvisar matallergener rekommenderas patienter följa en riktad eliminationsdiet [90].
En hörnsten i terapin för eosinofil gastroenterit och eosinofil kolit är kortikosteroider, som används vid svår sjukdom vid debut eller om kostterapi inte ger effekt eller inte kan genomföras [93]. Studier har visat snabb remission vid induktionsbehandling och ihållande remission vid underhållsbehandling [36, 60, 94]. Brist på respons vid steroidbehandling bör föranleda omvärdering av diagnosen [95, 96]. Den rekommenderade dosen av prednisolon vid induktionsbehandling är 0,5–1 mg/kg kroppsvikt per dag för remission inom 2 veckor, särskilt hos patienter med engagemang av serosa [97]; därpå följer nedtrappning under 6–8 veckor. Ungefär 20 procent av patienterna som får prednisolon kommer att återinsjukna, och underhållsbehandling med lägre steroiddoser eller upprepade steroidkurer kan då behövas [40]. Ett alternativ till systemisk kortikosteroidbehandling vid tarmengagemang är budesonid, som har lokalverkande effekt och låg systemisk biotillgänglighet på grund av sin höga första passagemetabolism i levern, vilket minskar systemiska biverkningar [98]. Den initiala rekommenderade dosen är 9 mg/dygn som induktionsbehandling, vilken kan trappas ned till 6 mg/dygn som underhållsdos.
Azatioprin används som steroidsparande hos patienter med antingen steroidberoende eller refraktär sjukdom i dosen 2–2,5 mg/kg kroppsvikt/dygn [44, 99]. En annan steroidsparande behandling för eosinofil gastroenterit och eosinofil kolit är montelukast, som i dosen 5–10 mg/dygn har visat signifikant effekt, antingen som monoterapi eller i kombination med steroider för induktions- och underhållsbehandling vid steroidberoende eller refraktär sjukdom [100, 101]. Kromoglicinsyra har i enstaka fall rapporterats ha effekt hos patienter med eosinofil gastroenterit med engagemang av slemhinna eller serosa (dosering 100–300 mg 4 gånger dagligen) [102]. Läkemedel såsom cendakimab och dupilumab är under utveckling (fas 3) och kan komma att bli framtida behandlingsalternativ hos patienter med de olika eosinofila gastrointestinala sjukdomarna [103, 104]. Infliximab har rapporterats vara en effektiv induktionsbehandling vid refraktär eosinofil gastroenterit, men dess användning begränsas av risk för avtagande respons över tid. I dessa fall kan adalimumab vara ett alternativ [106]. Omalizumab (anti-IgE) har rapporterats resultera i ett signifikant histologiskt svar, men är sannolikt inte en effektiv behandling av patienter med serum IgE-nivå > 700 kIE/l [103, 107].
Kirurgi är indicerad i svåra komplicerade fall med perforation, ocklusion eller invagination (intussusception). Ungefär 40 procent av patienter med eosinofil gastroenterit kommer att behöva genomgå kirurgi under sina liv, och 50 procent av dem kommer att uppleva ihållande symtom trots operation [94].
Fekal transplantation har rapporterats ha klinisk effekt i kombination med prednisolon [108]. Intravenöst immunglobulin och interferon-alfa har visats ge effekt i enstaka rapporterade fall med refraktär och steroidberoende eosinofil gastroenterit [44, 109].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Diagnostiska kriterier för eosinofil esofagit (American College of Gastroenterology) [17].
- Symtom relaterade till esofageal dysfunktion.
- Eosinofildominerad inflammation med ≥ 15 eosinofila celler/HPF (högupplöst synfält) i minst en biopsi från mellersta eller proximala esofagus.
- Frånvaro av andra sjukdomar som kan vara associerade med ökad förekomst av eosinofila celler i esofagusslemhinna (Crohns sjukdom, parasitinfektioner, hypereosinofilt syndrom, akalasi, vaskulit, pemfigus, bindvävssjukdomar, transplantat kontra värd-sjukdom, läkemedelsöverkänslighet).
Samtliga kriterier bör vara uppfyllda för diagnosen eosinofil esofagit.