Den vetenskapliga litteraturen talar för att epilepsikirurgi är en effektiv behandling med låg risk för allvarliga komplikationer.
Epilepsikirurgin framstår som underutnyttjad, och remitteringen till epilepsikirurgisk utredning behöver öka.
Epilepsikirurgi bygger på ett uttalat multidisciplinärt arbetssätt.
En epilepsikirurgisk utredning innefattar analys av anfallssemiologi, MRT, anfallsregistrering, neuropsykologisk bedömning och ibland även andra modaliteter. I vissa fall krävs därtill invasiv EEG-registrering.
För att förbättra tillgång till epilepsikirurgisk utredning och behandling behöver kunskapen om epilepsikirurgi öka i alla delar av vården där epilepsi handläggs.
Epilepsi är den vanligaste kroniska neurologiska sjukdomen och innebär en benägenhet för upprepade epileptiska anfall [1]. Forskningsprojektet Global Burden of Disease har rankat epilepsi som nummer två bland neurologiska sjukdomar avseende förlorade friska levnadsår [2]. Epilepsi är, utöver benägenheten för epileptiska anfall, förknippat med andra neurologiska och psykiska hälsoproblem samt nedsatt livskvalitet. 0,6–0,7 procent av befolkningen beräknas ha aktiv epilepsi, vilket i Sverige innebär 60 000–70 000 individer, varav cirka 10 000 är barn [3]. 3,8 procent av befolkningen beräknas någon gång under livet uppfylla diagnoskriterier för epilepsi [4].
Tidig diagnos av läkemedelsresistent epilepsi, remiss till specialiserat epilepsicentrum för bedömning samt tillgång till tidig kirurgi har visat sig vara kopplade till förbättring i anfallssituation, barns neurologiska utveckling och kognitiv nivå [5]. Epilepsikirurgi kan vara effektiv efter lång sjukdomsduration, även om detta förefaller vara en negativ prediktor för anfallsfrihet [6, 7]. Avancerad utredning vid läkemedelsresistent epilepsi samt tillgång till resektiv epilepsikirurgi är centrala rekommendationer i Socialstyrelsens »Nationella riktlinjer för vård vid epilepsi« från 2019 [8].
Internationella data tyder på att epilepsikirurgisk behandling är underutnyttjad [9, 10]. I Sverige opereras färre patienter per capita än i våra nordiska grannländer [11]. För närvarande pågår en process i Socialstyrelsens regi om nationell högspecialiserad vård vid svårbehandlad epilepsi, där beslut ska fattas om huruvida epilepsikirurgisk utredning och behandling ska centraliseras.
Forskning baserad på det svenska epilepsikirurgiregistret SNESUR har bidragit till kunskapsutveckling på området. För att förbättra remittering och tillgång till epilepsikirurgisk utredning och behandling behöver dock kunskapen öka i alla delar av vården där patienter med epilepsi sköts. En artikel i Läkartidningens temanummer om epilepsi 2018 beskrev den epilepsikirurgiska utredningsprocessen samt risker och resultat vid kirurgi [12]. I denna artikel fokuserar vi på att beskriva det multidisciplinära arbetssättet och den växande arsenalen av undersökningsmetoder, kirurgiska behandlingsmetoder samt tekniker för neurostimulation.
Läkemedelsresistens och multidisciplinära team
Etiologin vid epilepsi är heterogen och prognosen, som till betydande del beror på etiologin, är högst varierande. Orsakerna är oftast strukturella, genetiska eller bådadera.
Traditionellt har en sjukdomsorsak kunnat specificeras i endast en tredjedel av alla epilepsifall. Detta har bidragit till att epilepsibehandlingen huvudsakligen har varit symtomlindrande.
ILAE (International League Against Epilepsy) definierar läkemedelsresistent epilepsi som epilepsi där anfallsfrihet ej uppnåtts efter två lämpliga antiepileptika prövade i adekvata doser [13-15]. Definitionen syftar till att tidigt upptäcka individer som kan vara kandidater för icke-farmakologisk behandling. Cirka en tredjedel av alla med epilepsi utvecklar läkemedelsresistens [16, 17]. En del av dem kan uppnå anfallsfrihet med modifierad läkemedelsbehandling, i vissa fall långvarig eller bestående, medan andra växlar mellan perioder med anfallsfrihet och återfall. En grupp uppnår aldrig sammanhängande anfallsfrihet. Andelen patienter som anses vara kandidater för epilepsikirurgi och bör få tillgång till avancerad utredning varierar stort i litteraturen, från 10 till 50 procent av individer med läkemedelsresistent epilepsi [18]. 1 av 25 barn med epilepsi uppskattas kunna vara hjälpt av kirurgi, vilket skulle motsvara upp till 60 barn per år i Sverige, att jämföras med de 15–20 barn som i nuläget opereras varje år [19]. Konsekvenserna för den enskilda individen och dess familj är betydande, och sjukdomen medför stora samhällskostnader [8, 20].
En epilepsikirurgisk utredning syftar till att kartlägga vilken typ av epilepsi som föreligger, samt om kirurgisk behandling är lämplig. För att så ska vara fallet bör följande förutsättningar gälla:
Det epileptiska anfallets startområde kan lokaliseras och avgränsas.
Avlägsnande av hjärnvävnaden i detta område är möjlig att genomföra på ett säkert sätt och med acceptabel riskprofil.
Chansen till förbättrad anfallssituation är tillräckligt hög för att motivera ett irreversibelt ingrepp.
I denna värdering av risk och nytta är patientens egen inställning central, vilket förutsätter en delaktig och välinformerad individ, samt informerade anhöriga. Det senare är särskilt viktigt när det gäller barn samt vuxna individer med intellektuell funktionsnedsättning.
Den information som ska insamlas, tolkas och sammanställas vid en epilepsikirurgisk utredning är komplex. Utredningen behöver därför ske i ett multidisciplinärt team för att säkerställa kompetensen. Teamet behöver ha kunskap om samtliga tillgängliga undersöknings- och behandlingsmetoder. Neurolog, barnneurolog, neurofysiolog, neuroradiolog, neuropsykolog, biomedicinska analytiker och för barn ofta även logoped, arbetsterapeut och sjukgymnast, samtliga med särskild epilepsikompetens, behöver samverka i teamet och vid regelbundna fallkonferenser. Epilepsisjuksköterskan och kunnig omvårdnadspersonal vid video-EEG på en epilepsiövervakningsenhet (EMU) har också viktiga roller. Utifrån den samlade informationen i det enskilda fallet görs en bedömning av vilken behandling som är möjlig och lämplig.
Epilepsikirurgi av resektiv typ vid fokal epilepsi är den enda i nuläget tillgängliga behandling som är potentiellt botande. Även vid multifokal eller generaliserad epilepsi kan kirurgisk behandling vara aktuell, men då av icke-botande, palliativ typ såsom kallosotomi. För vissa individer med läkemedelsresistens, där kirurgi inte bedöms lämplig, kan behandling med neurostimulation eller ketogen kost vara bra alternativ. Tillgången till kostbehandling är i nuläget begränsad, framför allt för vuxna patienter.
Undersökningsmetoder
En epilepsikirurgisk utredning vilar, liksom all bedömning av epilepsi, på en utförlig anamnes med särskilt fokus på anfallens utseende från start till slut och hur de upplevs av patienten själv (semiologin). En första hypotes rörande anfallsursprung kan ofta formuleras baserat på detta. I basutredningen ingår därtill radiologisk utredning med MRT samt video-EEG och en neuropsykologisk bedömning. Ofta krävs därutöver kompletterande mer avancerade utredningar med icke-invasiva och i vissa fall invasiva undersökningar.
Neuropsykologisk undersökning. Neuropsykologisk undersökning genomförs av neuropsykolog med erfarenhet av epilepsikirurgiutredning, dels som en pusselbit i kartläggningen av det anfallsgenererande området, dels för att bedöma individens kognitiva förutsättningar och lämplighet för kirurgi. Vid kirurgi följs kognitiva funktioner upp efter operationen.
Video-EEG med skalpelektroder. Grunden för den neurofysiologiska utredningen är registrering av anfall med video-EEG för att kartlägga individens habituella anfall. Vid glesa anfall används ibland sömndeprivation eller läkemedelsreduktion för att anfall ska kunna registreras. Undersökningen syftar till att bilda en hypotes om var anfallen startar. Video-EEG ger även möjlighet att studera semiologin i detalj. Kvaliteten på denna undersökning är avgörande, och den bör både av denna anledning och av säkerhetsskäl utföras med övervakning dygnet runt av särskilt utbildad personal på en epilepsiövervakningsenhet.
Magnetresonanstomografi (MRT). Den strukturella avbildningen görs med MRT av hjärnan med särskilt epilepsiprotokoll med tunna snitt, helst med magnetfältsstyrka 3T, och åtminstone en gång med kontrastförstärkning. Ibland kan den radiologiska utredningen behöva kompletteras med funktionell MRT, för att bedöma språklateralisering, eller med magnetfältsstyrka 7T.
Positronemissionstomografi (PET). PET med 18F-märkt glukos (FDG-PET) kan påvisa områden med nedsatt glukosupptag (hypometabolism). Epileptogen vävnad har ofta nedsatt metabolism. PET görs med DT eller MRT. I liten utsträckning används också andra ligander än glukos. PET används framför allt vid normala eller svårtolkade radiologiska fynd för att lokalisera eller åtminstone lateralisera epileptogent område.
Iktal och interiktal enfotonstomografi (SPECT). SPECT är en funktionell avbildningsmetod som med hjälp av isotopteknik identifierar regionalt ökade blodflöden under anfall. Därefter kan den interiktala registreringen subtraheras från den iktala och MRT-bilder adderas (så kallad SISCOM). Metoderna är användbara för att styrka hypotes om anfallslokalisation och används när övrig icke-invasiv utredning inte ger en entydig bild av anfallsgenererande område.
Navigerad transkraniell magnetstimulering. Navigerad transkraniell magnetstimulering är en undersökningsmetod som kombinerar rumslig information från MRT med funktionell icke-invasiv stimulering av kortex. På så vis kan man kartlägga områden i hjärnan som ansvarar för viktiga funktioner, exempelvis språk och motorik, före kirurgi.
Magnetencefalografi (MEG). Magnetencefalografi mäter magnetiska fält och kompletterar EEG, som mäter elektriska fält. Den är bättre på att fastställa tangentiell epileptisk aktivitet i kortex och kan ofta ge en mer högupplöst bild av denna än sedvanlig EEG-teknik.
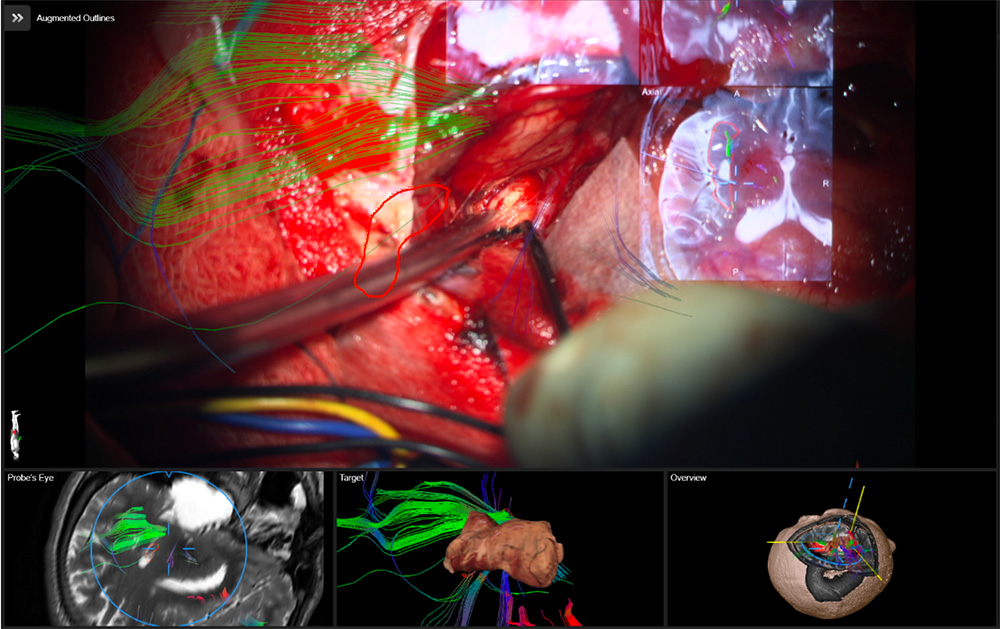
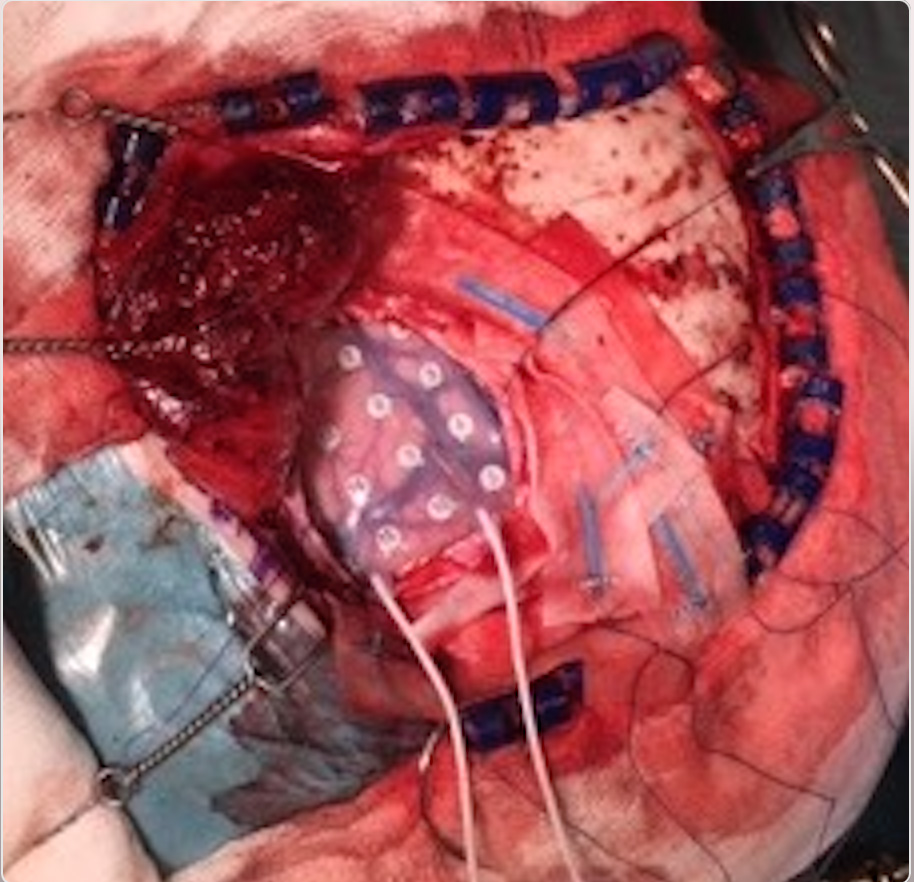
Invasiv EEG-utredning. Fokal epilepsi, där den icke-invasiva utredningen givit svårtolkade resultat, men där en hypotes om anfallsursprung finns, kan ibland motivera invasiv anfallsregistrering med intrakraniella elektroder för att kartlägga anfallsstart och spridningsvägar. Historiskt sett har både plattelektroder och djupelektroder använts, men på senare tid har invasiv anfallsregistrering kommit att domineras av stereotaktiskt implanterade elektroder (SEEG), där man med hjälp av robotassisterad eller rambaserad stereotaktisk teknik kan implantera EEG-elektroder med hög precision i de områden som misstänks vara anfallsgenererande (Figur 1) [21]. Ofta krävs 10–15 elektroder. Elektrisk stimulering med SEEG-elektroder används dessutom för att lokalisera elokventa områden, framför allt för språk, och för att se var habituella anfall kan triggas. I bästa fall kan ett tydligt anatomiskt område avgränsas och resekeras kirurgiskt (Figur 2). Intraoperativ EEG (kortikografi) kan användas för att registrera interiktal epileptiform aktivitet under operation (Figur 3).
Kirurgiska metoder
Lesionektomi. I fall där en tydlig, resekabel förändring går att urskilja vid radiologi, och denna lesion överensstämmer med anfallssemiologi och EEG-bild, kan man erbjuda kirurgi i form av lesionektomi. De vanligaste patologierna är fokala kortikala dysplasier, medan gangliogliom och dysembryoplastiska neuroepiteliala tumörer representerar de vanligaste tumörformerna kopplade till epilepsi [22].
Tumörlokalisationen är också avgörande för huruvida en lesion blir epileptogen. Frontotemporal eller parietal lesion nära kortex är kopplad till störst risk att utveckla epilepsi [23]. I elokventa områden, till exempel nära talcentrum eller motorarea, kan vakenkirurgi övervägas för att minimera postoperativ neurologisk påverkan.
Temporallobsresektion. I de fall anfallsstarten bekräftas ligga i temporalloben kan patienten erbjudas en temporallobsresektion. Detta innebär fullständigt avlägsnande av både amygdala och hippocampus, som ofta är strukturer som underhåller anfallsaktiviteten i temporallobsepilepsi. Temporallobsresektion är ett av de vanligaste epilepsikirurgiska ingreppen. Ibland kan man överväga att göra en selektiv amygdalo-hippokampektomi, alternativt spara dessa och enbart resekera temporalloben. Den klassiska temporallobsresektionens omfattning är 3–5 cm av främre laterala kortex. En viktig aspekt vid denna typ av kirurgi är att ta hänsyn till språklateralitet samt patientens samlade kognitiva kapacitet, då amygdalo-hippokampektomi har viss risk för kognitiv påverkan. Det föreligger även en liten risk för synfältspåverkan.
Vid lesionektomi samt amygdalohippocampektomi ligger graden av postoperativ långsiktig anfallsfrihet kring 60–65 procent [23, 24].
Kallosotomi. När en fokal resektion inte är möjlig och patienten lider av så kallade droppattacker såsom vid Lennox–Gastauts syndrom kan det vara aktuellt att kapa förbindelserna mellan hemisfärerna genom en kallosotomi (Figur 4) [25]. En komplett kallosotomi beskrivs lindra droppattackerna i ungefär 80 procent av fallen; dock är effekten något bättre hos barn jämfört med vuxna. Kallosotomi har trots sin goda effekt vissa nackdelar, framför allt i form av risk för nedsatt kommunikation mellan hjärndelar (så kallat disconnection syndrome) som kan påverka högfungerande patienter. Detta kan ibland göra att det är fördelaktigt att överväga en partiell kallosotomi, där de främre tvåtredjedelarna av corpus callosum delas [26, 27].
Hemisfärotomi. Vid svår epilepsi i ena hemisfären och tillhörande hemipares kan vissa individer vara aktuella för en hemisfärotomi, där den sjuka hjärnhalvan helt kopplas bort. Det är framför allt barn som kan vara aktuella för denna typ av ingrepp. Ofta har den friska hemisfären redan övertagit funktioner från den sjuka hjärnhalvan.
Ingreppet kan göras med ett flertal olika tekniker, och tillgängliga studier visar på en anfallsfrihet på 60–90 procent hos de individer som genomgått ingreppet. Komplikationsfrekvensen är inte helt obetydlig och ligger kring 10 procent, varav infektioner och likvorcirkulationsstörning står för merparten [28].
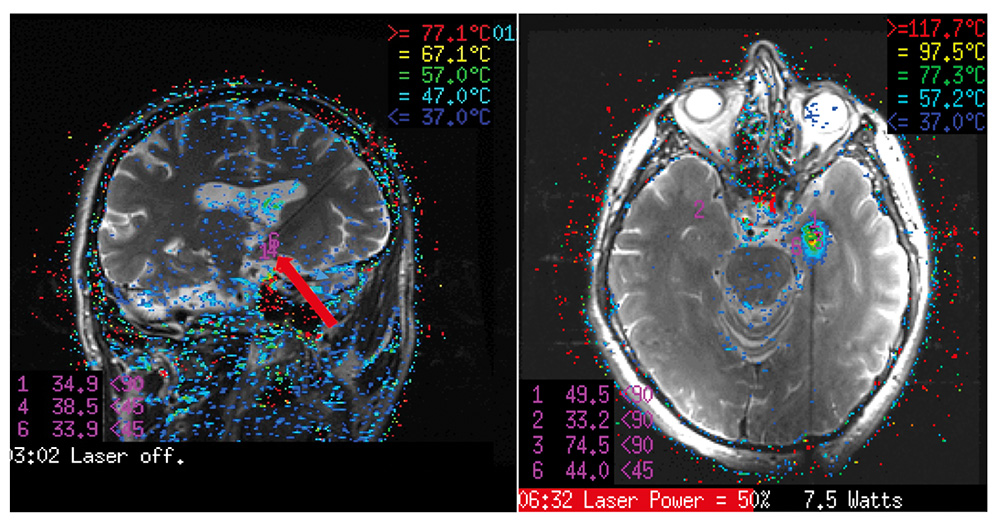
Laserablation. Användandet av laser som värmekälla för att med termokoagulation behandla epileptogena lesioner är väldokumenterat och har en låg riskprofil [29]. Laserablation är ett minimalinvasivt ingrepp som görs under narkos. Med stereotaktisk teknik implanteras en laserkateter i det epileptogena området genom ett 3,2 mm stort hål i skallbenet. Själva behandlingen utförs i magnetkamera, och uppvärmningen med efterföljande vävnadsdestruktion kan ses i realtid med hjälp av MR-termografi (Figur 5). Behandlingen kan bara uppnå ett maximalt ablationsområde på dryga 2 cm i diameter, men med retraktion av katetern och upprepade lesioneringar kan avlånga ablationer uppnås. Tekniken har visat sig vara särskilt effektiv på epilepsi utgående från hypotalamushamartom, mesial skleros i temporalloben samt från mindre fokus, såsom kavernom eller låggradiga tumörer [30].
Behandlingen har lägre riskprofil än öppen kirurgi, med betydligt kortare vårdtid och återhämtning. Den vanligaste komplikationen är ödem, som oftast kan förekommas med en kortare kortikosteroidbehandling [30].
Andra ablationstekniker. Epilepsi, framför allt mesial skleros i temporalloben, kan även behandlas med andra lesionstekniker, såsom radiofrekvensablation och strålknivsbehandling, men effekten förefaller sämre och lesioner något svårare att kontrollera jämfört med laserablation [24].
Neurostimulationstekniker
För individer med läkemedelsresistent epilepsi som inte är aktuella för öppen kirurgi eller ablativa behandlingar kan neurostimulationsbehandling vara lämplig. De tre olika typerna av neurostimulering använder alla kirurgiskt implanterade enheter, men har olika verkningsmekanismer.
Vagusnervstimulering. Vagusnervstimulering är en etablerad behandling där en elektrod placeras på vagusnerven på halsen och därefter kopplas till en impulsgenerator subkutant strax nedanför klavikeln (Figur 6). Den exakta mekanismen för den antiepileptiska effekten är inte helt klarlagd, men sannolikt handlar det om påverkan i retrograd riktning via hjärnstammen till talamus och limbiska systemet [31, 32]. Ungefär hälften får effekt i form av en signifikant reduktion i anfallsfrekvens. Vanligt förekommande biverkningar är påverkan på röst, hosta, dyspné och illamående [31].
Djup hjärnstimulering (DBS). Djup hjärnstimulering är sedan 1990-talet en etablerad behandling för vissa rörelsesjukdomar. En stereotaktisk DBS-elektrod implanteras med millimeterprecision i centrala hjärnområden och kopplas till en permanent stimulator som normalt placeras på bröstkorgen. För epilepsi är DBS inte en fullt etablerad behandling, och några potentiella målområden i hjärnan har studerats. I dagsläget förefaller stimulering av främre och centromediala kärnor i talamus ge bäst effekt på terapirefraktär epilepsi. Stimulering av främre kärnan har störst evidens och ger framför allt effekt vid fokala samt fokala till bilaterala tonisk-kloniska anfall, medan stimulering av centromediala kärnan har visat sig ha bäst effekt vid generaliserade anfall. Minskningen av anfallsfrekvens har visat sig ligga kring 60–70 procent beroende på typ av epilepsi och stimulationsområde. Den vanligaste komplikationen är infektion i implanterat material, vilket i litteraturen beskrivs förekomma hos 3 procent [33].
Responsiv neurostimulering. Responsiv neurostimulering är en responsiv enhet som placeras intrakraniellt och som via elektroder kontinuerligt registrerar anfallsaktivitet i ett eller två områden. När enheten registrerar avvikande mönster, såsom inför början på ett anfall, ger den en strömpuls på samma sätt som en pacemaker. Utrustningen behandlar alltså endast enligt ett EEG-mönster som individualiseras för varje patient. Studier på vuxna har visat på vissa goda resultat, framför allt på lång sikt, där 3 av 4 individer har fått en halvering av antalet anfall efter 9 år [34]. Studier på barn pågår. Responsiv neurostimulering är godkänd i USA sedan 2014, men finns ännu inte tillgänglig i Europa.
Sammanfattning
Epilepsikirurgin har utvecklats till att i dag omfatta ett flertal olika typer av ingrepp och tekniker och bör inte längre enbart betraktas som en sista utväg. Snarare är det den bästa behandlingen för vissa typer av läkemedelsresistenta epilepsier. En utredning för att avgöra om en individ kan vara lämplig för ett kirurgiskt ingrepp bör då genomföras tidigt. Litteraturen talar för att tidig kirurgi förbättrar utfall och livskvalitet.
Läs även:
Hur kan fler patienter få tillgång till epilepsikirurgi?
Fem frågor till Ulrika Sandvik
Potentiella bindningar eller jävsförhållanden: Margrét Jensdottir har erhållit arvode från Medtronic för föreläsningar om laserablationer.