HHT är en autosomalt dominant ärftlig sjukdom med hög penetrans.
Dominerande symtom är näsblödningar, som debuterar i unga år. Nästan alla har fått symtomet vid 40 års ålder.
Den viktigaste komplikationen är cerebrala infarkter och abscesser på grund av arteriovenösa missbildningar i lungorna.
Alla patienter med HHT ska screenas för arteriovenösa missbildningar i lungorna.
På Akademiska sjukhuset har intresserade kollegor samlats kring sjukdomen hereditär hemorragisk telangiektasi (HHT, I78.0), som ofta kallas vid sitt gamla namn morbus Osler. Sjukdomen beräknas ha en prevalens på 20/100 000 [1], och antalet fall i Sverige kan uppskattas till cirka 2 000 individer. Oslercentrum började sin verksamhet 2009 och har sedan dess knutit till sig en fast stab av medarbetare, som representerar de olika discipliner som behövs för att täcka mångfalden av kliniska problem tillståndet medför. De första internationella riktlinjerna för diagnostik och handläggning av HHT publicerades 2011 [2], och 2020 presenterades en uppdatering [1]. Vi vill här redovisa våra erfarenheter av handläggningen av detta symtommässigt brokiga tillstånd.
Fallbeskrivning
En tidigare frisk 36-årig kvinna inkom till hemortens sjukhus med ischemisk stroke. Man hittade ingen bakomliggande orsak och patienten skrevs ut. Detta upprepades följande år, men med symtom inom annat kärlområde. Då ingen bakomliggande orsak kunde identifieras remitterades hon till ett närliggande universitetssjukhus med frågeställningen: bakomliggande embolikälla, öppetstående foramen ovale? Inte heller nu kunde någon orsak till hennes insjuknande påträffas, och hon fick acetylsalicylsyra som profylax. Så småningom uppmärksammades att många i släkten lider av HHT med näsblödningar och hjärnabscesser som dominerande symtom. Man kunde genetiskt fastställa att kvinnan har en mutation i ENG-genen (HHT typ 1). Två år senare blev hon gravid, och samtidigt väcktes frågan huruvida arteriovenösa missbildningar (AVM) kunde finnas i lungorna. Hon remitterades till Oslercentrum i Uppsala för bedömning och eventuella åtgärder.
En undersökning av lungorna med datortomografi avslöjade ett flertal smärre AVM, men även en större som behövde behandlas. Hon genomgick en framgångsrik interventionsradiologisk behandling där kärlmissbildningen stängdes, och graviditeten fortlöpte väl.
Genetik och patofysiologi
HHT är en autosomalt dominant sjukdom. Hos 90 procent av patienterna påvisas mutationer i ENG-genen (HHT typ 1) eller ACVRL1-genen (HHT typ 2) [3, 4]. Hos ett fåtal individer har avvikelser i GDF2-genen (HHT typ 5) påvisats, och avvikelser i SMAD4-genen har beskrivits hos dem med samtidig juvenil kolonpolypos, vilka utgör 1–2 procent av patienterna [5, 6]. Dessa gener kan i dag analyseras i rutinsjukvård (Tabell 1).
Hos de allra flesta med HHT är sjukdomen nedärvd från en förälder med diagnosen. Nymutationer är ovanliga, men har beskrivits.
Generna som är muterade vid HHT kodar för proteiner som tillhör TGF-beta-familjen, som är viktiga för bland annat proliferation, differentiering och adhesion av celler. Detta medför att endotelintegriteten försämras, vilket med tiden orsakar de karaktäristiska kärlförändringarna. Sekundärt stiger vaskulär endotelial tillväxtfaktor (VEGF), som stimulerar bildningen av patologiska kärl.
Då HHT nedärvs autosomalt dominant kommer barn till en individ med sjukdomen ha en 50 procents risk för anlagsbärarskap. I familjer med känd genetisk avvikelse erbjuder vi anlagsbärarutredning för symtomatiska barn, och från 15 års ålder även om de är asymtomatiska. För barn med bekräftat anlagsbärarskap rekommenderar vi screening för AVM i lungorna (pulmonella arteriovenösa missbildningar, PAVM) från 15 års ålder.
En kontroversiell fråga är huruvida barn yngre än 15 år i en familj med HHT ska erbjudas presymtomatisk testning. Hittills har endast enstaka utvalda familjer, med till exempel CNS-komplikationer sekundärt till PAVM redan under barndomen, erbjudits presymtomatisk anlagsbärarutredning. Vi rekommenderar inte presymtomatisk screening hos unga annat än i undantagsfall.
Näsan och munhålan
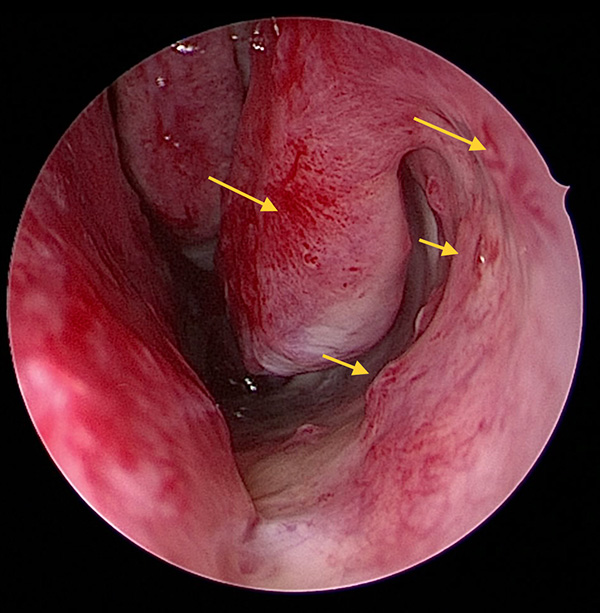
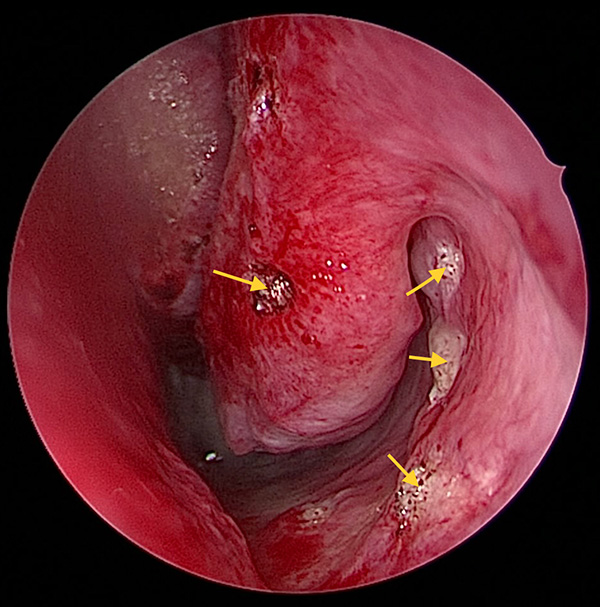
Återkommande näsblödningar är det vanligaste symtomet vid HHT och förekommer hos 90 procent av patienterna. I sällsynta fall kan näsblödningarna vara livshotande [7]. Symtomet debuterar vanligen tidigt i tonåren, men lindriga blödningar kan förekomma tidigare [8]. Konsekvensen kan bli sänkt livskvalitet och socialt handikapp [9]. Förebyggande rekommenderas befuktning av nässlemhinnan med koksaltlösning, mjukgörande nässprej (till exempel Nozoil) eller vitt vaselin, samt användning av luftfuktare. Patienten ska informeras om hur näsblödning kan hanteras i hemmet, till exempel genom korrekt huvudställning (huvudet framåtböjt), tamponad med en bomullsudd och olja i näsan och/eller tryck över den främre delen av näsan med två fingrar. Patienter kan även tamponera näsan själv, till exempel genom att installera Merocel eller tamponad med Rapid Rhino. Om egenbehandling inte hjälper bör sjukvård uppsökas. Efter undersökning med nasoskopi anläggs fast tamponad med Terracortrilsalva (hydrokortison/oxitetracyklin). Vid större blödning kan tamponad med Rapid Rhino eller bakre tamponad med Foleykateter väljas. Som sista åtgärd kan ligering av arteria sphenopalatina eller interventionsradiologisk endovaskulär embolisering av blödningskällan bli aktuell. Förstahandsval vid läkemedelsbehandling är tranexamsyra (1 g × 2–3 per dos) eller droppar timolol eller optimol 1–2 gånger dagligen [10]. Vid otillräcklig effekt av lokalbehandling eller tranexamsyra rekommenderas behandling med bevacizumab [11].
Kirurgiska behandlingsalternativ är koagulationsbehandling med laser, diatermi eller koblation. Vid svårare fall kan delhudstransplantat (septodermoplastik) utföras, och som sista alternativ tillslutning av näsan med Youngs operation [12].
Telangiektasier ses typiskt på läppar, tunga och gom hos patienter över 40 års ålder. Litteraturen kring oral problematik vid HHT är sparsam [13]. Differentialdiagnostiskt finns flera alternativ, men de dilaterade kärlen i telangiektasierna bleknar alltid vid tryck och är ofta jämt fördelade över affekterad slemhinna [14]. Det är ovanligt med orala problem på grund av HHT, men det är av flera skäl viktigt att försöka upprätthålla en god odontologisk status hos patienterna. Patienter med HHT bör erbjudas profylaktisk antibiotikabehandling i samband med tandingrepp. Tänderna bör skötas minutiöst eftersom munhålebakterier oftast är orsaken till hjärnabscesser. Antibiotikaprofylax med amoxicillin 2 gram (barn 50 mg/kg kroppsvikt) peroralt 0,5–1 timme före tandingrepp eller andra ingrepp med ökad risk för bakteriemi rekommenderas vid PAVM (Fakta 1, 2).
Hjärta och lever
Hjärtat påverkas inte direkt av sjukdomen, men när så sker är det en konsekvens av AVM i levern med en ökad volymbelastning, vilket leder till hjärtsvikt med samtidigt ökad hjärtminutvolym (HOHF, high output heart failure) [15]. Innan behandlingsmöjligheten med bevacizumab fanns, var levertransplantation den enda möjligheten när hjärtsvikten inte kunde hanteras med kardiovaskulära farmaka. Ökad hjärtminutvolym kan leda till pulmonell hypertension [16]. Detta ökar risken för förmaksflimmer och diastolisk dysfunktion. Vid misstanke om HOHF eller pulmonell hypertension görs i första hand transtorakal ekokardiografi (TTE), där även högerhjärtat bedöms och lungartärtrycket skattas.
Vaskulära missbildningar i levern kan påvisas hos upp till 80 procent av patienter med HHT [17]. De är vanligast vid HHT typ 2 och är 2–4 gånger vanligare hos kvinnor än män. Endast cirka 10 procent av patienterna utvecklar symtom [18]. Symtomen beror på vilka kärlsystem som är engagerade. Sällsynta komplikationer är biliär och hepatocellulär ischemi och nekros [19].
Vi rekommenderar inte screening för vaskulära missbildningar i levern vid HHT, men tillkomst av sjukdomstecken från hjärta eller lever bör föranleda utredning för levershuntar med dopplerultraljud, datortomografi eller magnetresonanstomografi, vilka samtliga har hög diagnostisk träffsäkerhet [20]. Patienter med HHT har ökad förekomst av nodulär regenerativ hyperplasi och fokal nodulär hyperplasi [21]. Vid symtom insätts sedvanlig behandling mot hjärtsvikt, portal hypertension och övriga hepatobiliära komplikationer. Behandling med bevacizumab har i små okontrollerade studier visat effekt hos upp emot 80 procent av patienter med symtomatiska vaskulära leverförändringar, framför allt hos dem med hjärtsvikt som inte svarar på den initiala hjärtsviktsbehandlingen [15]. Vid svåra, terapiresistenta symtom är levertransplantation indicerad [22]. Interventionell behandling av kärlmissbildningar i levern bör undvikas [21].
Mag–tarmkanalen
Att gastrointestinala (GI-) blödningar är vanliga vid HHT är välkänt, men systematiska studier av omfattningen är sparsamma [23, 24]. Blödningarna uppträder som regel först vid 50 års ålder och drabbar oftast magsäcken och tunntarmen. Vid misstanke om GI-blödning är därför gastroskopi en lämplig första åtgärd. Kolon är inte lika ofta drabbad (cirka 30 procent) men då andra sjukdomar, till exempel koloncancer, blir vanligare med åren är det rimligt att göra en koloskopi innan eventuell tunntarmsundersökning genomförs med kapselkamerateknik [25]. Om man finner kärlförändringar i mag–tarmkanalen och överväger att åtgärda dessa bör man först försäkra sig om att samtidiga näsblödningar är optimalt behandlade. Behandlingsförsök med endoskopisk teknik, till exempel argonplasmakoagulation (APC-behandling), har provats, och enstaka fallbeskrivningar visar bevarad effekt i 24 månader [26, 27]. Vid mer utbredda förändringar torde detta vara en svårframkomlig väg. När järnsubstitution inte räcker för att upprätthålla adekvata Hb-nivåer föreslås i första hand tranexamsyra [28], i andra hand bevacizumab.
Lungor och centrala nervsystemet
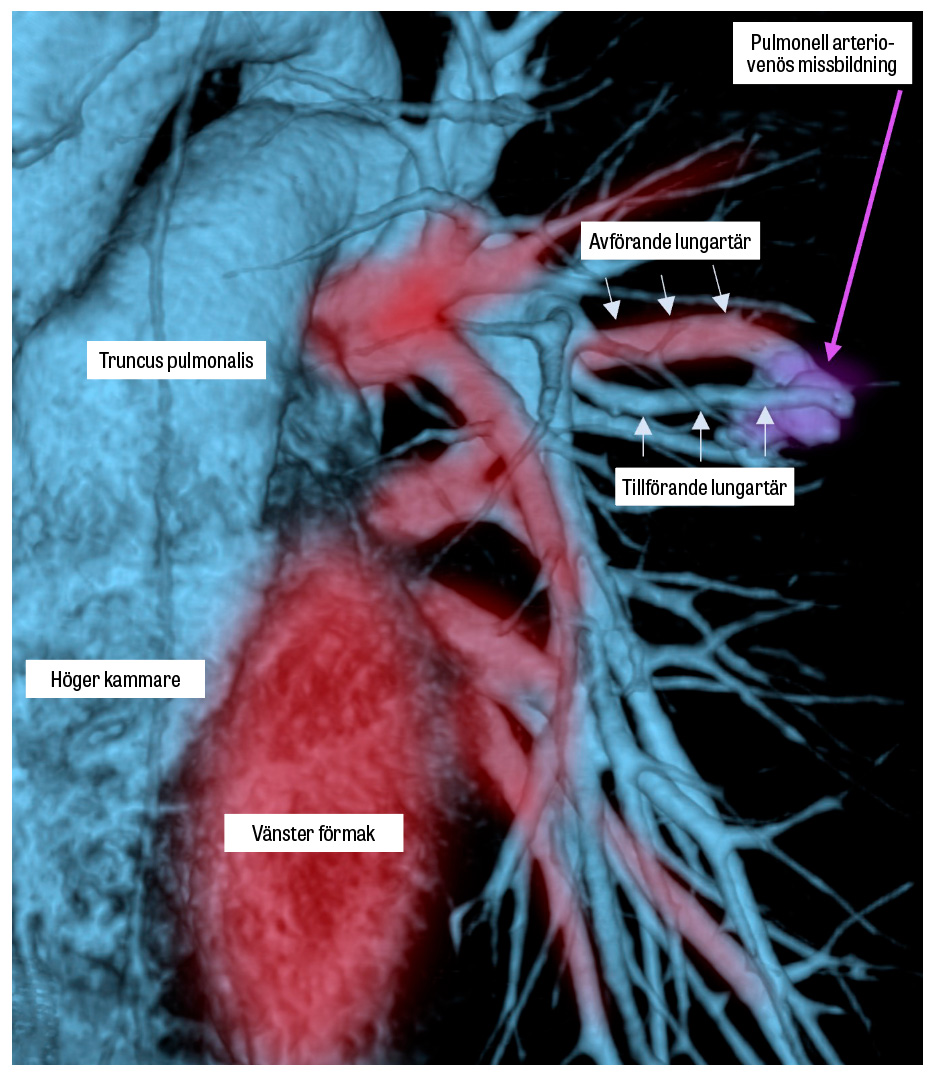
Hos 15–35 procent av patienterna med HHT förekommer kärlförändringar i lungorna, pulmonella arteriovenösa missbildningar (PAVM) [29]. Kärlmissbildningarna antas vara medfödda och växer gradvis, främst under barndomen [30, 31]. Obehandlade PAVM är i regel asymtomatiska, men kan få livshotande konsekvenser [32]. Shuntningen av blod medför att lungornas filtrerande förmåga nedsätts med risk för paradoxal embolisering, med främst cerebrala komplikationer i form av stroke och hjärnabscesser. Vid uttalad shuntning utvecklas cyanos och sekundär polycytemi. Hypoxi behöver bara behandlas om den är symtomgivande [33]. I sällsynta fall kan hemoptys eller hemotorax uppstå [34]. För HHT-patienter med obehandlad eller behandlad PAVM, eller som inte undersökts med avseende på detta, rekommenderas förebyggande åtgärder [1]. Dykning med tuber avråds på grund av ökad risk för dykarsjuka och luftembolisering. Eftersom effektiv behandling finns rekommenderas screening för PAVM. Flera olika strategier har föreslagits [1, 30, 33, 35], och i Uppsala följer vi huvudsakligen internationella riktlinjer när det gäller vuxna patienter [1]. Kontrastförstärkt transtorakal ekokardiografi (TTCE) utförs så snart diagnosen HHT har ställts, och vid misstanke om PAVM utförs datortomografi i tunna snitt (cirka 1 mm) utan kontrast för att verifiera diagnosen. En stor andel av patienterna med positiv TTCE har ingen påvisbar PAVM på DT; metodens negativa prediktiva värde är 100 procent medan positivt prediktivt värde är 8–36 procent [36]. Screeningen upprepas i regel vart femte år. Efter genomförd emboliseringsterapi bör DT torax upprepas efter 6–12 månader och därefter vart tredje år. Screening av barn görs med klinisk undersökning, pulsoximetri och lungröntgen eller med TTCE [37].
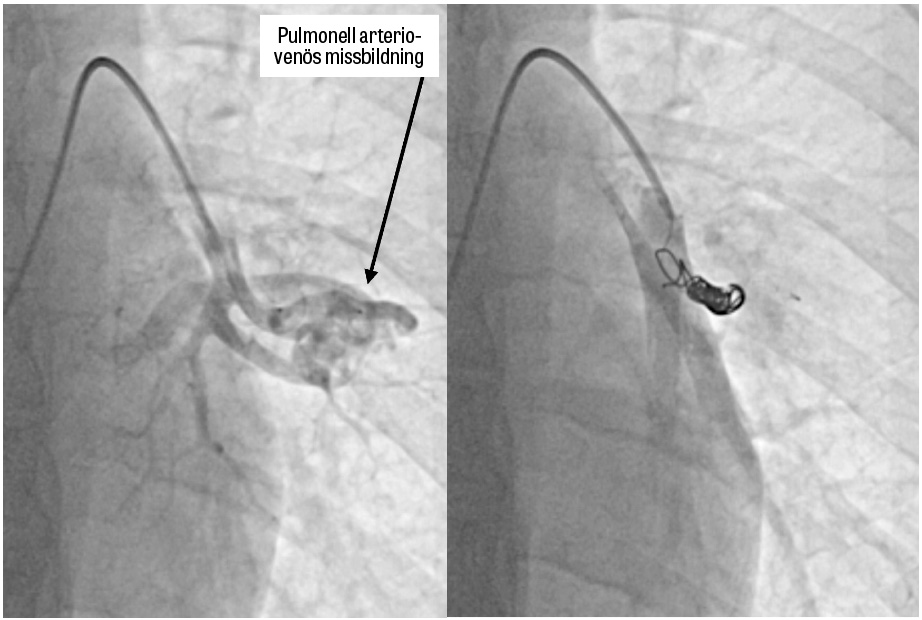
Med interventionell radiologi kan de flesta stora (>2–3 mm) PAVM behandlas. Ingreppet minskar risken för komplikationer och död väsentligt och förbättrar såväl hypoxi som symtom [38]. Lungorna har 18–20 segment, och angiografi med varierande projektioner krävs för att klarlägga den tredimensionella anatomin. Den emboliserande behandlingen sker med spiraler (coils) och/eller kärlpluggar med diametern 2–20 mm.
Kontroll av behandlingen sker med datortomografi. Kontrastförstärkt ekokardiografi är en alltför sensitiv metod för uppföljning då majoriteten av angiografiskt framgångsrikt behandlade patienter kommer att ha en viss passage av kontrastbubblor till vänster förmak. Dessa mycket små shuntar är därmed en påminnelse om att patienterna ska erbjudas antibiotikaprofylax vid risk för bakteriemi, till exempel vid tandingrepp.
Utöver embolisering via PAVM till hjärnan kan HHT även orsaka kärlmissbildningar i hjärnan, något som ses hos cirka 10 procent av patienterna. Det finns många olika typer av kärlförändringar, av vilka flera har ett helt benignt förlopp. Då den sammanlagda blödningsrisken inte är större än cirka 1 procent /år [39], och preventiva ingrepp kan vara skadliga, är frågan om presymtomatisk screening kontroversiell [40]. Akuta neurologiska symtom vid HHT ska utredas hos alla patienter, och om kärlmissbildning relaterad till HHT diagnostiseras ska neurokirurgisk expertis bedöma patienten.
Obstetriska synpunkter
Under graviditet ökar plasmavolymen med 50 procent och hjärtminutvolymen med upp till 45 procent. De hormonella förändringarna medför också en kärlvidgning. Sammantaget leder detta till ökad risk för blödningar i framför allt lungorna, med störst risk under den tredje trimestern. Komplikationer från cerebrala eller spinala AVM är mycket ovanliga [41]. Den vanligaste komplikationen är en ökad förekomst av näsblödningar och anemi. Vid indikation för antikoagulantia, både som profylax och i behandlingsdos, ska detta ges. Detta gäller både lågmolekylärt heparin och trombocytaggregationshämmare. Individuell bedömning avseende blödningsrisken ska alltid göras.
Majoriteten av alla graviditeter vid HHT förlöper okomplicerat. Dock ska de betraktas som högriskpatienter, eftersom komplikationer till rupturer i AVM kan vara livshotande. Planering inför en eventuell graviditet och förlossningssätt ska ske i ett multidisciplinärt team. Som regel förordas vaginal förlossning.
Farmakoterapi
Det har visat sig vara svårt att hitta fungerande läkemedel med generell angreppspunkt vid HHT. Under många år har östrogenterapi provats utan övertygande effekt och har därför ingen plats i terapin. Tranexamsyra har däremot försvarat sin plats och rekommenderas vid behov för att minska blödningsrisken [1]. Vetskapen om att VEGF är förhöjt har medfört att försök med bevacizumab gjorts. Denna antikropp mot VEGF har i små välgjorda studier visat sig minska behovet av blodtransfusioner, minska näsblödningar och förbättra hjärtindex hos patienter med lever-AVM [15, 42, 43]. En utvidgad multicenterstudie med 232 patienter visade att medelvärdet på Hb steg från 86 till 118 g/l under behandlingen. Näsblödningarna minskade och behovet av intravenöst järn minskade med 70 procent [44]. De vanligaste biverkningarna var hypertoni (18 procent), trötthet (10 procent), och den allvarligaste var venös tromboembolism (2 procent). Bevacizumab är dock inte registrerat på indikationen HHT.
Järnbristanemi är mycket vanlig, och man räknar med att cirka 50 procent drabbas [1]. Enligt vår erfarenhet är det svårt att med tablettbehandling uppnå en positiv järnbalans vid blödningsanemi, och därför rekommenderar vi i regel intravenös järnbehandling [1]. Målet för behandlingen är normalt Hb och erytrocytmedelvolym med P-ferritin >100 µg/l och transferrinmättnad >20 procent.
Vid HHT är risken för venös tromboembolism (VTE) förhöjd, och risken tycks paradoxalt öka med förvärrad järnbrist [45]. Trombosprofylax i högrisksituationer, som exempelvis kirurgi, ska ges enligt gängse rutiner. Trombosförebyggande behandling vid förmaksflimmer och behandling av akut VTE kan ges, men risken för blödningar ökar. Direktverkande orala antikoagulantia är belastade med stor blödningsrisk, varför ofraktionerat heparin och warfarin rekommenderas i första hand [46].
Trombocythämmare kan ges om indikation föreligger, men man avråder från dubbel trombocythämning och kombinationen trombocythämmare och antikoagulation [1] (Fakta 3).
Oslercentrum i Uppsala
Intresset för HHT har ökat internationellt, och centrumbildningar med varierande grad av excellens finns över stora delar av världen. Centrumbildningen i Uppsala startade vid öronkliniken 2009, och i samarbete med intresserade kollegor från andra kliniker växte verksamheten. I dag har vi regelbundna multidisciplinära konferenser en gång i månaden, då vi diskuterar aktuella remisser och synpunkter lämnas av medlemmarna varvid gemensamma svar kan ges. Oslercentrum är en rådgivande instans och har ingen samlad mottagnings- eller uppföljningsverksamhet, men ingående specialiteter tar vid behov emot patienter från andra regioner för bedömning eller behandling. Sedan starten har 170–180 patienter handlagts.
Vem var sir William Osler?
William Osler föddes i Kanada 1848 som åttonde barn i en prästfamilj [47]. Efter en lyckad examen följde en utbildningsresa till Europa, där han bland annat studerade fysiologi i London och senare träffade Rudolf Virchow i Berlin. En snabb karriär följde, först i hemlandet och sedan i USA, där han blev den första chefen i medicin vid Johns Hopkins sjukhus. Hans sista tjänst var som regiusprofessor i Oxford. Oslers medicinska intresse var mycket brett och han ivrade tidigt för patologins betydelse. Han är välkänd för sina många slagkraftiga aforismer; en ständigt aktuell lyder: »One of the first duties of the physician is to educate the masses not to take medicine.«
Läs även:
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Docent Charlotte Ebeling-Barbier, överläkare, Bild- och funktionsmedicinskt centrum vid Uppsala universitet, har bidragit med illustrationer.
FAKTA 1. Curaçaokriterierna [48]
- Hereditet. Sjukdomen finns hos minst en förstagradssläkting.
- Hemorragier. Spontana recidiverande näsblödningar.
- Telangiektasier. Multipla, vid typiska lokaler (läppar, munhåla, fingrar, näsa).
- Viscerala lesioner. Kärlförändringar i inre organ (lungor, lever, mag–tarmkanal).
- Föreligger 3 kriterier eller fler är diagnosen säkerställd. 2 kriterier innebär möjlig eller misstänkt HHT.
FAKTA 2. Vanligaste kliniska tecken och symtom
- Spontana näsblödningar, debuterar i genomsnitt vid 12 års ålder.
- Nästan alla har drabbats av näsblödningar vid 40 års ålder.
- Blödningar från mag–tarmkanalen uppträder ofta efter 50 års ålder.
- Järnbristanemi är frekvent förekommande.
FAKTA 3. Insatser och uppföljning
- Näsblödningar ska förebyggas med lokala konservativa medel.
- Alla patienter med HHT ska screenas för PAVM vart 5:e år.
- Signifikanta PAVM ska stängas för att förebygga cerebrala komplikationer.
- Efter behandling av PAVM ska lungorna kontrolleras vart 3:e år.
- Noggrann munhygien är viktig för att minska risken för bakteriemi och cerebrala abscesser.
- Hos patienter med PAVM rekommenderas antibiotikaprofylax vid ingrepp med ökad risk för bakteriemi, såsom tandingrepp.
- Patientens blodstatus ska övervakas och intravenös järnbehandling ges vid behov.