Hos patienter med akut och kronisk hjärtsvikt utgör järnbrist med eller utan samtidig anemi en vanlig komorbiditet kopplad till sämre funktionsklass och prognos.
Vid hjärtsvikt definieras järnbrist som ferritin <100µg/l eller som ferritin 100–299 µg/l om transferrinmättnaden samtidigt är <20 procent.
Svenska och internationella riktlinjer rekommenderar utredning (blodstatus, ferritin och transferrinmättnad) och behandling av järnbrist hos patienter med symtomatisk hjärtsvikt och reducerad ejektionsfraktion (<50 procent).
Genomförda studier dokumenterar positiva effekter av intravenös behandling med järnkarboximaltos (Ferinject) på symtom, livskvalitet, funktionella variabler och risk för sjukhusvård för hjärtsvikt. Pågående studier undersöker effekterna avseende mortalitet och effekterna vid hjärtsvikt med bevarad ejektionsfraktion (>50 procent) samt effekterna av järnderisomaltos (Monofer).
Ansvarig läkare ska ta ställning till utredning av bakomliggande orsak till järnbristen mot bakgrund av patientens allmäntillstånd och hjärtstatus.
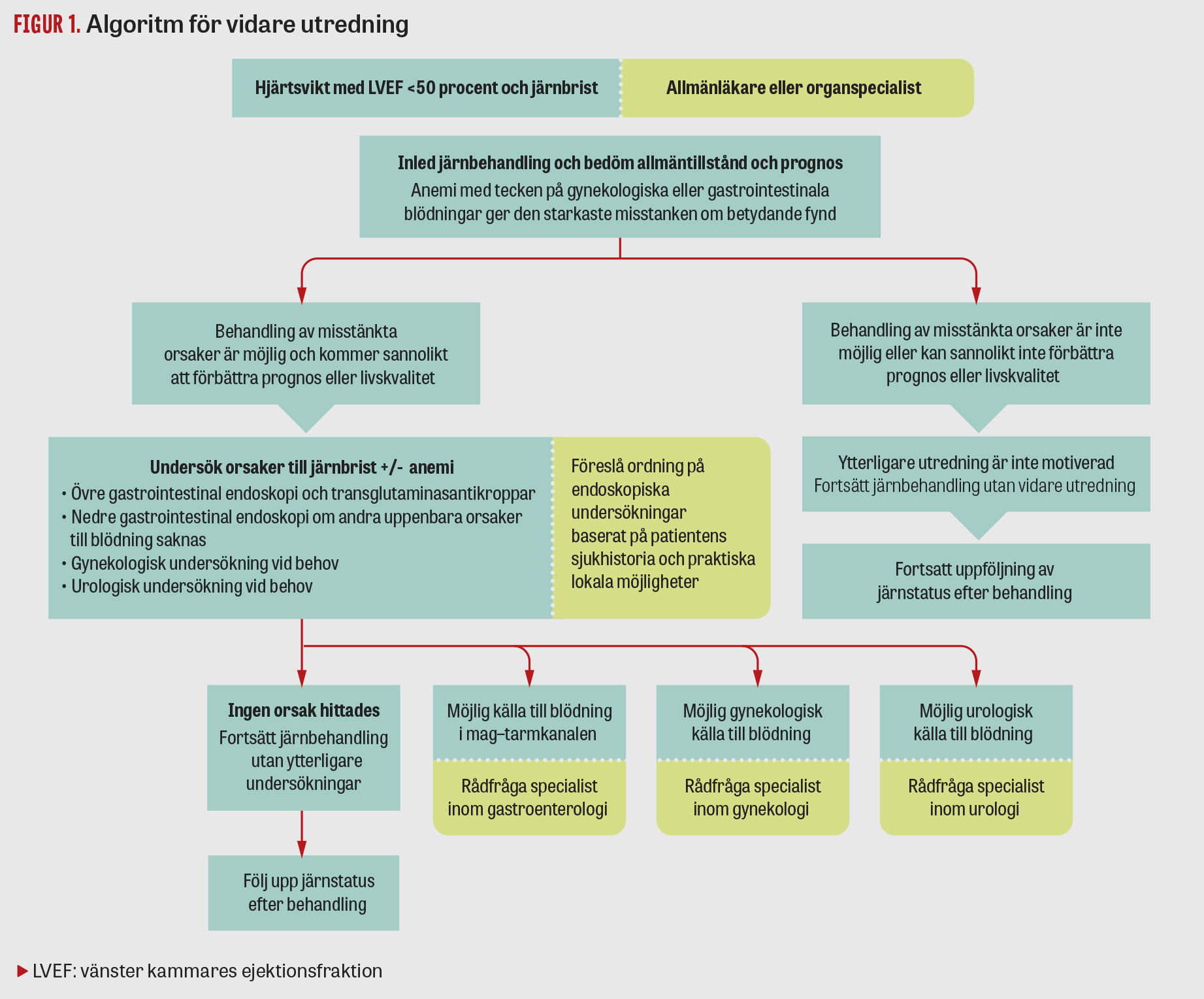
Trots att flera studier dokumenterat god effekt av behandling med intravenöst järn av järnbrist vid akut och kronisk hjärtsvikt med reducerad ejektionsfraktion (EF) (motsvarande »systolisk« hjärtsvikt) går implementeringen av denna kunskap långsamt [1]. Vi har därför utvecklat en enkel behandlingsalgoritm baserad på publicerade data för att förenkla handläggningen i klinisk praktik (Figur 1).
Prevalens, orsaker och mekanismer
Järn, bundet till hem i hemoglobin och myoglobin, är essentiellt för syrgastransport i erytrocyterna samt upplagring av syre och energiproduktion i vävnader, inte minst i muskler [2].
Järnbrist är en viktig orsak till anemi och leder till nedsatt funktion i både myokard och skelettmuskulatur [3].
Vid hjärtsvikt är järnbrist, oberoende av samtidig förekomst av anemi, relaterad till nedsatt livskvalitet, försämrad fysisk prestationsförmåga samt ökad kardiovaskulär och total mortalitet [4]. Vid kronisk hjärtsvikt kan upp till hälften av patienterna ha järnbrist, med eller utan samtidig anemi [5,6]. Förekomsten av järnbrist ökar med stigande NYHA-klass, och den orsakas såväl av absolut järnbrist med tömda depåer som av inflammationsrelaterad järnbrist med låg tillgänglighet till det järn som finns i depåerna (funktionell järnbrist). Absolut järnbrist kan orsakas av ökade förluster genom blödning, lågt intag, nedsatt upptag från tunntarmen eller effekter av trombocythämning och antikoagulantia. Vid systemisk inflammation, vilket är vanligt hos patienter med hjärtsvikt, ökar hepcidinproduktionen i levern, vilket blockerar upptaget av järn från tarmen och frisättningen från depåerna.
Njursvikt är en annan viktig orsak till anemi hos hjärtsviktspatienter, orsakad av en kombination av järnbrist, inflammation och erytropoetinbrist. Den föranleder dock inte samma överväganden om vidare utredning av bakomliggande orsaker och diskuteras därför inte vidare här.
Diagnostik
Serumferritin <30 µg/l tillsammans med transferrinmättnad <16 procent indikerar alltid absolut järnbrist. Vid samtidig inflammation återspeglar ferritinnivåerna i plasma icke-mobiliserbara järndepåer, och ferritin är dessutom en akutfasreaktant, vilket försvårar bedömningen. I kliniska studier av hjärtsviktspatienter har järnbrist ansetts föreligga vid ferritin <100 µg/l, eller vid ferritin <300 µg/l om transferrinmättnaden samtidigt är <20 procent. I svårtolkade situationer kan analys av löslig transferrinreceptor i serum underlätta, eftersom förhöjda nivåer alltid återspeglar absolut järnbrist, oavsett samtidig inflammation. Europeiska riktlinjer för hjärtsvikt rekommenderar värdering av järnstatus hos alla patienter med hjärtsvikt och behandling med järnkarboximaltos vid järnbrist hos patienter med EF <50 procent. [4]. Men det finns fortfarande osäkerhet i bedömningen av underliggande orsaker utöver hjärtsvikten och bristande rekommendationer avseende den praktiskt kliniska handläggningen. Gastrointestinal cancer tycks vara vanlig vid hjärtsvikt med järnbrist [7], utan säker skillnad mellan patienter med eller utan anemi, definierat som Hb <120 g/l.
Behandling
Peroral järnbehandling har visat sig sakna effekt avseende studerade variabler vid kronisk hjärtsvikt. Orsaken är en kombination av gastrointestinal intolerans, reducerat upptag på grund av ödem i tunntarmen och systemisk inflammation med hepcidinblockering av järnupptag från tarmen. Flera studier har däremot visat positiva effekter av intravenöst järn på symtom, livskvalitet och funktionsparametrar hos patienter med kronisk hjärtsvikt och reducerad ejektionsfraktion [8]. FAIR-HF inkluderade 459 patienter med hjärtsvikt i NYHA-klass II–III med EF <40–45 procent och järnbrist, med eller utan samtidig anemi [9]. Patienterna randomiserades till placebo alternativt 200 mg järnkarboximaltos intravenöst en gång per vecka tills järnförråden var normaliserade och därefter 200 mg intravenöst var fjärde vecka. Vid uppföljningen efter 24 veckor fann man att intravenöst järn förbättrade livskvaliteten enligt den validerade Kansas City cardiomyopathy questionnaire, NYHA-klassificeringen och 6 minuters gångtest. Resultaten var varken beroende av EF eller Hb-nivåer vid behandlingsstarten.
I CONFIRM-HF-studien randomiserades 304 patienter i NYHA II–III, EF <45 procent och järnbrist till behandling med 500–1 000 mg järnkarboximaltos eller placebo under den första behandlingsveckan [8]. Om järnstatus inte normaliserades fick patienterna i den aktiva armen ytterligare intravenöst järn. De totala järndoserna uppgick till 500–3 500 mg. Behandling med intravenöst järn förbättrade 6 minuters gångtest signifikant efter 24 veckor. Den statistiska skillnaden mot placebogruppen kvarstod efter 52 veckor. Dessutom förbättrade järnbehandlingen fatigue, självupplevd hälsa och NYHA-klass samt reducerade antalet inläggningar på sjukhus på grund av hjärtsvikt. I AFFIRM-AHF randomiserades 1 132 patienter hospitaliserade med akut hjärtsvikt, EF <50 procent och järnbrist vid hemgång till järnkarboximaltos eller placebo [10]. Behandlingen resulterade i bättre funktion och livskvalitet samt lägre risk för återinläggning på sjukhus på grund av försämrad hjärtsvikt, fortfarande utan skillnader mellan patienter med initialt Hb över eller under 120 g/l.
Behandling med järnkarboximaltos bör därför övervägas för att förbättra symtom, funktionsnivå och livskvalitet samt minska risken för sjukhusvård för hjärtsvikt hos hjärtsviktspatienter med järnbrist och EF <45 procent, respektive patienter med EF <50 procent som nyligen sjukhusvårdats för hjärtsvikt [4]. Flera pågående studier förväntas kunna komplettera bilden avseende mortalitet, eventuell effekt vid bevarad EF (>50 procent) och hälsoekonomi.
Behandlingsrisker
Totalt sett är frekvensen av infusionsreaktioner med moderna intravenösa järnpreparat mycket låg, till och med lägre än för andra intravenösa läkemedelsbehandlingar. Frekvensen av överkänslighetsreaktioner är <1 procent, vilket nyligen konfirmerats i en stor metaanalys [11]. Anafylaktiska reaktioner är mycket sällsynta. Flertalet infusionsreaktioner betingas av interaktion mellan fritt järn och kärlendotel, frisättning av kvävemonoxid och icke-allergisk komplementaktivering och upphör när infusionen avbryts [12]. Infusionen kan sedan återstartas efter cirka 15 minuter med en långsammare infusionstakt. Vid misstanke om anafylaktisk reaktion ska behandlingen givetvis inte återupptas.
Hypofosfatemi, som oftast är asymtomatisk, är en biverkan av intravenös järnbehandling som uppmärksammats de senaste åren. Risken är väsentligt större för järnkarboximaltos än för järnderisomaltos. Mekanismen är kartlagd i detalj [13], och hypofosfatemin betingas av en stegring av intakt fibroblasttillväxtfaktor 23, sannolikt medierad av kolhydratkomponenten i järnkarboximaltos. Stegringen åtföljs av förändringar i 1,25-dihydroxivitamin D, kalcium och parathormon, som kan vara långvariga, även efter normalisering av fibroblasttillväxtfaktor 23. Osteomalaci kan i sällsynta fall utvecklas som följd av långvarig hypofosfatemi efter upprepade infusioner, men i övrigt är de kliniska konsekvenserna ännu ej klarlagda.
Algoritm för vidare utredning av patienter
Baserat på tillgängliga data och rekommendationer från ESC föreslår vi att blodstatus, ferritin och transferrinmättnad analyseras regelbundet på alla patienter med hjärtsvikt och EF <50 procent [4]. Behandling med intravenöst järn ska inledas så snart järnbrist påvisats och fortsätta tills järnbristen hävts. Dessutom bör bakomliggande orsaker till järnbristen värderas i enlighet med Figur 1. Beslut att utreda järnbristen vidare ska fattas av ansvarig läkare i samråd med patienten och närstående och baseras på sannolikheten att andra faktorer än hjärtsvikten i sig ligger bakom järnbristen, patientens riskfaktorer och övriga symtom och patientens situation, allmäntillstånd och behandlingsmöjligheter. Utredning av eventuella kroniska blodförluster bör mot bakgrund av klinisk misstanke i första hand inriktas på mag–tarmkanalen [7], men också urinvägar och gynekologiska orsaker. Vidare bör transglutaminasantikroppar analyseras med tanke på eventuell bakomliggande celiaki.
Observera också att järnbehandling kan höja järndepåer och hemoglobin och maskera blodförluster och därmed dessa bakomliggande orsaker, även om Hb initialt var >120 g/l.
Behandlingseffekten ska följas upp, och sedan behandlingsmålet uppnåtts bör patientens blod- och järnstatus följas cirka varannan månad samt ny behandling med intravenöst järn ges om järnbrist utvecklas på nytt.
Om vidare utredning ej bedöms möjlig eller meningsfull bör patienten ändå få behandling för sin järnbrist, mot bakgrund av påvisade positiva effekter på livskvalitet och fysisk prestationsförmåga, minskat behov av sjukhusinläggningar samt möjligen även lägre mortalitet [10].
Behandling av järnbrist hos hjärtsviktspatienter med järnkarboximaltos är sannolikt dessutom kostnadseffektiv [14].
Slutsatser
Järnbrist är en vanlig komorbiditet hos patienter med hjärtsvikt. Behandling med intravenöst järn har visat sig kunna förbättra patienternas symtom, funktionsstatus och livskvalitet samt reducera behovet av sjukhusinläggningar för hjärtsvikt. De studier som hittills publicerats är baserade på järnkarboximaltos, men motsvarande studier med järnderisomaltos pågår. Vid konstaterad järnbrist och i samband med järnbehandling är det viktigt att andra orsaker till järnbrist än hjärtsvikten i sig beaktas, särskilt kroniska blodförluster via tarmen, inkluderande maligniteter. Den algoritm vi presenterar ger stöd för handläggning rörande behandling och ställningstagande till vidare utredning av hjärtsviktspatienter med järnbrist och kan sannolikt implementeras utan behov av ytterligare resurstillskott.
Potentiella bindningar eller jävsförhållanden: Samtliga författare har uppburit arvode för föreläsningar och webbseminarier på uppdrag av Vifor Pharma och Pharmacosmos. Företagen har ej utbetalt ersättning för eller påverkat utformningen av artikeln.