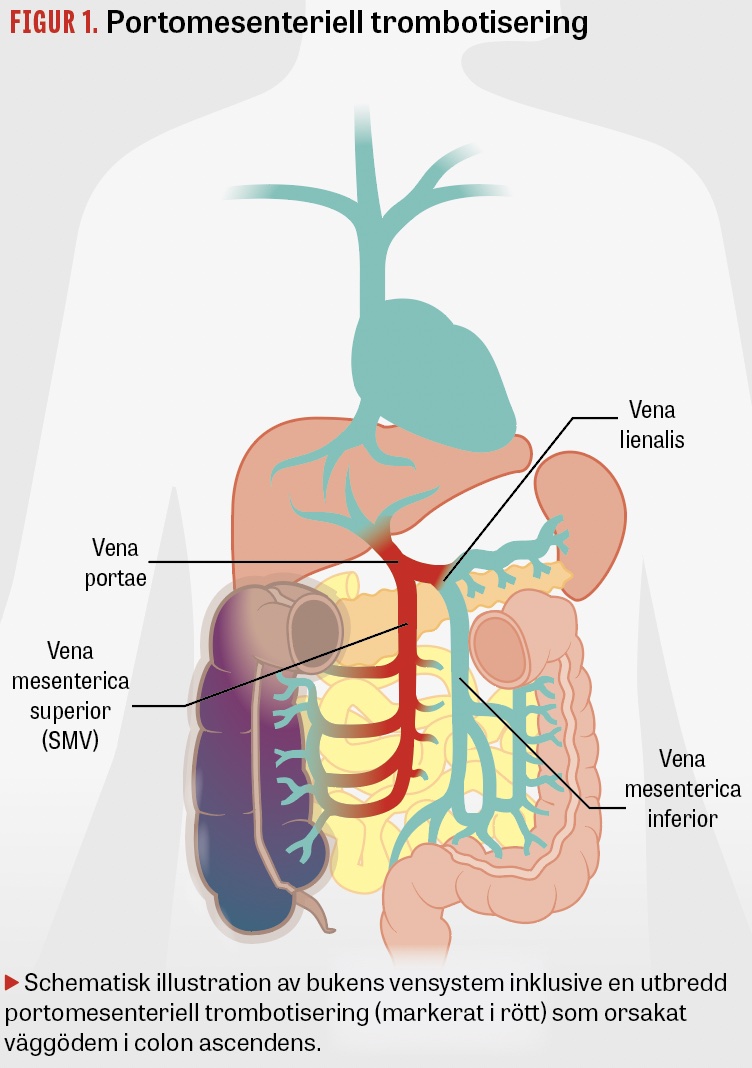
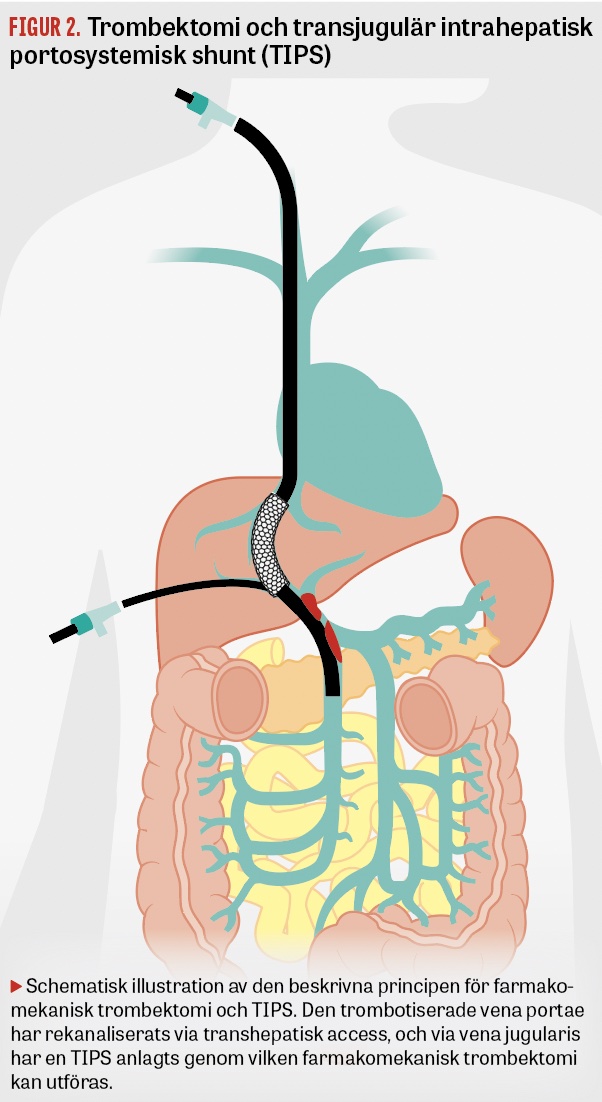
Akut portomesenteriell trombotisering är ett ovanligt tillstånd, men en viktig differentialdiagnos vid oklar buksmärta.
Antikoagulation ska påbörjas omedelbart efter diagnos, och handläggningen bör vara multidisciplinär.
Ofullständig mesenteriell rekanalisering kan leda till tarminfarkt och utveckling av portal hypertension.
Perkutan intervention, inklusive transjugulär intrahepatisk portosystemisk shunt (TIPS), bör tidigt övervägas hos patienter som inte svarar tillfredsställande på, eller försämras under, antikoagulation.
Kontakt med enhet som har multidisciplinär kompetens och erfarenhet att handlägga patienter med portomesenteriell trombotisering bör tas tidigt i förloppet.
Den kliniska bilden vid akut trombos i bukens vensystem spänner från kliniskt okomplicerad partiell ocklusion till fulminant trombotisering med hotande tarmgangrän. När trombosen begränsas till portavenen är chansen för spontan rekanalisering hög, och vid tidigt insatt antikoagulation minskar risken för komplikationer ytterligare. Vid extensiv utbredning, särskilt när trombotiseringen även engagerar vena mesenterica superior (SMV) och/eller vena lienalis, är emellertid risken för allvarliga konsekvenser betydligt högre. Isolerade tromboser i SMV eller vena lienalis förekommer också, men är ovanligare (Figur 1) [1]. I denna artikel har vi valt att inkludera all trombotisering som engagerar de portomesenteriella venerna i begreppet portomesenteriell venös trombos (PMVT).
PMVT är ett ovanligt tillstånd. I en svensk retrospektiv sammanställning (2000–2015) sågs en incidens av trombos i vena mesenterica på 1,3 fall per 100 000 personår, något högre för män än kvinnor [2]. 30-dagarsmortaliteten i samma studie var förhållandevis låg (3,9 procent), vilket bedömdes vara en möjlig följd av aktiv diagnostik och behandling, inklusive tillgång till endovaskulär intervention.
Etiologi och patofysiologi
I en majoritet av fallen med PMVT identifieras åtminstone en bakomliggande riskfaktor. Vanligast är medfödda eller förvärvade koagulopatier (till exempel faktor V Leiden-mutation och myeloproliferativ neoplasi). Andra kända riskfaktorer är lokala inflammatoriska tillstånd, lever- och gallgångscancer och nylig intraabdominell kirurgi [3]. Här kan nämnas en ökad risk för trombotisering efter bariatrisk kirurgi, framför allt under första postoperativa månaden [4]. Bland de inflammatoriska tillstånden dominerar akut pankreatit, som intressant nog är kopplad till en gynnsam prognos [5], men PMVT ses även vid exempelvis kolecystit, appendicit och inflammatorisk tarmsjukdom.
PMVT är överrepresenterad vid samtidig levercirros. Detta beror sannolikt på ett avvikande blodflöde i splanknikusbädden, störd hemostas samt den kroniska systeminflammation som anses central för patofysiologin vid avancerad leversjukdom. Trombosrisken hos denna patientgrupp är störst i samband med dekompenserad leversjukdom eller vid förekomst av ytterligare en lokal riskfaktor. För en mer detaljerad beskrivning av trombos vid samtidig levercirros hänvisas till Rajanis och Marschalls översikt i Läkartidningen [6].
Risken för tarminfarkt är som störst när trombosen sträcker sig ut i de mest perifera mesenterialvenerna. I denna grupp är patienter med förvärvad eller nedärvd koagulopati överrepresenterade [7]. Vid ocklusion av SMV påverkas de tarmavsnitt som dräneras via denna kärlarkad, och då vanligen ileum och/eller jejunum, medan kolon eller duodenum mer sällan drabbas. Att inte samtliga fall med utbredd trombotisering leder till ischemi beror sannolikt på ett ofta gradvis insjuknande, med parallell utveckling av fysiologiska shuntar (kollateraler).
Klinik
Akut PMVT bör alltid övervägas vid akut buk hos en patient med kända riskfaktorer för tromboembolism eller som nyligen genomgått intraabdominell kirurgi. Diagnosen är svår att ställa på kliniska grunder och kommer därför inte sällan som en överraskning för klinikern [8]. Det vanligaste symtomet är buksmärta, men även kräkningar, illamående, diarré och blödningar från mag–tarmkanalen förekommer. Insjuknandet är ofta smygande, under timmar eller dagar, och sällan lika hyperakut som vid arteriell tarminfarkt. Ibland föregås diagnosen av perioder med obehag lika dem som ses vid funktionell mag–tarmsjukdom. Peritonit och släppömhet saknas som regel, men bör, liksom blodtillblandade diarréer och ascites, inge misstanke om tarminfarkt. Förhöjt serumlaktat ses vid tarminfarkt, men även vid annan kritisk sjukdom, och saknar därför värde för den specifika diagnostiken. CRP-stegring, leukocytos, trombocytos och förhöjd D-dimer stödjer diagnosen, men utgör inte PMVT-specifika fynd och saknar därtill säkerställd prognostisk betydelse.
PMVT vid samtidig cirros är ofta asymtomatisk eller mer diffus, och den upptäcks inte sällan en passant vid radiologi. Orsaken till detta är sannolikt att det redan här finns avlastande kollateraler på grund av portal hypertension. Ibland upptäcks trombosen i samband med akut försämring (varixblödning, ascites, encefalopati) hos en patient med tidigare kompenserad cirrossjukdom.
Diagnos
Diagnostiken ska alltid inkludera kontrastförstärkt datortomografi (DT-angiografi), eller möjligen magnetisk resonanstomografi (MR-angiografi). Dessa metoder har högre sensitivitet för tromboser i SMV än ultraljud, och med kontrastförstärkning i venös fas kan trombosutbredning och eventuell sekundär tarmpåverkan bedömas. Ödem i mesenteriet och tarmväggen indikerar venös stas, medan samtidig förekomst av ascites, tunntarmsdilatation eller intramural gas signalerar en mer fulminant situation med hotande tarmgangrän [9]. Lågattenuerande trombmassa med omgivande retning (flebit) stödjer misstanken om akut trombotisering. Förekomst av upparbetade venösa kollateraler och mjältförstoring (utan samtidig cirros) talar för en kronisk situation. Kavernom – slingriga kollateraler i leverhilus – är vanligen det tidigaste radiologiska tecknet på kronicitet och kan ses så tidigt som inom en vecka efter symtomdebut. Sekundär portal hypertension uppstår oftare vid utbredd/total PMVT eller där initial behandling inte åstadkommit synlig rekanalisering [10].
Initialt omhändertagande
Målet med behandlingen av akut PMVT är att 1) motverka trombosprogress, 2) förhindra uppkomst av irreversibel tarmischemi och 3) minska risken för utveckling och komplikationer av portal hypertension. Ansvarig klinik och vårdnivå anpassas utifrån klinisk bild, lokal erfarenhet och kompetens. Patient med begränsad trombosutbredning och lindriga symtom kan observeras på vanlig vårdavdelning enligt nedan, medan utbredd trombotisering och/eller uttalade symtom bör föranleda vård på högre nivå (intermediärvård eller intensivvård) för adekvat övervakning.
Antikoagulation. Antikoagulation är grundbulten i behandlingen och är tillräcklig som monoterapi i de flesta fall av portomesenteriell trombotisering [2]. Behandlingen ska initieras omedelbart vid konstaterad akut PMVT. I den akuta situationen och/eller vid konstaterad eller misstänkt intestinal ischemi brukar ofraktionerat heparin rekommenderas med motiveringen att den korta halveringstiden är en fördel om intervention/kirurgi blir aktuell. Tveksamheter kring val av antikoagulation får dock inte fördröja behandlingsstarten, och vid svårigheter att administrera eller monitorera intravenöst heparin samt vid stillsam klinik rekommenderas därför lågmolekylärt heparin, i fulldos och tvådosregim. Förekomst av kollateraler/varicer (utan pågående blödning) utgör inget hinder för antikoagulation, vare sig i det akuta eller kroniska skedet. Vid etablerad peritonit eller hållpunkter för akut pågående blödning tas beslut om behandling först efter kirurgisk konsultation.
Monitorering. Tarmvila och parenteral nutrition bör råda initialt. Övervakningen ska vara aktiv och inkludera smärtanamnes, bukstatus, puls/blodtryck och temperatur. Daglig provtagning bör innefatta blodstatus, elektrolyter och CRP. Vätske- och elektrolytbalans följs och substitueras enligt gängse rutiner. Vid komplicerad koagulationsrubbning handläggs patienten i tätt samråd med specialist inom klinisk koagulationsmedicin.
Efter 3–5 dagars antikoagulation, eller tidigare vid förvärrad klinisk bild, görs ny värdering angående fortsatt terapi, inklusive ny DT-angiografi. Om klinik talar för förbättrat venöst avflöde fortsätter farmakologisk behandling och monitorering tills situationen stabiliserats mer varaktigt. Om symtombilden däremot är oförändrat besvärlig, och DT-angiografi inte visar påtaglig regress av trombosutbredning eller tarmsvullnad, bör kontakt tas med sjukhus med interventionsradiologisk kompetens som inkluderar transjugulär intrahepatisk portosystemisk shunt (TIPS). Tillkomst av peritonit, släppömhet eller feber bör föranleda akut kirurgkonsultation för att ta ställning till laparotomi och vid behov tarmresektion.
Interventionell radiologi. Perkutan intervention vid akut PMVT bör övervägas vid flera kliniska scenarier (Fakta 1). Flera olika kateterburna tekniker finns beskrivna [11]. Vid Akademiska sjukhuset används vanligen transjugulär access av portasystemet för lokal trombektomi/trombolys, vilken kombineras med insättandet av en shunt som förbinder leverven och portacirkulation, TIPS (Figur 2). Shunten minskar risken för retrombotisering, sannolikt genom att säkerställa det venösa avflödet via levern och därmed minska stasrelaterad hyperkoagulation. Den utgör dessutom en riskfri access vid behov av kontrollröntgen (flebografi) eller reintervention [12].
Randomiserade studier som jämför antikoagulation och endovaskulär behandling vid akut PMVT saknas, och det vetenskapliga stödet baseras på fallserier och retrospektiva studier. I ett europeiskt material av icke-cirrotisk, icke-malign akut portavenstrombos med hotande tarmgangrän, varav majoriteten involverade SMV, visade sig transjugulär kateterburen intervention med TIPS ge komplett eller partiell regress av trombos i 94 procent av fallen [13]. Efter 24 månader var vena portae öppetstående hos 88 procent, och ingen av dessa hade utvecklat portal hypertension. 2 av 17 patienter tvingades genomgå segmentell tarmresektion, varav en efter retrombotisering som skedde efter utsättning av antikoagulation på grund av heparininducerad trombocytopeni.
Nya metoder för mekanisk trombektomi (t ex Angiojet) har visat sig ytterligare förbättra utfallet med bibehållen säkerhet [14]. Vid kateterburen trombolys ses en signifikant ökning av blödningskomplikationer jämfört med TIPS med/utan trombektomi [15]. Även vid kronisk trombotisering med kavernomutveckling och portalhypertension är perkutan intervention vanligen genomförbar och framgångsrik, om än mer tekniskt utmanande. Komplikationer och långtidsdata är jämförbara med ingrepp som görs i det mer akuta skedet [15].
Kirurgi. Vid irreversibel transmural tarminfarkt ska tarmresektion utföras. Valet av tidpunkt och resektionsomfång är svårt, och för en fördjupad genomgång hänvisas till ESVS (European Society for Vascular Surgery) riktlinjer [16]. Det finns visst stöd för att kombinera kirurgi med perkutan intervention vid infarkthotande tillstånd för att på så sätt underlätta bedömningen av nödvändigt resektionsomfång. I de flesta fallen är interventionen i sig tillräcklig för att avvärja kirurgi [17]. I senare skede, vanligen inom några månader, utvecklar ett fåtal patienter mekanisk ileus på basen av ischemisk strikturering [11].
Behandling efter akutskedet
Efter akutskedet görs vanligen övergång till peroral antikoagulation. Riktlinjer för val av preparat efter akut PMVT skiljer sig inte från dem vid isolerad portavenstrombos. Hos patienter utan cirros finns numera god evidens för att NOAK (direktverkande orala antikoagulantia) har liknande effekt och säkerhetsprofil som warfarin. Vid samtidig cirros är evidensen bäst for lågmolekylärt heparin och warfarin. Det finns emellertid god empirisk erfarenhet av NOAK-behandling vid cirros, och i ett nyligen publicerat konsensusdokument slås fast att NOAK bedöms säkert och effektivt vid Child–Pugh A- och B-cirros, men bör undvikas vid mer uttalad leverfunktionsnedsättning, motsvarande Child–Pugh C [19]. Risken för biverkningar, inkluderande blödning, av antikoagulantia hos patienter med kompenserad levercirros är inte högre än för patienter utan cirros [18].Koagulationsutredning, enligt sedvanlig rutin, bör övervägas hos samtliga patienter med PMVT. Vid utbredd akut trombotisering fortsätter behandlingen vanligen livet ut eller tills kontraindikation uppstår. Rekommendationen är om möjligt ännu starkare hos patienter som genomgått endovaskulär terapi med TIPS, eftersom SMV-engagemang visat sig utgöra en riskfaktor för stentdysfunktion [15]. Tidsbegränsad behandling kan övervägas hos en patientgrupp utan andra riskfaktorer för upprepad tromboembolism där det funnits en övergående utlösande faktor.
Erfarenheter från Akademiska sjukhuset
Fram till och med mars 2022 har det på Akademiska sjukhuset genomförts 37 transjugulära interventioner på patienter med PMVT. I en publicerad sammanställning av ingreppen genomförda mellan 2014 och 2018 (5 kvinnor, 16 män; medelålder 48 år) hade 8 av 21 patienter klinik och radiologi förenlig med akut PMVT, medan övriga uppvisade tecken till kronicitet redan vid diagnos [20]. I samtliga fall krävdes upprepade interventioner (≤4 gånger) innan bibehållet venöst avflöde kunde säkerställas. Frekvensen av pre- och postoperativa komplikationer var högre vid kronisk trombotisering, och i denna grupp var även fallen med åtgärdskrävande reocklusioner fler. Det förekom ingen 30-dagarsmortalitet eller signifikanta blödningar. En patient med akut PMVT avled efter 6 månader på grund av snabbt progredierande malignitet.
Utifrån vår erfarenhet är de tekniska förutsättningarna för ett framgångsrikt ingrepp bedömbara först på interventionsbordet. I flera av fallen bedömdes intervention utsiktslöst utifrån DT-bilderna, men likafullt kunde framgångsrik intervention genomföras efter att flebografi identifierat kontrastfyllda nativa mesenterialvensgrenar möjliga att kateterisera. Kontakt med interventions- och TIPS-kompetent sjukhus rekommenderas därför alltid vid utbredd PMVT, även vid till synes utsiktslösa fall. Vid Akademiska sjukhuset kontaktas gastromedicinjouren för dessa frågeställningar under dag- och kvällstid, medan kärlkirurgjouren kontaktas övrig tid.
Patientfall
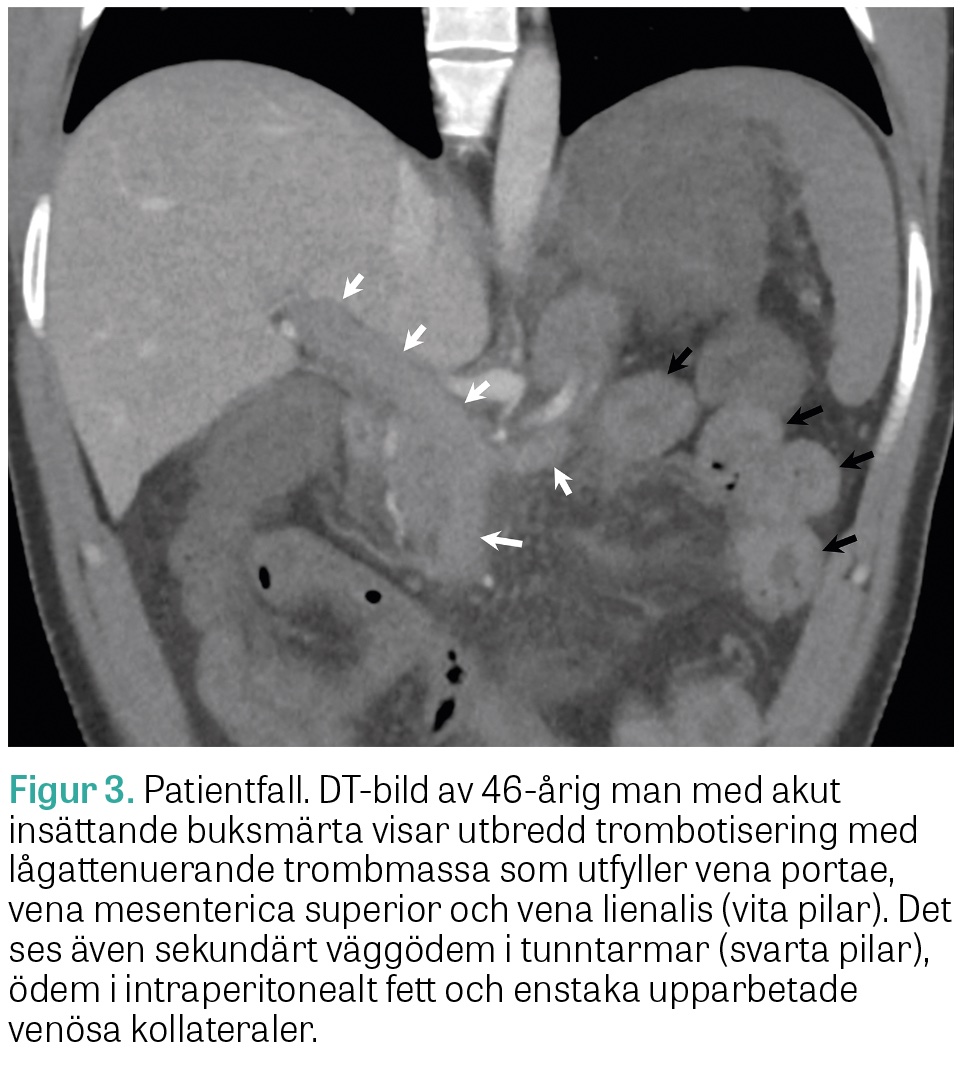
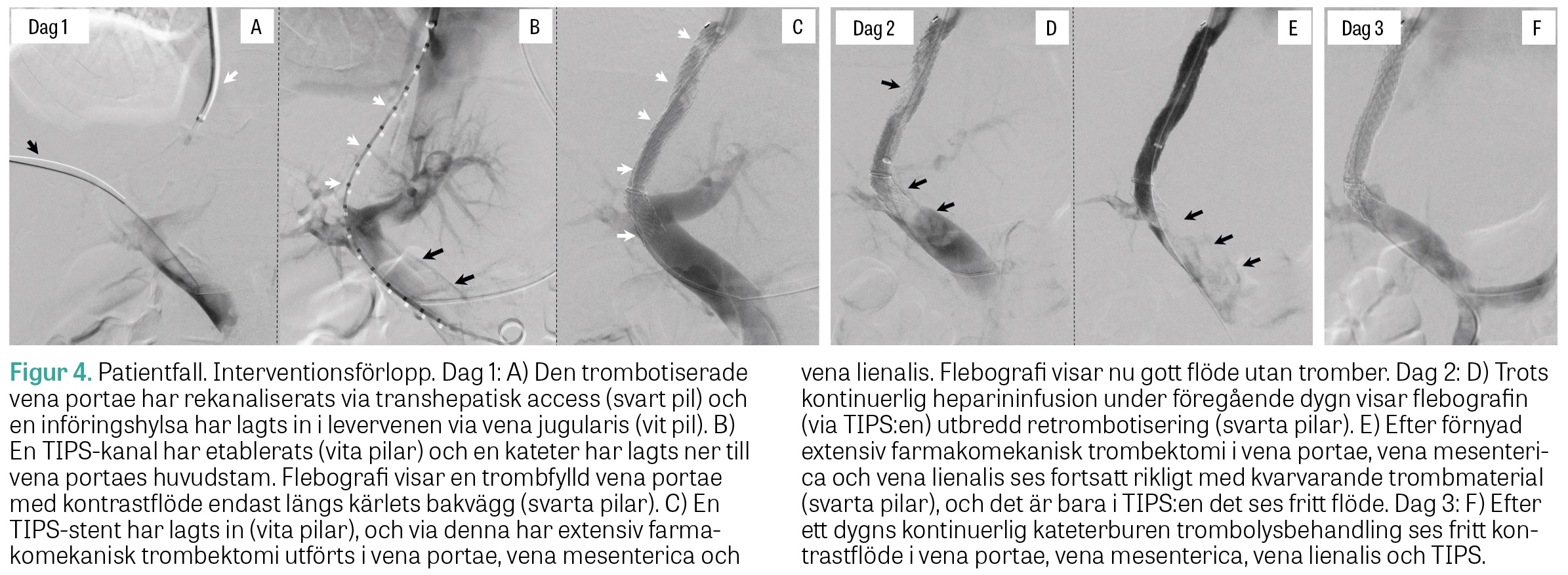
46-årig icke-rökande man, som i tidigare sjukhistoria opererats för malignt melanom in situ utan hållpunkter för recidiv. För övrigt frisk och medicinfri. Veckolång anamnes på matleda och illamående. Söker hemortssjukhuset på grund av snabbt insättande, intensiv buksmärta. Bukpalpation är utan anmärkning, varför tillståndet bedöms som »pain out of proportion«. DT-angiografi visar massiv PMVT med sekundärt väggödem i tunntarmar och högerkolon, ödem i intraperitonealt fett och enstaka upparbetade venösa kollateraler (Figur 3). Dessutom ses lindrig lungembolisering samt en trombos i vena iliaca. Heparininfusion påbörjas, och efter kontakt med gastromedicinjouren vid Akademiska sjukhuset överförs patienten till Uppsala för interventionsförsök. Vid ingreppet sätts först ett vena cava-filter för att hindra embolisering från bäckentromboserna, och därefter anläggs en TIPS. Genom denna utförs extensiv farmakomekanisk trombektomi som upprepas dagen därpå, då terapin även kompletteras med (kvarliggande) kateterburen trombolys, innan fritt venöst avflöde kan konstateras (Figur 4). Heparin växlas därefter till lågmolekylärt heparin, som efter utskrivning till hemorten byts till tills vidare-behandling med warfarin. Koagulations- och malignitetsutredning utfaller normalt, och patienten är i dag, 5 år efter insjuknandet, fortsatt välmående utan kliniska hållpunkter för retrombotisering.
Sammanfattning
Akut PMVT är ett potentiellt livshotande tillstånd och en viktig differentialdiagnos vid akut buk, inte minst hos patienter med känd trombosbenägenhet. Tidig diagnos och behandling förbättrar förutsättningen för rekanalisering, vilket i sin tur minskar risken för livshotande tarmgangrän och portal hypertension. Handläggningen bör vara multidisciplinär och involvera gastroenterolog, TIPS-kompetent interventionsradiolog, kärl- och bukkirurg samt koagulationsexpertis. I svåra fall bör perkutan intervention med TIPS och trombektomi övervägas i tidigt skede parallellt med insatt antikoagulation. Vid peritonit ska kirurg konsulteras för ställningstagande till laparotomi och tarmresektion.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Situationer då perkutan intervention vid akut PMVT bör övervägas
- Vid överhängande risk för akut transmural tarminfarkt trots flera dagars antikoagulation.
- Vid klinisk försämring trots adekvat farmakologisk behandling.
- I fall där patienten redan vid symtomdebut har hotande tarmgangrän eller portal hypertension med blödande esofagusvaricer.
- När patienten inte bedöms lämplig för kirurgi eller antikoagulation.