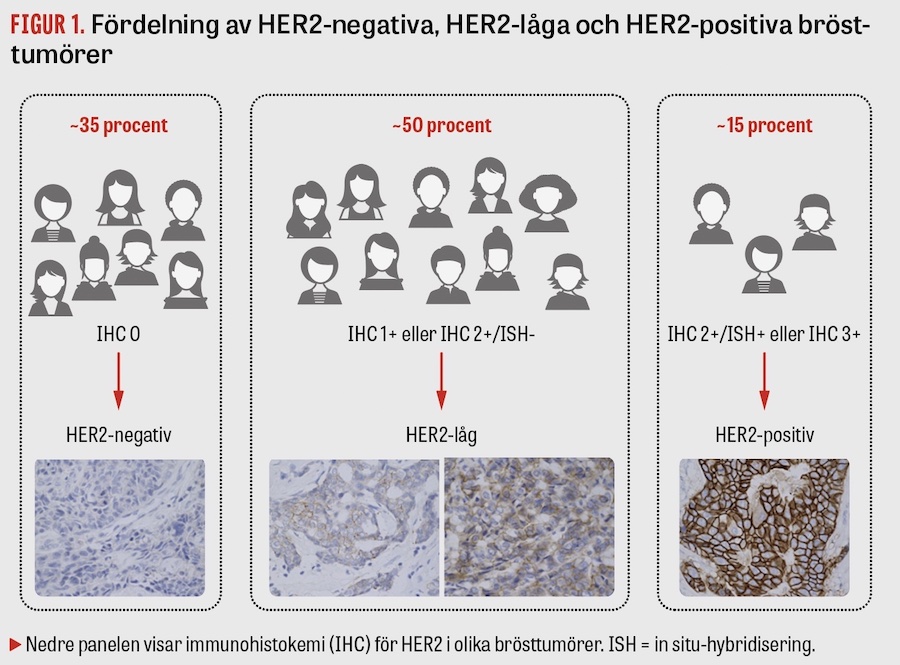
Överuttryck av HER2 (human epidermal growth factor receptor 2) (immunohistokemi [IHC] 2+/3+ eller in situ-hybridisering [ISH]-positiv) finns i ca 15 procent av bröstcancerfall.
HER2-låg bröstcancer har upptäckts vara en separat entitet, som utgör ca 50 procent av fallen. Definitionen som används mest är IHC 1+/2+ eller ISH-negativ.
Studier med HER2-antikroppsläkemedelskonjugatet trastuzumab–deruxtekan (Enhertu) har visat imponerande antitumoral aktivitet hos kvinnor med icke-resekabel HER2-låg bröstcancer.
Forskning behövs för att komma fram till förfinade sätt att definiera HER2-låg bröstcancer, och en möjlig roll finns hos nya avbildningsmetoder, som HER2-positronemissiontomografi (PET) med [68Ga]Ga-ABY-025.
Bröstcancer är den vanligaste cancersjukdomen hos kvinnor i Sverige. År 2020 rapporterades 10 043 fall av diagnostiserad bröstcancer hos kvinnor, och 1 385 kvinnor dog i bröstcancer samma år [1].
Det har varit känt sedan flera årtionden att HER2 (human epidermal growth factor receptor 2) är överuttryckt i omkring 15 procent av invasiva brösttumörer. HER2 är en medlem i familjen tillväxtfaktorreceptorer och är ett nyckelprotein involverad i intracellulär tillväxtsignalering. Överuttryck av HER2 är associerad med ökad proliferation och har en viktig prognostisk och prediktiv betydelse [2]. Med utvecklingen av HER2-riktade läkemedel har den dystra prognosen för HER2-positiv bröstcancer tydligt ljusnat, med en förbättring av 5-årsöverlevnad för svenska patienter med alla stadier av HER2-positiva tumörer från 81,4 till 84,9 procent mellan 2008 och 2011 [1]. Denna siffra förväntas stiga ytterligare när mer aktuella uppföljningsdata blir tillgängliga.
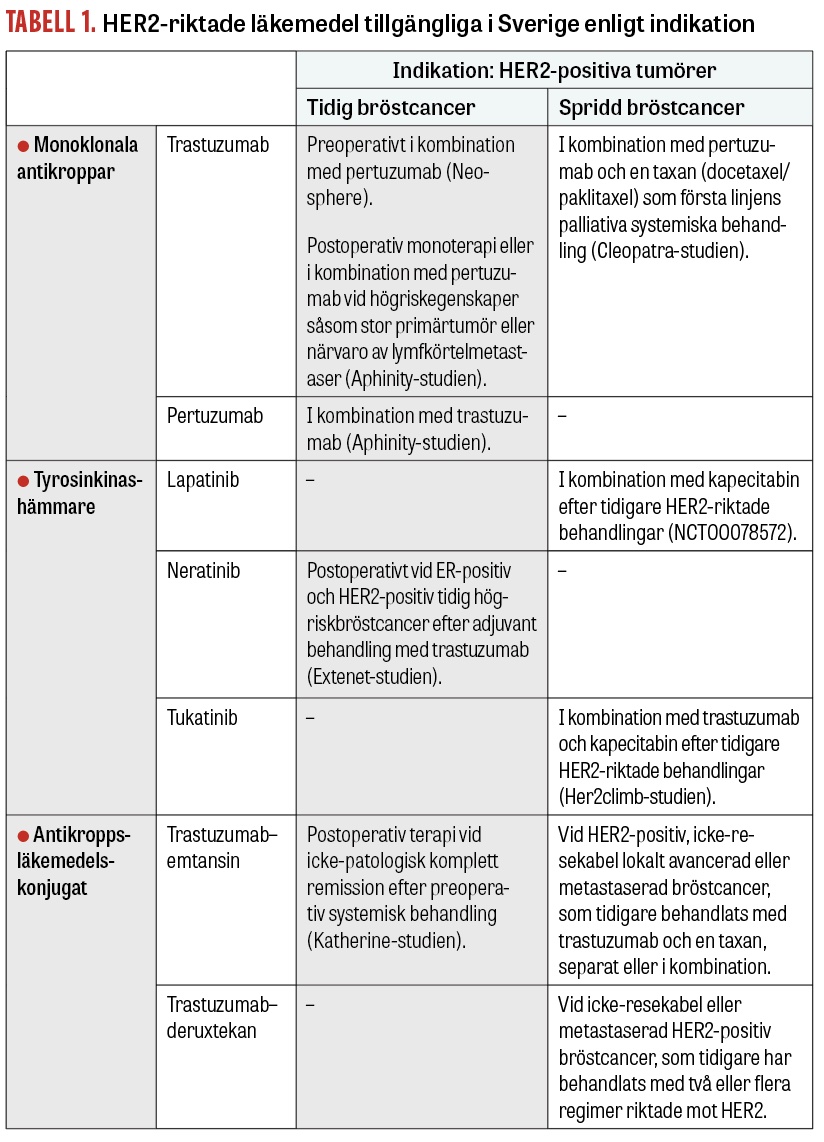
I dag finns det 7 godkända HER2-riktade läkemedel i EU: trastuzumab och pertuzumab (monoklonala antikroppar), lapatinib, neratinib och tukatinib (tyrosinkinashämmare) samt trastuzumab‒emtansin och trastuzumab‒deruxtekan (antikroppsläkemedelskonjugat, ADC), se Tabell 1. HER2-ADC är en relativt ny variant som fungerar genom att binda HER2 och sedan frigöra den kopplade cytostatikakomponenten, som i sin tur utövar sin celldödande effekt inne i cellerna.
HER2-låg bröstcancer – en ny entitet
Nyligen upptäcktes det att patienter som har låga nivåer av HER2-protein på tumörcellytan, det vill säga under den formella gränsen för definition av HER2-positivitet, kan utgöra en separat undergrupp som också kan gynnas av HER2-riktade behandlingar (Figur 1). Det uppskattas att cirka 50 procent av brösttumörerna kan klassificeras som HER2-låga [3]. Andelen HER2-låga tumörer är högre bland östrogenreceptorpositiva (ER-positiva) tumörer än bland trippelnegativa: 65,4 procent jämfört med 36,6 procent, baserat på data från en stor retrospektiv analys [4]. HER2-uttryck är en dynamisk process, och fler tumörer utvecklar en HER2-låg fenotyp vid progress till avancerad sjukdom [5].
Riktade terapier. 54 patienter med HER2-låg icke-resekabel bröstcancer behandlades med trastuzumab‒deruxtekan i en fas 1-studie [6]. Patienterna hade fått olika systemterapier mot spridd bröstcancer (median 7,5 vid tidigare behandlingslinjer). Den bekräftade objektiva svarsfrekvensen, utvärderad genom oberoende central radiologisk granskning, visade en antitumoral effekt hos 20 av 54 patienter (37 procent; 95 procents konfidensintervall [95KI] 24–51) med en medianduration för respons på 10,4 månader (95KI 8,8–ej utvärderbart). En kliniskt relevant toxicitet var utvecklingen av interstitiell lungsjukdom, som 3 patienter avled av.
I juni 2022, vid en årlig konferens arrangerad av American Society of Clinical Oncology, presenterades de första resultaten från fas 3-studien Destiny-breast04 som samtidigt publicerades i New England Journal of Medicine [7]. I denna studie inkluderades 557 patienter med spridd eller icke-resekabel HER2-låg bröstcancer, både med ER-positiva och ER-negativa tumörer. Patienter randomiserades 2:1 till trastuzumab‒deruxtekan eller läkarens val av kemoterapi (kapecitabin, eribulin, gemcitabin, paklitaxel eller nab-paklitaxel). Resultaten visade en statistiskt signifikant och kliniskt meningsfull förbättring av både progressionsfri överlevnad (10,1 månader vs 5,4 månader, hazardkvot [HR] 0,51; P < 0,001) och total överlevnad (23,9 månader vs 17,5 månader, HR 0,64; P = 0,001) hos patienter som fick trastuzumab‒deruxtekan, oavsett hormonreceptorstatus. Den amerikanska läkemedelsmyndigheten FDA godkände läkemedlet för behandling av spridd eller lokalt avancerad HER2-låg bröstcancer den 5 augusti 2022, och den europeiska läkemedelsmyndigheten EMA:s granskning av ärendet pågår för närvarande.
Utöver signaler som visar en tydlig effekt av ADC vid HER2-låg bröstcancer finns det tecken på att patienter med tumörer utan HER2-uttryck (HER2 0) kan ha nytta av trastuzumab‒deruxtekan [8]. Mekanismen bakom detta tycks vara en så kallad indirekt skadeeffekt, där cancerceller utan HER2-uttryck dödas av frisläppta cellgifter från HER2-uttryckande celler i närheten [9].
Utmaningar vid diagnostik av HER2-låg bröstcancer
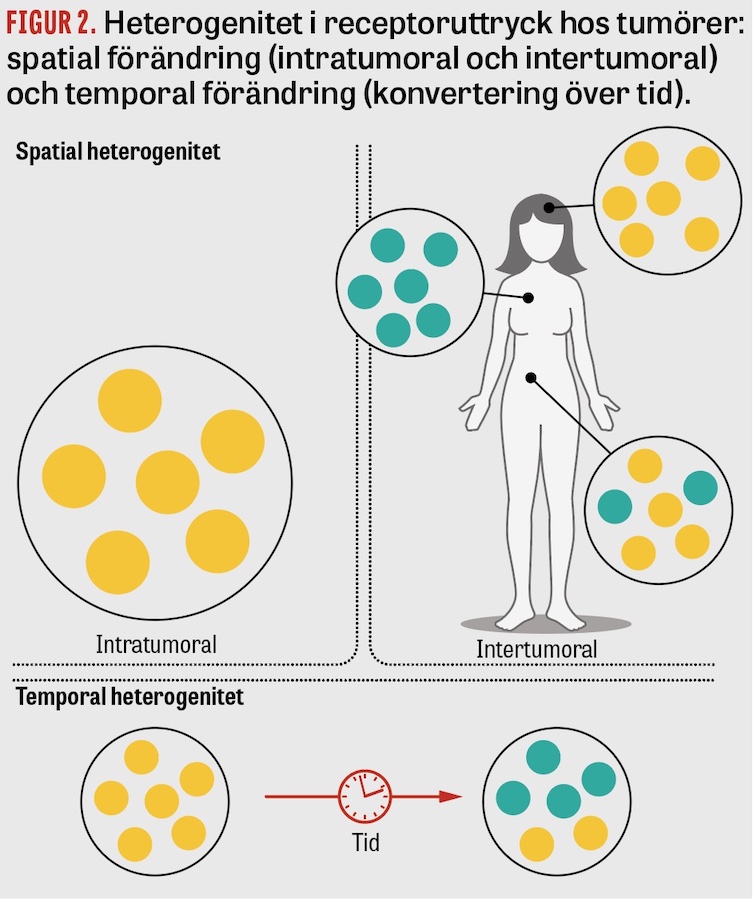
Olika praktiska svårigheter finns för närvarande vid upptäckt och hantering av HER2-låg bröstcancer. Internationellt accepterade definitioner av HER2-låg status saknas, och det är för närvarande okänt hur heterogena HER2-låga lesioner kan vara hos en patient (Figur 2). En retrospektiv analys av 3 689 HER2-negativa tumörer visade en suboptimal reproducerbarhet, testad med en så kallad kappa-konkordansskala, hos patologers bedömning av HER2-låg status [4]. Analysen visade en mycket bra konkordans för HER2 0 (kappa 0,82) och HER2 3+ (kappa 0,92), men bara en acceptabel konkordans för bedömning av HER2 1+ (kappa 0,67) och HER2 2+ (kappa 0,74). Denna utmaning för patologer har bekräftats i en stor genomgång av 170 tumörprov granskade av 18 olika patologer [10].
Inom klinisk rutin görs urval av patienter för behandling med HER2-riktade läkemedel genom att analysera HER2-status hos cancerceller, vanligtvis med immunhistokemi (IHC) och in situ-hybridisering (ISH) enligt internationella referensstandarder. Det finns ett tydligt kliniskt behov av att utveckla strategier som möjliggör förfinade och lättillgängliga metoder för att identifiera vilka patienter som har en optimal risk‒nyttabalans av HER2-riktade behandlingar.
Molekylär avbildning. Hybridmolekylär avbildning med olika radiofarmaka är en icke-invasiv metod som möjliggör en kombinerad (hybrid) bedömning av både anatomiska (storlek, morfologi, engagemang av olika organsystem) och funktionella (molekylära egenskaper, till exempel receptoruttryck) tumörkarakteristika hos patienter över tid. Kompletterande information om tumörens karaktär, såsom heterogenitet och mikromiljö, och dess farmakokinetiska parametrar, läkemedelsmålengagemang och behandlingssvar tillhandahålls också [11].
Genom en kartläggning av till exempel receptoruttryck i hela kroppen möjliggörs en mer förfinad bedömning av sjukdomens natur, och dynamik i receptoruttryck kan följas över tid.
Det finns olika radiofarmaka för att avbilda HER2-positiva tumörlokalisationer, till exempel monoklonala antikroppar (trastuzumab eller pertuzumab) kopplade till en isotop (89Zr, 64Cu, 111In) eller så kallade affibody-molekyler, som är små affinitetsproteiner. Den HER2-specifika »affibody«-molekylen ABY-025 (ZHER2: 2891-Cys-Mal-DOTA), ett peptidbiokonjugat, är märkt med 68Ga, och när det injiceras i blodomloppet ackumuleras det på platser där HER2 är rikliga. Vid preklinisk PET-undersökning har hög tumör/bakgrundskvot visats tidigt efter injektion [12]. Flera kliniska studier har nu utförts med spårämnet [68Ga]Ga-ABY-025 och visat att denna metod möjliggör visualisering av HER2-positiva tumörlesioner med hög diskriminerande förmåga (Figur 3). Samtidigt kan spårämnet noggrant och i realtid kvantifiera HER2-status för hela kroppen avseende metastaserad bröstcancer, vilket i en studie ledde till ändringar i klinisk hantering i 50 procent av fallen [13]. Kartläggning av HER2-låga tumörer med [68Ga]Ga-ABY-025 eller andra HER2-riktade spårämnen har hittills inte undersökts på ett systematiskt sätt. Enstaka patienter i tidigare studier med [68Ga]Ga-ABY-025 hade formellt HER2-negativa tumörer, och några hade ändå upptag av spårämnet inom vissa metastaser (Jens Sörensen, Uppsala, pers medd; 2022).
HER2-PET-studie. Vi kommer under hösten 2022 att starta en avbildningsstudie (EudraCT 2022-000486-41) med positronemissionstomografi (PET)/datortomografi (DT) för patienter med olika HER2-drivna tumörer, inklusive HER2-positiv gastroesofageal cancer, HER2-muterad lungcancer och HER2-låg bröstcancer. I studien görs avbildningarna med [68Ga]Ga-ABY-025.
Vår studiehypotes är att PET/DT-avbildning med spårämnet [68Ga]Ga-ABY-025 ger en icke-invasiv metod för att undersöka hela kroppens HER2-status, inklusive lokalisering av tumörer med HER2-låg status. I en pilotstudie kommer vi att inkludera 10 patienter med HER2-låg icke-resekabel bröstcancer. Det primära syftet med pilotstudien är att karakterisera HER2-status i hela kroppen genom PET/DT med [68Ga]Ga-ABY-025, och relatera upptag av HER2-PET till referensstandarden IHC/ISH. Pilotstudien bedöms vara framgångsrik om PET/DT med [68Ga]Ga-ABY-025 identifierar samtliga tumörlesioner med HER2-uttryck (både HER2-låga och HER2-positiva) och inte har något falskt positivt upptag av HER2-negativa lesioner. I en fortsatt studie planerar vi att inkorporera en behandlingsmöjlighet med HER2-ADC för att undersöka det terapiprediktiva värdet av HER2-PET vid val av behandling med dessa läkemedel. Detta görs genom att utvärdera behandlingseffektiviteten enligt internationella kriterier (Response evaluation critera in solid tumours, RECIST) och undersöka korrelationen mellan respons och HER2-status med helkropps-PET och IHC/ISH.
Sammanfattning
Närvaro av HER2 i cancer har ett tydligt prognostiskt och behandlingsprediktivt värde. För bröstcancerpatienter har prognosen förbättrats spektakulärt med moderna HER2-riktade läkemedel inklusive HER2-ADC. En ny entitet inom HER2-positiva tumörer har nu identifierats: HER2-låga tumörer. Resultat från studier med trastuzumab‒deruxtekan visar att HER2-riktade läkemedel kan vara mycket effektiva hos patienter med HER2-låga tumörer, och de förväntas ingå i behandlingsstrategier inom den närmaste framtiden. Förfinade kriterier för att utvärdera HER2-status behövs, och utöver mer detaljerade patologiska metoder kan PET-/DT-avbildning med ett HER2-specifikt radiomärkt spårämne (till exempel [68Ga]Ga-ABY-025) vara en potentiellt framgångsrik metod för att välja rätt behandling för rätt patient vid rätt tidpunkt.
Läs även författarintervjun med Renske Altena
Potentiella bindningar eller jävsförhållanden: Fredrik Y Frejd är anställd på företaget Affibody AB. Renske Altena har erhållit föreläsningsarvode från Mediahuset AB.



![Figur 3. Upptag av [68Ga]Ga-ABY-025 i metastaserad HER2-positiv bröstcancer, vilket visar HER2-uttryck i cancerceller (till vänster), jämfört med metabolt upptag av 18F-FDG hos samma patient (till höger) [14].](https://lakartidningen.se/wp-content/uploads/2022/11/22093-Figur-3.jpg)