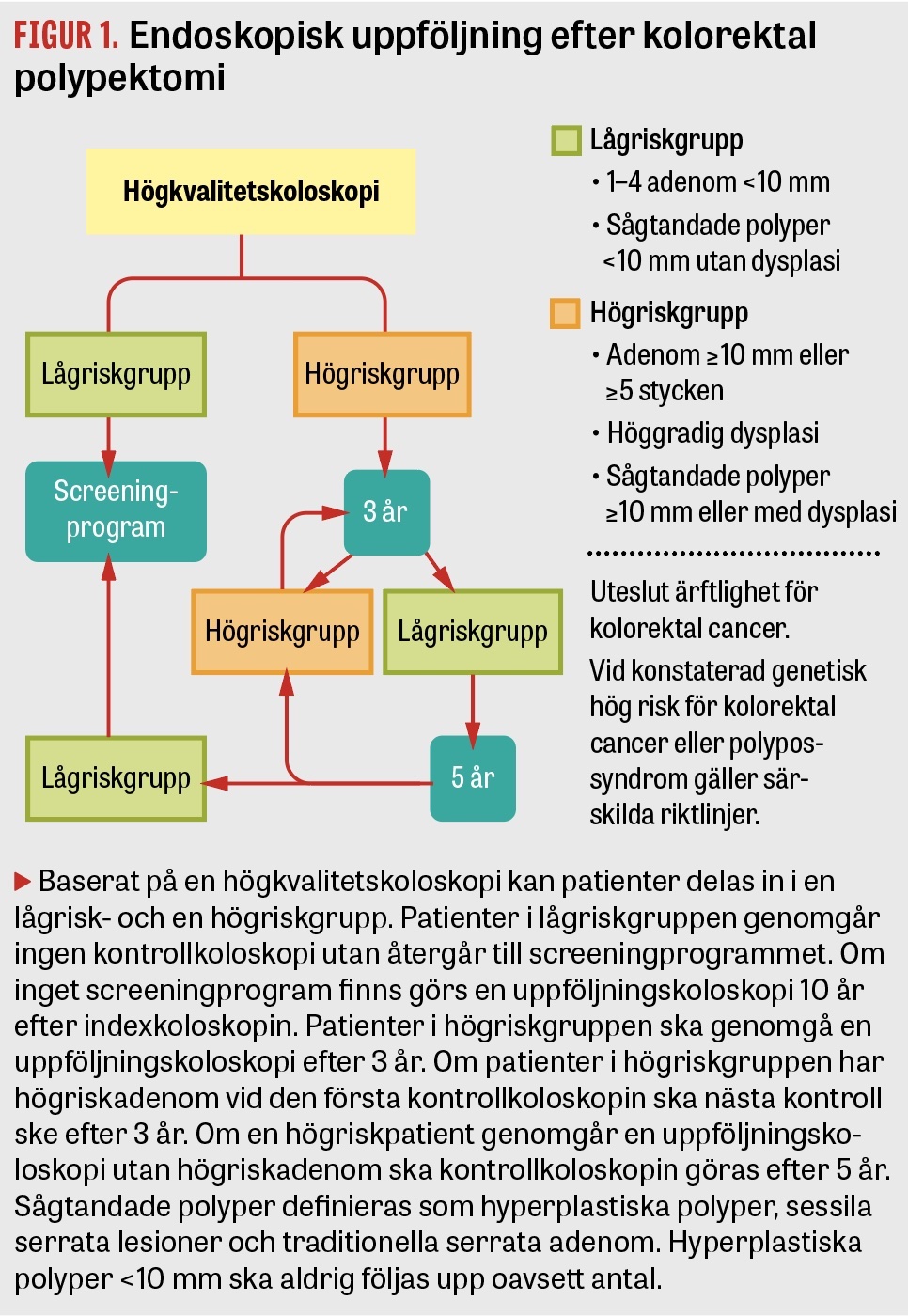
Uppdaterade evidensbaserade riktlinjer för endoskopisk uppföljning efter kolorektal polypektomi presenteras.
Riktlinjerna är huvudsakligen baserade på de rekommendationer som den europeiska föreningen för gastrointestinal endoskopi (ESGE) publicerade 2020.
I dag är det möjligt att dela upp patienter i en lågrisk- och en högriskgrupp med avseende på risk att insjukna och dö i kolorektalcancer.
En förutsättning för uppföljning är att den baseras på en högkvalitetskoloskopi.
Mer kunskap om adekvat indikation och tidsintervall behövs för att ytterligare utveckla riktlinjerna.
Kolorektalcancer drabbar knappt 7 000 personer varje år i Sverige och är den tredje vanligaste cancerrelaterade dödsorsaken [1]. Polyper är ett samlingsnamn för utväxter i gastrointestinalkanalen, men kan ha olika histologiskt ursprung. Flera sorter, exempelvis adenom, utgör förstadier till kolorektalcancer. Det är väl dokumenterat att borttagandet av precancerösa polyper och tidig detektion av cancer minskar dödligheten i kolorektalcancer [2]. I Sverige utförs drygt 100 000 koloskopier per år, och majoriteten av patienterna är äldre än 50 år. Adenom förekommer hos minst en fjärdedel av den här åldersgruppen, vilket medför att beslut om uppföljning måste fattas i mer än 20 000 fall per år. Ännu fler uppföljningsbeslut måste fattas framöver när fler kommer att ingå i polypvårdprogram som resultat av implementeringen av kolorektalcancerscreening.
2017 publicerades de senaste svenska riktlinjerna för uppföljning efter polypektomi i Läkartidningen [3]. Dessa fokuserade på att identifiera patienter med förhöjd risk för metakron avancerad neoplasi baserat på endoskopiska och histologiska fynd vid indexkoloskopin. Nyligen publicerade den europeiska föreningen för gastrointestinal endoskopi (ESGE) nya riktlinjer där man i stället fokuserade på beräkningar av nyttan mot risken när det gäller de mest relevanta kliniska målen [4]. I detta sammanhang rankades kolorektalcancerincidens och -mortalitet högre än metakron avancerad neoplasi som kliniska mål. Nya studier som analyserat långtidsrisken för insjuknande eller död i kolorektalcancer har visat att den är bara marginellt högre (1‒3 procent) efter polypektomi jämfört med allmänheten och dem som inte hade någon polyp [5]. Dessa data styrks av en annan studie som visar att incidensen av kolorektalcancer var endast 0,5‒1 procent och mortaliteten bara 0,03‒0,25 procent 10 år efter genomgången polypektomi [6]. De här studierna är grunden för en mer restriktiv uppföljning efter polypektomi i de nya uppdaterade riktlinjerna. Det är särskilt viktigt med tanke på att uppföljningskoloskopier utgör ungefär 40 procent av alla koloskopier. Jämfört med de tidigare rekommendationerna har vissa endoskopiska och histologiska riskfaktorer ifrågasatts [5, 7, 8]. Inslaget av villös histologi verkar vara av liten eller ingen betydelse för risken att insjukna i kolorektalcancer [5, 7, 8]. Dessutom har studier på sågtandade polyper (hyperplastiska polyper, sessila serrata lesioner och traditionella serrata adenom) och risken för att insjukna och dö i kolorektalcancer tillkommit, vilka stödjer rekommendationer för uppföljning [9-11]. Fördelarna med endoskopisk uppföljning måste balanseras mot risken för komplikationer och kapacitetsbrist som kan förlänga väntetider för andra patientgrupper. Den aktuella uppdateringen har gjorts på uppdrag av Svensk gastroenterologisk förening och baseras på de senaste europeiska riktlinjerna [4]. Ytterligare information kan inhämtas från föreningens webbplats [12]. Rekommendationerna inkluderar inte uppföljning efter borttagande av maligna polyper eftersom dessa fall alltid hanteras på multidisciplinär konferens.
Koloskopikvalitet
Hög koloskopikvalitet är en förutsättning för de uppdaterade riktlinjerna för endoskopisk uppföljning. Risken att insjukna eller dö i oupptäckt kolorektalcancer efter polypektomi, oavsett riskfaktorer vid indexkoloskopin och typ av uppföljning, dubbleras om indexkoloskopin var inkomplett eller tarmen var otillräckligt rengjord [5]. De parametrar som definierar en hög koloskopikvalitet har publicerats i en tidigare artikel i Läkartidningen [13]. I händelse av otillräckligt rengjord tarm (Bostonskala <6) eller inkomplett koloskopi rekommenderas tidigarelagd uppföljning med ny koloskopi inom 1 år [14]. Vi rekommenderar att alla koloskopier inrapporteras till Svenskt register för koloskopi och kolorektalcancerscreening (SveReKKS) så att koloskopikvaliteten kan monitoreras.
Polypstorlek
Polypstorleken är avgörande för val av uppföljning och kan bestämmas i samband med koloskopin eller senare vid den patologiska undersökningen av preparatet. Riktlinjerna utgår från den endoskopiska storleken. För att minska bias kan man använda en referensstandard såsom storleken på en snara eller avståndet mellan en biopsitångs öppna käftar.
Lågriskgrupp
Lågriskgruppen inkluderar nu 1‒4 icke-avancerade adenom (låggradig dysplasi <10 mm) och sågtandade polyper <10 mm utan dysplasi. Sedan förra versionen av riktlinjerna publicerades 2017 [3] har flera studier bekräftat att patienter med icke-avancerade adenom (låggradig dysplasi <10 mm) har lägre eller samma risk att insjukna eller dö av kolorektalcancer som patienter utan adenom eller som befolkningen i allmänhet [6-9, 15, 16]. Tre nyare studier om betydelsen av antalet icke-avancerade adenom ligger till grund för att ändra definitionen av lågriskgruppen från 1‒2 till 1‒4 stycken icke-avancerade adenom [5, 7, 8]. Exempelvis har en studie på 15 935 patienter med tidigare polypektomi visat att patienter med ≥3 icke-avancerade adenom inte hade någon ökad risk för kolorektalcancer jämfört med patienter utan adenom efter 13 års uppföljning [7]. I en multicenterstudie på 236 089 screeningpatienter observerade man efter knappt 8 års uppföljning att patienter med multipla icke-avancerade adenom <20 mm inte hade någon ökad risk för att insjukna eller dö av kolorektalcancer [8]. Anledningen till att behålla en storlek på <10 mm som gräns för icke-avancerade lesioner är att den ovan nämnda studien är den första som visar att icke-avancerade adenom upp till 20 mm storlek inte medför någon ökad risk. Fler studier behövs innan den storleksgränsen flyttas. En viktig ändring i den aktuella uppdateringen är att förekomst av villös histologi inte beaktas när det gäller att indela patienter som genomgått polypektomi i riskgrupper. Två nya studier har visat att förekomst av villös histologi inte medför någon ökad risk för att insjukna eller dö av kolorektalcancer [5, 8]. Detta stöds också av en metaanalys som visar att patienter med villösa polyper inte har någon ökad risk för avancerade polyper [17]. Flera nyare studier har bekräftat att patienter med sågtandade polyper <10 mm utan dysplasi inte har någon ökad risk att insjukna eller dö av kolorektalcancer [9].
Sammanfattningsvis rekommenderas ingen specifik uppföljning till patienter som tillhör lågriskgruppen, utan de ska i stället återgå till screeningprogrammet. Om det inte är utbyggt lokalt, eller om det kommer att gå mer än 10 år tills patienten erbjuds screening så rekommenderas en kontrollkoloskopi 10 år efter indexkoloskopin.
Högriskgrupp
I ESGE:s nya riktlinjer definieras hög risk som förekomst av avancerade adenom (adenom ≥10 mm i storlek och/eller med inslag av höggradig dysplasi) samt om 5 eller fler adenom detekteras [4]. Observera att sågtandade polyper inte räknas in i det totala antalet adenom. Ovannämnda studie på 15 935 patienter som inkluderade 2 882 avancerade adenom rapporterade en signifikant ökad risk för att insjukna eller dö av kolorektalcancer jämfört med patienter utan adenom efter 13 års uppföljning [7]. Dessutom har studier visat att högriskpatienter som genomgår uppföljning med koloskopi har en klart minskad risk för att insjukna i kolorektalcancer jämfört med ingen uppföljning [5, 18]. I högriskgruppen ingår också sågtandade polyper ≥10 mm eller med förekomst av dysplasi. Litteraturen har visat att sågtandade polyper medför en ökad risk för att insjukna i kolorektalcancer [9-11, 19, 20]. En studie på 12 955 patienter rapporterade att risken för metakron kolorektalcancer var mer än 4 gånger större efter borttagande av en sågtandad polyp ≥10 mm jämfört med befolkningen i allmänhet [11]. I enlighet med tidigare riktlinjer från 2017 rekommenderas en kontrollkoloskopi 3 år efter indexkoloskopin hos patienter i högriskgruppen [4]. Om patienten då överförs till lågriskgrupp rekommenderas ytterligare en kontroll efter 5 år. En patient som tidigare tillhört högriskgrupp och som genomgått 2 på varandra följande koloskopier med lågriskfynd kan återgå till screeningprogrammet. Optimal uppföljningstid av högriskpatienter undersöks för närvarande i flera studier. En studie visade att det inte var någon skillnad i förekomst av kolorektalcancer mellan högriskpatienter som gjorde uppföljningskoloskopi 2, 3 eller 5 år efter polypektomin [5]. I dagsläget saknas det dock robusta data från långtidsstudier om uppföljningsintervall och risken att insjukna och dö av kolorektalcancer. Det ska noteras att en pågående studie (European polyp surveillance) undersöker möjligheten att förlänga uppföljningsintervallet till 5 år för patienter i högriskgruppen [21].
Speciella situationer
»Piecemeal«-resektion. Data om recidiv efter så kallad piecemealresektion (borttagande av polyp i fler än en bit) av polyper <20 mm saknas och blir en individuell bedömning. Piecemealresektion av icke-stjälkade adenom >20 mm är associerad med en recidivfrekvens nära 20 procent [4]. Majoriteten (>90 procent) av recidiven uppstår inom 6 månader, även om sena recidiv förekommer [22]. Nya data har visat att termisk ablation av resektionskanten med snarans spets eller argonplasmakoagulation kan minska risken för recidiv avsevärt [23, 24]. För att underlätta uppföljning kan man tatuera slemhinnan 5 cm distalt om tagstället (cekum och rektum undantaget). Mot bakgrund av detta rekommenderas att piecemealresektion av icke-stjälkade adenom >20 mm följs upp inom 6 samt 12 månader. De här patienterna ska också genomgå en kontrollkoloskopi efter 3 år enligt programmet. Vid uppföljning bör tagstället inspekteras och fotodokumenteras i vanligt ljus samt med virtuell/konventionell kromoendoskopi. Rutinmässiga biopsier av tagstället i avsaknad av endoskopiska fynd rekommenderas inte.
Osäker radikalitet. Vid osäker radikalitet i samband med polypresektion bör man överväga tidigarelagd kontroll, i synnerhet om polypen är >20 mm, då risken för att insjukna eller dö i kolorektalcancer är påtagligt förhöjd [5, 8].
Ärftlighet. Fall av kolorektalcancer i släkten och insjuknandeålder ska efterfrågas. Patienter som har ärftliga tillstånd med definierade mutationer, såsom Lynchs syndrom och polypossyndrom (familjär adenomatös polypos och Mut-YH–associerad polypos), följs i särskilda uppföljningsprogram som går utanför innehållet i den här artikeln [12]. En tumregel är att patienter med fler än 10 kolorektala polyper ska remitteras till onkogenetisk utredning.
Ålder. Data saknas för att rekommendera uppföljning efter 80 års ålder. Risken för koloskopirelaterade komplikationer ökar avsevärt hos äldre patienter [13], och därför rekommenderas att man avbryter uppföljningen av polyper vid 80 års ålder eller tidigare vid allvarlig komorbiditet.
Slutsats
Dessa uppdaterade riktlinjer utgör en evidensgrundad riskstratifiering för endoskopisk uppföljning efter polypektomi med syfte att begränsa kontroller till patienter med ökad risk för att insjukna eller dö i kolorektalcancer. Restriktiva regler för endoskopisk uppföljning efter polypektomi är viktiga för optimalt utnyttjande av koloskopiresurserna i takt med implementeringen av kolorektalcancerscreening i Sverige.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.