Kronisk diarré utan påvisbar orsak är vanligt förekommande.
Ett fåtal behandlingsstudier finns, och de är ofta baserade på ett litet antal patienter eller friska frivilliga.
Behandlingen baseras ofta på försök och misstag, med stor variation i valet av behandling.
Riktlinjer saknas, och det finns en kunskapslucka för behandlingsmål, såsom avföringfrekvens, -konsistens och -form.
Artikeln beskriver en behandlingstrappa för kronisk idiopatisk diarré som bygger på gemensam kunskap och erfarenheter.
Kronisk diarré är vanligt och förekommer hos 5 procent av befolkningen. Diagnostiken är ofta en utmaning, och behandling måste ofta initieras utan att säker orsak har konstaterats. Målsättningen med denna artikel är att ge rekommendationer om farmakologiska behandlingssteg vid diarré. Det är viktigt att hålla i minnet att diarré kan ha olika innebörd för olika individer, från osäkerhet och rädsla för ofrivillig tömning till återkommande inkontinens. Det innebär alltid en påtagligt sänkt livskvalitet.
Grundläggande mekanismer
Diarré innebär ändrad avföring avseende frekvens, konsistens och mängd. Tre eller flera dagliga avföringar med lös eller vattnig konsistens som överstiger 200 g/dygn eller 200 ml/dygn definieras som diarré [1]. Tillståndet indelas i akut diarré med varaktighet mindre än 2 veckor, persisterande diarré med varaktighet 2‒4 veckor och kronisk diarré med varaktighet överstigande 4 veckor [2].
Diarré är ett symtom som speglar obalans mellan absorption och sekretion av vatten i tarmen. Absorptionen regleras av elektrolyttransporten genom tarmväggen, där vatten följer passivt genom osmos. Normalt tillförs mag‒tarmkanalen ca 9 liter vätska per dygn genom oralt intag och sekretion. Av detta absorberas ca 98 procent, vilket ger en hanterbar konsistens på avföringen. Vid diarré innehåller avföringen i regel 50 procent mer vatten, och överskottet uppstår genom ökad sekretion eller minskad absorption i tarmen, ökad osmos till tarmlumen eller snabb propulsion av innehållet genom mag‒tarmkanalen.
Olika diarrétyper
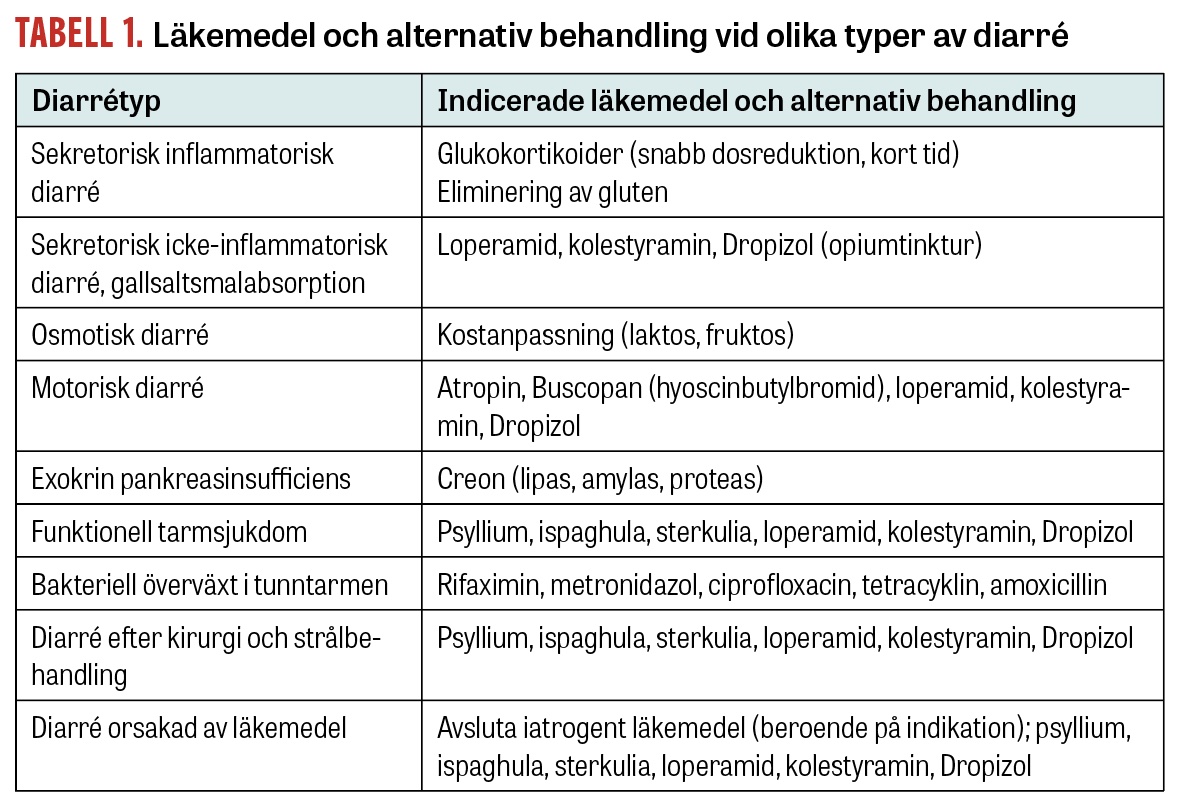
Av praktiska skäl indelas tillståndet i sekretorisk, osmotisk eller motorisk diarré, beroende på den bakomliggande mekanismen. Den sekretoriska diarrén kan bero på ett inflammatoriskt tillstånd med passiv sekretion genom läckande tarmslemhinna och ska uteslutas först i en utredning. Sekretorisk diarré kan också bero på neuronal eller hormonell stimulering av sekretionen (avföringen är isoosmolär). Den osmotiska diarrén har sin orsak i en absorptionsstörning orsakad av födoämnesintolerans (avföringen är då hyperosmolär). Den motoriska diarrén orsakas av en funktionsstörning i det enteriska nervsystemet eller av en samtidig hormonell stimulering (isoosmolär avföring).
Sekretorisk inflammatorisk diarré. Den inflammatoriska diarrén beror på ökad permeabilitet med sekretion och kännetecknas av alarmsymtom, såsom blod i avföringen, viktförlust och feber. I första hand misstänks celiaki, inflammatorisk tarmsjukdom med ulcerös kolit eller Crohns sjukdom, där även buksmärta är vanligt. Mikroskopisk kolit är ett annat inflammatoriskt tillstånd med diarré, som i regel har vattnig konsistens. Kroniska infektioner i mag‒tarmkanalen kan orsaka sekretorisk diarré med inflammatoriskt inslag av Giardia lamblia och Entamoeba histolytica, kryptosporidier och Brachyspira species, Blastocystis hominis och Endolimax nana, liksom systemiska sjukdomar som Whipples sjukdom (Tropheryma whipplei) och hiv.
Många läkemedel kan orsaka diarré genom osmotiska effekter (akarbos, laxantia, olmesartan), sekretorisk stimulering (antiarytmika, metformin, mesalazin) eller motoriska effekter (tyroxin, irinotekan, erytromycin) samt inflammatoriska reaktioner (5-fluorouracil, irinotekan, NSAID). Antibiotika ger i regel upphov till diarré som en sekundär effekt på tarmfloran. Immunkontrollpunktshämmare (»checkpoint-hämmare«) kan ge upphov till en autoimmun inflammatorisk reaktion, där såväl akut som mikroskopisk kolit kan orsaka sekretorisk diarré.
Sekretorisk icke-inflammatorisk diarré. Vid inflammation eller resektion av distala ileum kommer resorptionen av galla att bli otillräcklig, med ökat flöde av gallsalter till kolon som följd, vilket stimulerar sekretion och motorik [3]. En ofta förbisedd diagnos är idiopatisk gallsaltsdiarré, då produktionen av galla är förhöjd, vilket innebär att reabsorptionen av gallsalter överskrids. Tillståndet diagnostiseras med serumprov i fasta för S-7-OH-kolestenon (7-alfahydroxi-4-kolesten-3-on) eller med 75Se-HCAT-test. Neuroendokrina tumörer är en ovanlig orsak till diarré, men kan spåras med serumprov för kromogranin A eller gastrin. Det är viktigt att notera att kromogranin A kan stiga vid samtidig behandling med protonpumpshämmare. Det är okänt hur länge denna stegring kvarstår, varför kromogranin B, som inte påverkas av protonpumpshämmare, kan vara mer informativ som tumörmarkör.
Osmotisk diarré. Den osmotiska diarrén beror på malabsorption med ansamling av näringsämnen i tarmen. Vid brist på disackarider (laktas, maltas, sukras, isomaltas/palatinas) uppträder hyperosmolär diarré. På cellulär nivå förekommer defekter i absorptionen av fruktos i natriumberoende SGLT (natriumglukossamtransportör) liksom i GLUT2 (glukostransportör 2), med intolerans som följd. Vid celiaki föreligger en osmotisk diarré samtidigt med ett inflammatoriskt inslag, vilket gör sjukdomsbilden komplex.
Genom den bakteriella fermenteringen i kolon uppträder symtom som uppblåsthet och diarré. Symtomen kan variera på grund av bakteriell fermentering och olika grader av bristande absorption. Kolhydratmalabsorption kan också uppstå till följd av patologisk tarmflora efter infektioner, vid Crohns sjukdom med stenoser samt vid postoperativa tillstånd. Variationer i tarmens förmåga att hantera gas och vätska innebär att symtombilden kan variera stort mellan olika individer.
Motorisk diarré. Vid motorisk diarré stimuleras det enteriska nervsystemet och den glatta muskulaturen genom en toxisk eller hormonell påverkan. Den motoriska stimuleringen driver innehållet snabbt genom tarmen med minskad absorption, vilket bidrar till ökad vattenmängd i avföringen. Motorisk stimulering kan bidra till diarrén vid neuroendokrin tumör. Flera läkemedel (kinidin, digoxin) och vissa antibiotika (erytromycin, azitromycin) kan ha motorisk diarré som biverkan. Infektiösa gastroenteriter kan stimulera tarmmotoriken (kolera, samonella, Clostridioides difficile), men överskuggas i regel helt av den sekretoriska diarrékomponenten. Som ytterligare en mekanism kan motorisk stimulering minska reabsorptionen av gallsalter i distala ileum, vilket indirekt leder till stimulerad sekretion i kolon.
Exokrin pankreasinsufficiens. Vid exokrin pankreasinsufficiens uppstår maldigestion på grund av bristande enzymaktivitet. Typiska symtom är uppblåsthet, diarré och viktförlust. Ofta följer steatorré med fettglänsande avföring som är svårspolad i toaletten. Diagnosen kronisk exokrin pankreasinsufficiens ställs vid minskad mängd elastas i avföring. Testen är specifika för humant elastas och kan genomföras under samtidig behandling med Creon (pankreatin) i doser av 100 000 IE lipas eller mer per dag beroende på kostens fettinnehåll.
Funktionell tarmsjukdom. Den vanligaste orsaken till långvarig diarre är funktionella tillstånd, med diagnoserna irritabel tarm med diarré (IBS-D) och funktionell diarré. IBS-D kännetecknas av diarré tillsammans med buksmärtor minst en gång per vecka under sammantaget 3 månader den senaste 6-månadersperioden och samtidigt förändrat tarmtömningsmönster. Patofysiologin för irritabel tarm är multifaktoriell; förekomst av dysbios och barriärskada i tarmen samt funktionsrubbningar i autonoma och viscerala nerver associerade med motilitetsrubbningar och hypersensitivitet i tarmen anses vara betydelsefulla. I avsaknad av buksmärtor talar man i stället om funktionell diarré.
Bakteriell överväxt. Bakteriell överväxt i tunntarmen är ofta ett sekundärt tillstånd till bland annat divertikel eller stenos i tunntarmen, nedsatt motilitet eller IgA-brist, men kan även uppstå efter bakteriell kolonisation av tunntarmen. Vanligen ger tillståndet en funktionsnedsättande diarré direkt efter måltid då en ökad mängd gallsalter spiller över till kolon. Utandningstest med analys av vätgas och metan efter intag av sockerarter kan vara vägledande för diagnos. Behandlingen syftar till att eliminera den bakteriella kolonisationen med rifaximin som ett icke-absorberbart antibiotikum med bred baktericid effekt.
Diarré efter kirurgi och strålbehandling. Gastrointestinal kirurgi riskerar att påverka motilitet och vattentransport i tarmen. Olika typer av bariatrisk kirurgi innebär att funktionell tunntarmslängd förkortas, varför diarré kan uppstå även om kirurgin kombineras med ett restriktivt ingrepp på magsäcken (gastrisk bypass, sleeve-gastrektomi) för att minska den osmotiska belastningen på tarmen. Denna typ av diarré kan vara svår att avgränsa mot bakteriell överväxt i tunntarmen.
Resektion av ileocekalklaffen innebär en betydande risk för diarré eftersom backventilen i ileocekalklaffen går förlorad, och detta ökar risken för bakteriell överväxt i tunntarmen. Även omfattande tunntarmsresektioner kan orsaka diarré på grund av snabb tarmpassage, gallsaltsmalabsorption och minskad resorption. Graden av diarré är beroende av längden av resekerad tarm. Proximala stomier kan ge höga stomiflöden, men är inte diarré i egentlig mening. Extern strålbehandling mot buk och bäcken innebär risk för diarré på grund av skador på slemhinna och tarmvägg.
Diskussion
Ofta ställs den behandlande klinikern inför diarréproblematik med ett tillstånd som kräver omgående behandling. Erfarenheten från det kliniska arbetet visar att man många gånger måste angripa problemet med symtomatisk behandling utan säker kunskap om orsaken.
Vid expertgruppsmöten i april 2021 och maj 2022 diskuterades problematiken kring diarré inom gastroenterologi, kirurgi och onkologi med målsättningen att skapa en behandlingstrappa för att angripa problematiken utifrån fysiologiska mekanismer och farmakologisk kontroll.
Det kliniska problemet. Vid utredning av kronisk diarré är vanligen den dikotoma frågeställningen inflammatorisk eller funktionell tarmsjukdom. Situationen blir ofta problematisk efter resultatlösa utredningar med fekalt kalprotektin, IgA-antikroppar mot transglutaminas, 7-OH-kolestenon- alternativt 75Se-HCAT-test, fekal PCR-analys avseende patogena tarmbakterier, Clostridioides difficile-toxin, direktmikroskopi avseende parasiter och koloskopi med biopsier. Symtomatisk behandling enligt empiriska regler är det som kvarstår.
Inom kirurgin och onkologin finner vi dessa patienter efter stora tarmresektioner och proximala stomier, efter strålbehandling och under cytostatikabehandling. Strålbehandling av såväl cervixcancer som prostata- och rektalcancer ger ofta proktit, där även distala ileum riskerar att bestrålas genom att tunntarmen hänger ned i lilla bäckenet. Adjuvant cytostatikabehandling med 5-fluorouracil eller irinotekan, liksom antracykliner, främst doxorubicin, kan ge besvärande diarré som blir begränsande för behandlingen. Den tarmskadande effekten av 5-fluorouracil beror på en intestinal mukosit med villusskador och epiteliala ulcerationer med samtidig diarré, dyspepsi och buksmärta. Irinotekan har kolinesterashämmande effekter, vilket leder till diarré. Doxorubicin har en direkt tarmskadande effekt med apoptos i kryptceller. Den skadade tarmvävnaden förlorar förmågan att reabsorbera gallsalter, vilket bidrar till symtomen. För det generella omhändertagandet måste vätske- och elektrolytstatus samt serumkreatinin kontrolleras, särskilt i desolata fall.
Behandlingstrappa
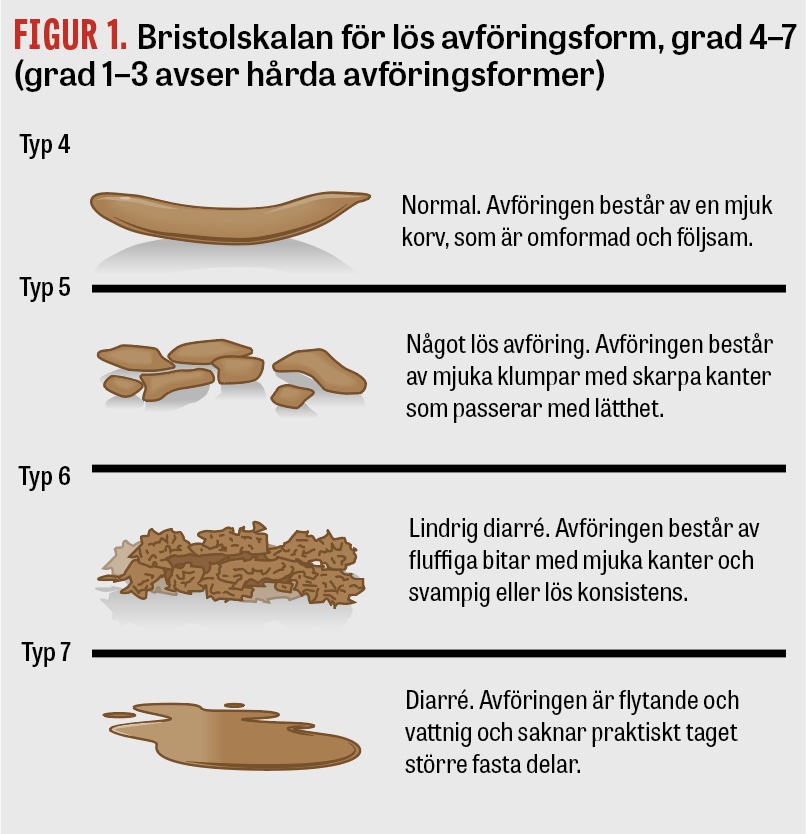
Vid behandling av patienter med svår diarré är det viktigt att stegvis öka behandlingsinsatserna. Graden av diarré uppskattas utifrån avföringens form med hjälp av Bristolskalan och avföringsfrekvensen. En avföringsdagbok under 1‒2 veckor kan hjälpa till att ge en tydlig bild av problemet. Enligt Bristolskalan [4] är i första hand avföringsformerna 6 och 7 (dvs lös eller vattnig avföring) associerade med diarré, men avföringsform 5 (»något lös avföring«) innefattas ibland i också diarrébegreppet (Figur 1).
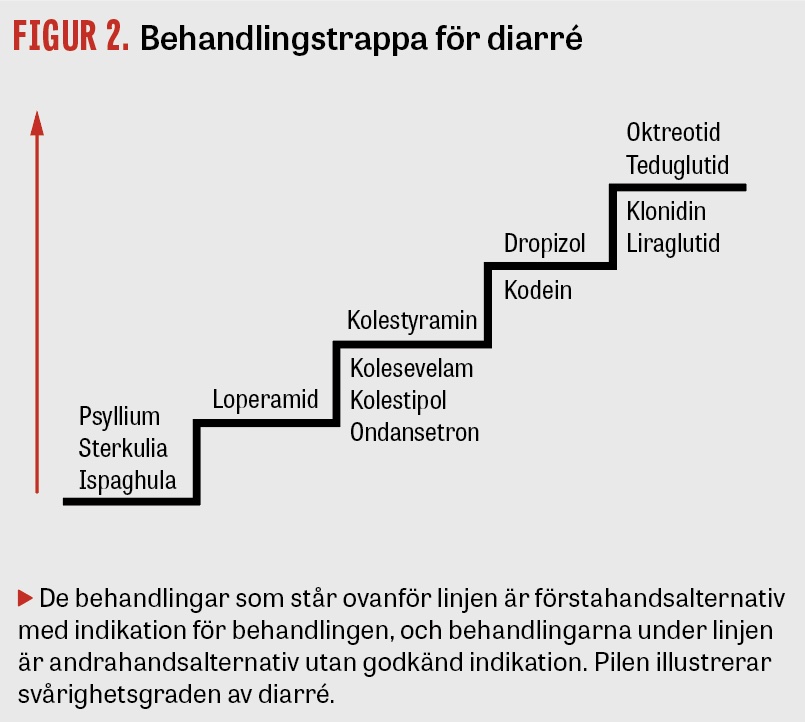
Expertgruppen har diskuterat en behandlingstrappa för diarré. Förslaget baserar sig på kunskaper och erfarenhet om diarré inom klinisk praxis och således inte på sedvanlig evidensprocess (Figur 2).
Första steget i trappan är behandling med lösliga fibrer i psyllium och ispaghula. Dessa fermenteras och bildar en viskoelastisk vattenbindande massa, som ökar transittiden och därmed också vattenabsorptionen [5]. Sterkulia är olösliga fibrer med stor förmåga att binda vatten och normalisera avföringens konsistens [6]. Behandling med dessa preparat har ett tydligt vetenskaplig stöd vid förstoppning, men svagt stöd vid kronisk diarré.
Som nästa steg i trappan används loperamid. Läkemedlet har en etablerad plats i behandlingen. Loperamid stimulerar opioidreceptorer av -typ i tarmen, vilket minskar sekretion och motilitet och medför ökad vattenabsorption [7, 8]. Substansen har en hög proteinbindningsgrad, 95 procent, och halveringstid på 9‒14 timmar. Passagen över blod‒hjärnbarriären är begränsad, och en »kick-effekt« saknas vid terapeutiska doser. Vid akut diarré doseras loperamid med 2 tabletter à 2 mg efter varje lös tömning tills acceptabel konsistens uppnås (maximal daglig dos är 16 mg). Vid långvariga diarrébesvär rekommenderas i regel att man inte inväntar en diarréepisod före ny dos, utan i stället finner en lämplig regelbunden dosering som kan motverka diarrén utan att ge förstoppning. Loperamid är mindre effektivt vid svåra former av diarré [9]. Höga doser (40‒800 mg) har visats kunna ge EKG-förändringar med förlängd QT-tid och torsade de pointes [10]. Jämfört med tablettform har loperamid i kapselform ett snabbare upptag och tydligare behandlingseffekt [11].
Gallsaltsmalabsorption utvecklas vid sjukdomar i distala ileum, efter tarmresektioner och efter bestrålning av ileum. Gallsaltsmalabsorption förekommer också efter kolecystektomi, vid patologisk tarmflora och intestinal dysmotilitet samt vid funktionell diarré och IBS-D, då sannolikt på grund av idiopatisk överproduktion av galla. Gallsaltsbindande resiner har en positiv effekt vid dessa tillstånd [12]. Kolestyramin har indikationen gallsaltsinducerad diarré. Användningen försvåras ibland av biverkningar, såsom buksmärta, illamående och dålig smak. Behandling initieras med 0,5‒1 dospåse à 4 g 1‒2 gånger dagligen och titreras sedan upp till önskad effekt. Även kolestipol har använts för behandling av gallsaltsmalabsorption. Ett nytt alternativ är kolesevelam, som har bättre gallsaltsbindande effekt och smak. Många gånger måste kolesevelam initialt ges i hög dos för att senare justeras till en lägre nivå, 3 tabletter à 625 mg 2 gånger dagligen. Ett särskilt problem med gallsaltsbindare är att de minskar biotillgängligheten av andra läkemedel och fettlösliga vitaminer. All annan medicinering bör därför tas 1 timme före eller 4 timmar efter gallsaltsbindare för att minimera interaktionsrisken. Denna effekt tycks vara mindre uttalad med kolesevelam [13].
5-HT3-receptorantagonister kan förbättra avföringens konsistens framför allt vid IBS-D, då serotonin anses ha viss betydelse för symtombilden [14]. Ondansetron har visats vara effektivt vid IBS-D i ett mindre antal studier [14-16]. Ofta räcker låga ingångsdoser på 4 mg 1‒2 gånger dagligen, som senare titreras till 4‒8 mg upp till 3 gånger dagligen för full effekt.
Vid idiopatisk diarré som inte har kunnat påverkas med dessa läkemedel kan ytterligare behandlingssteg tas. Opiumpreparat har effekter på diarré etablerade sedan 1800-talet. Från »opiumdroppar«, som tidigare kunde förskrivas som extemporeberedning, har läkemedlet Dropizol utvecklats i form av oral lösning. Läkemedlet består av flera opiumalkaloider med dämpande effekt på motilitet och sekretion [17]. Dropizol stimulerar μ-opioidreceptorer, vilket ökar transittiden genom tunntarm och kolon med ökad vätskeabsorption och minskad diarré som följd [17]. Eftersom läkemedlet distribueras över blod‒hjärnbarriären finns risk för beroendeutveckling. Någon toleransutveckling för den stoppande effekten i kolon har inte påvisats [18, 19]. Halveringstiden för ingående morfin i preparatet är 2 timmar, medan aktiva metaboliter har längre halveringstider på cirka 7 timmar. Indikationen för Dropizol är symtomatisk behandling av svår diarré hos vuxna när annan behandling inte haft önskad effekt, baserat på tidigare erfarenheter från behandling med opiumtinktur. Dropizol doseras 2,5‒5 mg, 2-3 gånger dagligen, med maxdos 60 mg dagligen.
Kodein är ett alternativ vid behandling av långvarig svår diarré, även om det inte har denna indikation. Substansen har en snabb absorption [20], passerar blod‒hjärnbarriären och påverkar opioidreceptorer både i hjärnan och tarmen med utbredd motilitetshämmande effekt [21]. Omkring 10 procent av kodein bioaktiveras till morfin med risk för en centralnervös »kick-effekt«, missbruk och beroendeutveckling. Effekten är kortvarig på grund av kodeinets korta halveringstid, 2‒3 timmar. Kodein doseras 25 eller 30 mg (dosekvivalent 6 mg loperamid) 4 gånger dagligen [21, 22].
På det översta steget i behandlingstrappan finner vi preparat som är begränsade till specialistkunskap inom området. Behandling med oktreotid bygger på en effekt med minskad sekretion av vätska och elektrolyter i jejunum och ileum [23]. Det finns indikation för behandlingen vid hormonproducerande tumörer med sekretorisk diarré. Oktreotid har också visat god behandlingseffekt vid hiv-associerad diarré [24] och mer kraftfull effekt än loperamid vid cytostatikainducerad diarré [25].
Andra mer tentativa behandlingar är liraglutid (GLP-1-receptoragonist), som har visat effekt vid korttarmssyndrom och gallsaltsinducerad diarré [26, 27]. Effekten bygger på en långsam transit genom mag‒tarmkanalen, vilket ökar absorption av vätska och elektrolyter.
Teduglutid (rekombinant GLP-2-analog) stimulerar tillväxt av tunntarmen, vilket ger ökad absorption och minskar vätske- och elektrolytförluster vid korttarmssyndrom [28].
En annan möjlighet att påverka motilitet och absorption är genom stimulering av adrenerga autoreceptorer med klonidin som α2-receptoragonist. Behandlingen har en antihypertensiv effekt, men dämpar också diarré vid IBS-D och diabetesenteropati [29, 30].
Kombinerad behandling. Genom att flera olika farmakologiska verkningsmekanismer är tillgängliga kan också olika behandlingar kombineras. Exempelvis kan grundläggande behandling med fibrer kombineras med loperamid (opioidreceptoragonist) eller ondansetron (5-HT3-receptorantagonist). På motsvarande sätt kan också kolestyramin eller kolesevelam kombineras med andra antidiarroika, som då ska tas vid olika tillfällen. Vid svår diarré kan även opioidreceptoragonister (loperamid, Dropizol) kombineras med en α2-receptoragonist (klonidin) som ett ytterligare behandlingssteg.
En bekymmersam grupp är de patienter som i livets slutskede behandlas med analgetika av opioidtyp i höga doser och där alla opioidreceptorer kan antas vara stimulerade men som trots detta har diarré. Här måste en alternativ verkningsmekanism väljas för behandlingen. Lång erfarenhet visar att ondansetron alternativt klonidin är möjliga val i sådana situationer.
Slutsatser
Den övergripande mekanismen för behandling av diarré utan känd orsak bygger på att en fördröjd transit genom mag‒tarmkanalen ökar absorption av vätska och elektrolyter. Vid lindriga tillstånd kan ofta bulkmedel vara tillräckliga. Behandling med ytterligare antidiarroika kan sedan prövas stegvis. Vid gallsaltsinducerad diarré finns en klar behandlingsindikation för gallsaltsbindande resiner. Vid diarrétillstånd utan säker orsak är en perifert verkande opioidreceptoragonist som loperamid adekvat behandling, och utöver detta kan Dropizol användas för symtomatisk behandling av svår diarré när annan behandling inte haft önskad effekt. Behandlingar därutöver är begränsade till den intresserade specialistläkaren med specifik kunskap och klinisk erfarenhet
Potentiella bindningar eller jävsförhållanden: Artikeln har sammanställts med bidrag från Pharmanovia.