Kongenital faktor XIII-brist är en ovanlig blödningsrubbning som oftast diagnostiseras i nyföddhetsperioden och medför en livslång risk för blödningar. Den behandlas med faktor XIII-koncentrat. Autoantikroppsbildning mot FXIII är mer sällsynt. Dessa tillstånd kan misstänkas vid normal APTT och PK(INR) hos en blödande patient. Autoantikroppar kan misstänkas vid nytillkommen blödningsbenägenhet hos vuxna patienter.
Den förvärvade FXIII-bristen till följd av nedsatt syntes/konsumtion är mindre väldefinierad, men kan beaktas vid allvarliga blödningar.
Kunskapen om dessa tillstånd är låg utanför koagulationscentrum. Sammanställningen belyser aktuell klinisk kunskap, diagnostik och behandling.
Koagulationsfaktor XIII (FXIII) har en undanskymd plats jämfört med andra koagulationsfaktorer, kanske på grund av att medfödd brist i sin svåra homozygota form är ovanlig. I studier av fibrinogenets omvandling till stabilt fibrin under 1940-talet påvisades en faktor, ett plasmaprotein, som isolerades och fick namnet »den fibrinstabiliserande faktorn« [1-3]. På 1960-talet fick den klinisk relevans i och med att den första patienten med svår medfödd FXIII-blödningsrubbning diagnostiserades [4], och proteinet fick då beteckningen FXIII. Med förbättrade laboratoriemetoder kunde lindrigare heterozygota, medfödda som förvärvade, FXIII-brister detekteras [5, 6]. Plasma/kryoprecipitat var initialt behandlingen vid medfödd FXIII-brist, men 1993 blev det plasmaderiverade koagulationsfaktorkoncentratet fibrogammin tillgängligt i Europa [7] och är numera registrerat som det godkända läkemedlet Cluvot. Omfattande forskning visar att FXIII är ett multifunktionellt protein av stor betydelse i en rad processer utöver blödningskontroll. FXIII har också påvisats i monocyter/makrofager, trombocyter och olika vävnadsceller [5, 8-10]. Vissa tumörceller har ökad FXIII-aktivitet med risk för tillväxt/spridning, och FXIII kan vara en prognostisk cellulär markör [11-14].
I denna översikt kommer vi att beskriva diagnostik och behandling av de sällsynta medfödda FXIII-bristerna, men också ny kunskap om de förvärvade FXIII-bristerna som kan uppstå vid antikroppsbildning och stora perioperativa/traumatiska blödningar.
FXIIIa och koagelstruktur
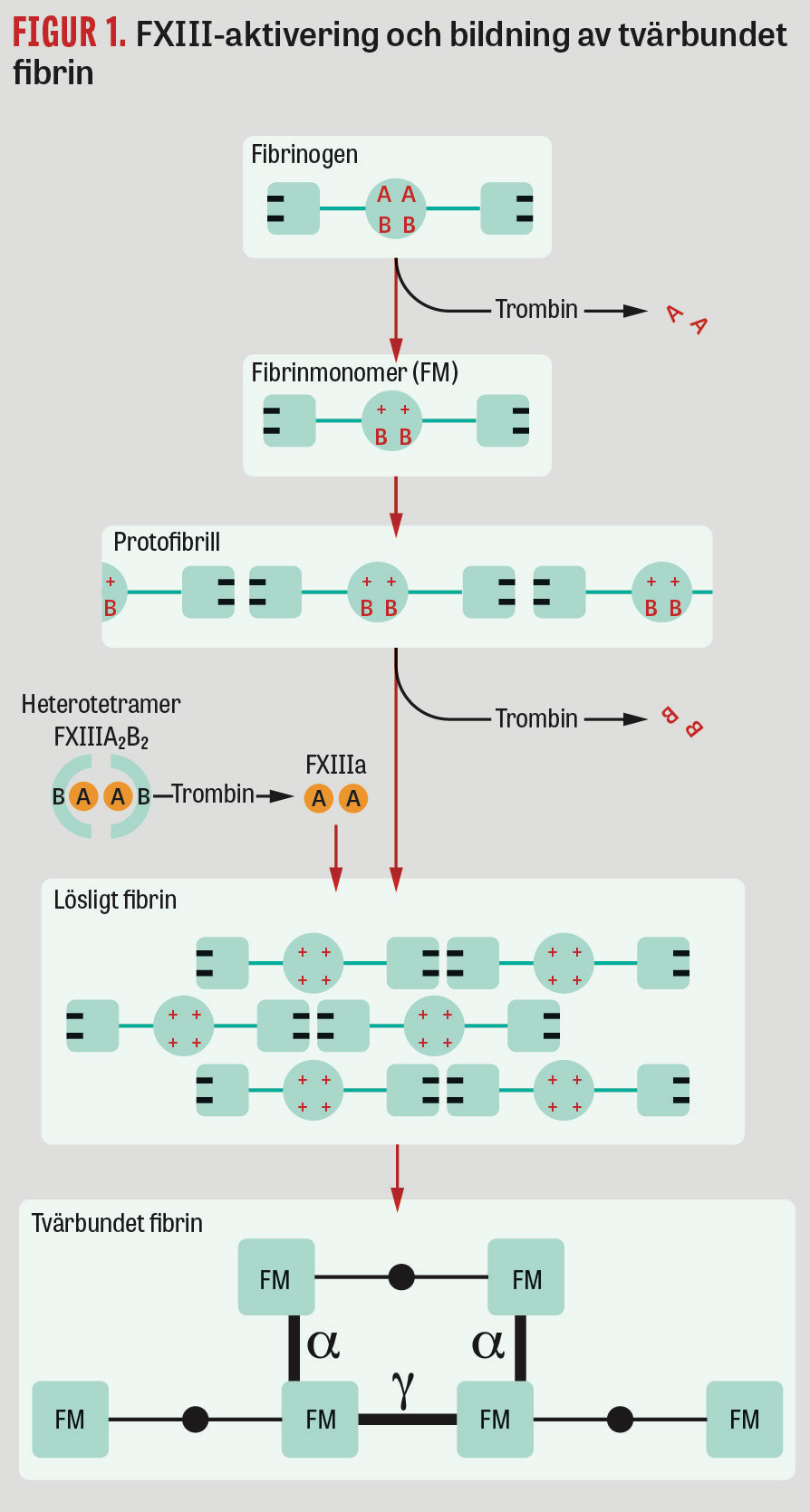
I slutskedet av fibrinogenets omvandling till fibrin bildas ett luckert tredimensionellt nätverk av fibrintrådar. Dessa består av polymeriserade löst sammansatta fibrinmonomerer, så kallat lösligt fibrin (Figur 1). Trombinkoncentrationen i plasma påverkar hur tätt fibrintrådarna vävs och deras tjocklek, vilket har betydelse för blödnings- och trombosrisker [15].
FXIII består av 2 subenheter i dimerform: FXIIIA2 från megakaryocyter i benmärgen och FXIIIB2 från hepatocyter i levern. De senare fungerar som ett FXIIIA2-skyddande bärarprotein i cirkulationen och utsöndras i mycket högre koncentration än FXIIIA2, och det finns därför alltid fritt cirkulerande (ca 50 procent) (Figur 1). Tillsammans bildar de en stabil plasmakoagulationsfaktor, heterotetrameren FXIIIA2B2, som är inaktiv i cirkulationen och då bunden via gammakedjor till fibrinogen [5]. Efter aktivering av trombin och polymeriserat fibrin lösgörs FXIIIA2 från sitt bärarprotein, aktiveras till FXIIIa och binds snabbt till fibrinnätverket genom så kallad tvärbindning (cross-linking) [5].
FXIIIa bildar 2 olika typer av tvärbindningar omkring lösligt fibrin: tidiga gamma‒gamma-horisontella och lite senare alfa‒alfa-transversella. De senare gör att fibrinnätet blir mer mekaniskt hållfast och resistent mot fibrinolys (Figur 1) [16]. FXIIIa binder också plasminhämmare och trombininducerad fibrinolyshämmare samt trombocyter, erytrocyter, trombomodulin, fibronektin, kollagen, faktor V och von Willebrand-faktor, som förstärker koaglet [17, 18]. Ny kunskap om FXIII tillkommer hela tiden [19-21], och det finns sannolikt FXIIIa-hämmande mekanismer som motverkar tromboembolism [22].
Ett stort antal mutationer finns beskrivna, de flesta i FXIIIA-genen, som producerar FXIIIA2 och orsakar den kongenitala FXIII-bristen. Mutationer i FXIIIB-genen minskar plasmanivån av FXIIIB2 och därigenom FXIIIA2B2, vilket kan påverka koagelstrukturen [23]. Det finns också mutationer som ökar FXIII-aktiviteten, med oklar betydelse för venös och arteriell tromboembolism [24, 25].
Laboratoriediagnostik
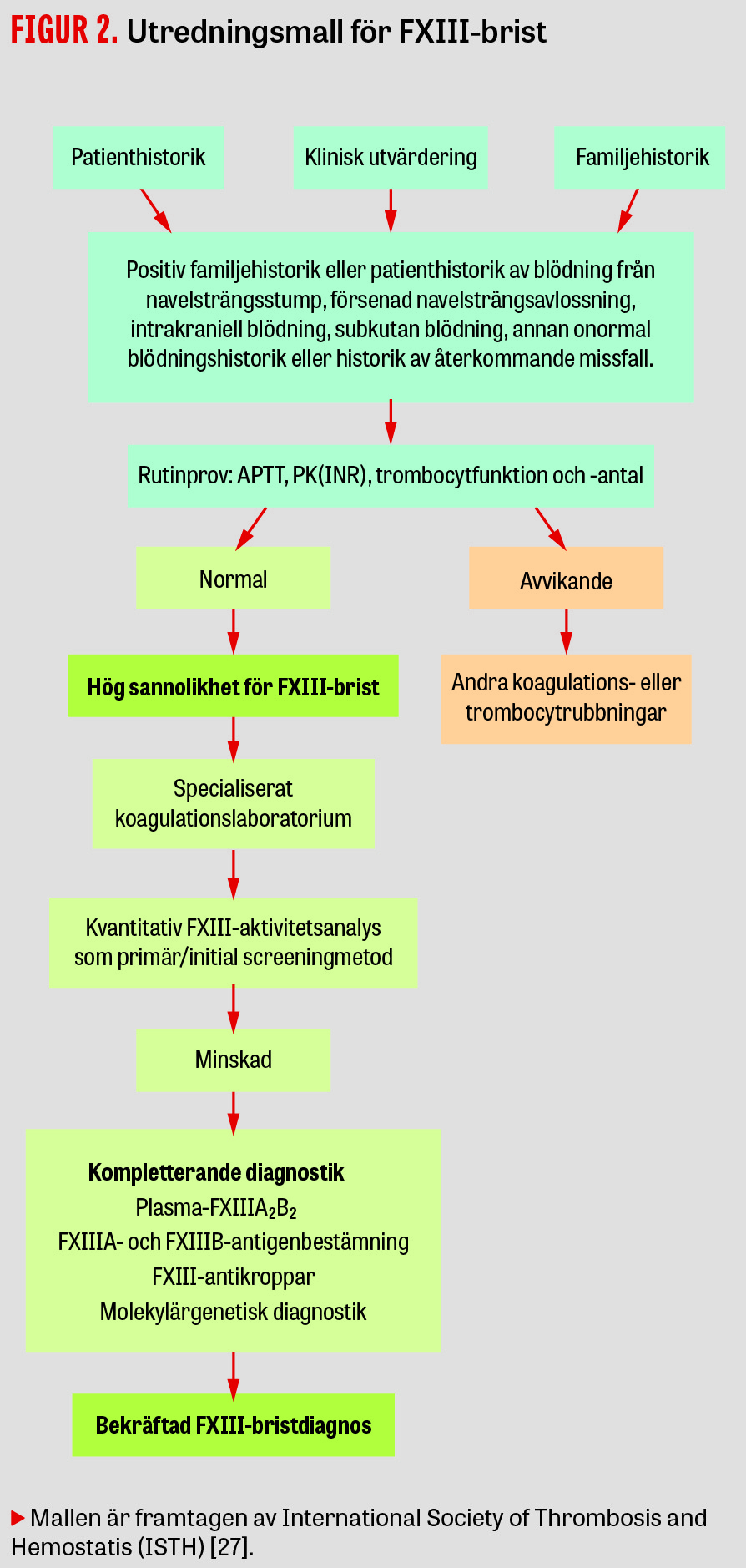
Screeninganalyserna för koagulationsrubbning, APTT (aktiverad partiell tromboplastintid) och PK(INR) (protrombinkomplex, internationell normaliserad kvot), kan inte påvisa FXIII-brist. Vid normala screeninganalyser och signifikant blödningsanamnes kan FXIII-brist föreligga. Det tidigare förstahandsvalet, löslighetstest (clot solubility test), var dåligt standardiserat och enbart känsligt för svår (total) FXIII-brist <0,05 kIE/l, som motsvarar <5 procent av normal aktivitet (referensintervall ca 0,7‒1,4 kIE/l) [26], vilket har bidragit till underdiagnostik. Numera rekommenderas användning av kvantitativa funktionella och specifika aktivitetsmetoder vid laboratoriediagnostik av ärftlig FXIII-brist [27, 28]. Den vanligaste automatiserade metoden är ett fotometriskt ammoniakfrisättningstest, men det finns också antigenmetoder, så kallad lateximmunanalys (LIA-test), för bestämning av plasmaproteinkoncentration. FXIII-analys finns på laboratorierna i anslutning till koagulationsmottagningarna i Malmö, Göteborg och Stockholm och utförs på citratplasmaprov.
Aktivitetsmetoden har sämre känslighet i det låga området (<0,2 kIE/l) och kan visa ökad aktivitet vid FXIII-nivåer som är lägre än 0,05‒0,1 kIE/l [27]. Detta är ett problem vid diagnostik av svår kongenital FXIII-brist och vid monitorering av förebyggande behandling med faktorkoncentrat. Därför utförs ibland kompletterande diagnostik enligt den mall som ISTH (International Society of Thrombosis and Hemostasis) förordar vid stark misstanke om kongenital FXIII-brist eller FXIII-antikroppar (Figur 2) [27]. Om den kvantitativa FXIII-metoden visar tecken på brist rekommenderas antigenmätning, eventuellt autoantikroppsbestämning och genetisk mutationsdiagnostik.
Viskoelastiska koagulationsmetoder, som tromboelastografi (TEG) och tromboelastometri (ROTEM), har fått stor spridning inom traumatologi, intensivvård och toraxkirurgi. TEG användes i samband med diagnostiken av det första kliniska fallet av svår kongenital brist och indikerade svag koagelstyrka och tidig upplösning av koaglet, det vill säga ökad fibrinolys [29]. Båda koagulationsdefekterna reverserades med FXIII-koncentrat [4]. Koagulationsstörningarna är multifaktoriella vid förvärvade FXIII-brister, vilka kan uppkomma exempelvis intraoperativt eller vid trauma. ROTEM/TEG påverkas då mer av fibrinogennivåer och trombocytantal och blir ospecifika för detektion av FXIII-brist [30]. Plasmakoncentrationen av fibrinogen är dessutom 2‒4 g/l, jämfört med FXIII på omkring 30 mg/l. I avsaknad av FXIII-aktivitetsanalys kan dessa metoder ändå ge en viss vägledning.
Raspé et al fann en korrelation på 0,77 mellan fibrinogen och FXIII-aktivitet postoperativt efter hjärtkirurgi och föreslog en logistik för FXIII-koncentratbehandling utifrån lågt fibrinogen i första hand och låg maximal koagelstyrka (med metoden ROTEM-FIBTEM-MCF) i andra hand; korrelationen till FXIII var 0,57 [31]. Låga värden på postoperativ ROTEM-EXTEM-MCF efter icke hjärt- eller transplantationskirurgi hos 272 patienter sågs oftare hos dem med FXIII-aktivitet <0,7 kIE/l [32]. I studierna korrelerade låg FXIII-aktivitet och/eller låg koagelstyrka med ökat transfusionsbehov. En synergieffekt har påvisats med ROTEM vid tillsatsförsök av FXIII- och fibrinogenkoncentrat både efter in vitro-dilution [33], vid uppkomna koagulopatier efter hjärt- och skolioskirurgi [34] och efter trauma [35].
Kongenitala FXIII-brister
Medfödd FXIII-brist har en autosomalt recessiv ärftlighetsgång. Homozygoti (eller kombinerad heterozygoti), som ger den svåra formen med FXIII-aktivitet <0,05 kIE/l [36], är ovanlig med en prevalens på omkring 1‒2/miljoner invånare (något högre i områden där ingiften är vanliga). Mer än 100 mutationer i FXIIIA1-genen, som orsakar bristen i subenheten FXIIIA2, har registrerats i HGMD (Human gene mutation database). I Sverige finns färre än 10 personer diagnostiserade med denna svårighetsgrad. Det klassiska symtomet vid svår form är navelstumpsblödning, som inträffar i 80 procent av fallen och uppträder någon vecka efter förlossningen på grund av den relativt långa halveringstid som moderns FXIII har [37]. Intrakraniella blödningar och muskelblödningar efter lindriga trauman, anmärkningsvärda blåmärken, slemhinneblödningar och långdragna blödningar är andra tecken på FXIII-brist. FXIII-brist har högst mortalitet bland de kongenitala blödningsrubbningarna [38]. Fördröjd sårläkning och onormal ärrbildning har beskrivits vid FXIII-brist [39]. Spontanabort i första trimestern förekommer med hög frekvens utan profylax (av 136 graviditeter resulterade 124 i missfall) [40, 41]. FXIII-brist leder till en dålig utveckling av cytotrofoblastskalet, vilket medför en försämrad nidation.
Vid heterozygota anlag ligger FXIII-aktiviteten oftast omkring 0,5 kIE/l. Här förekommer som regel blödningsbenägenhet bara vid fysiskt trauma (beroende på vilken mutation) [42-44].
Faktorkoncentratbehandling vid kongenitala brister
Vid svår form av FXIII-brist startas profylax med FXIII-koncentrat i 1-årsåldern på grund av hög risk för intrakraniella blödningar under barnaåren. I Sverige anpassas profylaxdosens storlek och intervall efter individuell testning av FXIII-dalvärdesaktiviteten och klinik. Det i Sverige registrerade plasmabaserade FXIII-koncentratet Cluvot (CSL Behring) har en medelhalveringstid på 6,6 dagar hos patienter med svår FXIII-brist. Oftast ges 35‒40 IE/kg kroppsvikt var 4:e vecka med dalvärden på 0,1‒0,2 kIE/l [44-46]. Vid avsaknad av FXIII-koncentrat kan virusinaktiverad plasma (Octaplas) som innehåller upp till ca 1 IE FXIII/ml övervägas, framför allt till mindre barn.
Patienter med svår form av FXIII-brist handläggs vid någon av koagulationsenheterna i Stockholm, Göteborg eller Malmö, och de anmäls till det internationella FXIII-bristregistret (http://dx.doi.org/10.1160/TH07-01-0034) [46] och registret för sällsynta blödningar (RBDD) [47]. Fakta 1 sammanfattar dosrekommendationer i samband med kirurgi, trauma och obstetrik. FXIII-behandling vid dessa tillstånd ska alltid ske i samarbete med koagulationsspecialist.
Utvecklingen av alloantikroppar mot plasmabaserade FXIII-koncentrat är sällsynt [50], enligt Solomon et al som undersökte säkerheten vid långvarig användning av fibrogammin (Corifact) [7]. Under 20 år rapporterades totalt 75 fall med alloantikroppsutveckling, motsvarande 1 fall/15 700 standarddoser (20 IE/kg för en 70 kg patient).
Ett rekombinant FXIIIa-koncentrat från Novo Nordisk är godkänt av den europeiska läkemedelsmyndigheten EMA och har studerats vid profylax/kirurgi på patienter med medfödd brist [51] och även på barn <6 år [52]. Utveckling av antikroppar verkar vara mer sällsynt. Detta koncentrat är inte tillgängligt i Sverige, enligt Fass.
I Fakta 2 ges ett exempel på symtomatologin vid svår kongenital FXIII-brist och den komplexitet som diagnostik och behandling kan innebära.
Autoantikroppsbildning mot FXIII – en utmaning
De diagnostiserade fallen med autoantikroppar mot FXIII i Sverige är ännu färre än de med svår form av medfödd FXIII-brist. Patienter med autoantikroppar mot koagulationsfaktorer har inte sällan andra typer av autoantikroppar, som vid systemisk lupus erythematosus och reumatoid artrit. Vissa typer av läkemedel, såsom isoniazid, prokainamid, valproat, fenytoin och penicillin, är associerade med autoantikroppsutveckling.
Autoantikroppar mot en koagulationsfaktor kan misstänkas vid nytillkommen blödningsbenägenhet hos en vuxen patient. Utredningen kan vara komplex (se Figur 2) [28, 53, 54]. För att eliminera autoantikroppar mot koagulationsfaktorer används numera ofta anti-CD20-antikroppsläkemedel (rituximab). Tone et al fann 2016 vid en systematisk genomgång av litteraturen 63 patienter med behandling mot verifierade autoantikroppar [55]. Hos 25 av 55 patienter (45 procent) rapporterades att antikropparna försvann helt efter eradikeringsterapi; 15 patienter (27 procent) hade partiell resolution och 9 av dessa (14 procent) fick återfall. 13 patienter (20 procent) dog, varav 7 på grund av interna blödningar. 2017 redovisade Ichinose et al 93 patienter med FXIII-autoantikroppar, där flertalet (50‒68 procent) uppnådde bestående eradikering av antikropparna och resten hade återkommande eller kvarvarande autoantikroppar trots immunbehandling, med hög morbiditet/mortalitet [53].
Förvärvade FXIII-brister
Förvärvad FXIII-brist med sänkt FXIII-aktivitet till 0,2‒0,7 kIE/l har rapporterats vid flera tillstånd. Vid perioperativ FXIII-brist löses koagler upp för tidigt, oftast inom 24‒36 timmar efter operationen, och misstanken om en förvärvad FXIII-brist är troligen inte stark.
Flera studier visar att FXIII-nivåerna är sänkta redan på skadeplats och fortsätter att sjunka vid ankomsten till akutavdelningen. Både akut traumakoagulopati (konsumtion) och dilution på grund av initial vätsketerapi kan orsaka sänkningen [57, 58]. Användningen av FXIII-koncentrat vid FXIII-värden lägre än 60 procent av det normala resulterade i en kortare vistelse på intensivvårdsavdelning, minskad risk för organdysfunktion samt minskad mortalitet [59, 60].
Det finns många studier som har visat sänkt FXIII-aktivitet vid olika typer av kirurgi. Gerlach et al studerade 876 neurokirurgiska patienter (totalt 910 elektiva operationer) och såg en ökad risk för postoperativa hematom vid sänkt FXIII-aktivitet (<60 procent av den normala; n = 39), vilket förstärktes av låga trombocyt- och fibrinogennivåer [61]. I en annan studie hade 8 av 34 neurokirurgiska patienter en signifikant högre risk för postoperativ blödning vid FXIII-aktivitet <60 procent av den normala [62]. Patienterna hade testats retrospektivt vid klinisk misstanke om FXIII-brist efter normala rutinkoagulationsprov (FXIII-provtagning på 34 av 1 264 patienter). Ytterligare 3 publikationer indikerar ökad risk för postoperativa hematom vid sänkt FXIII-aktivitet [63-65]. Vid kroniska spontana subduralhematom, speciellt recidiverande, har sänkt FXIII-aktivitet rapporterats, med större risk ju lägre aktiviteten är [66]. Även vid traumatiska intracerebrala blödningar kan FXIII-aktiviteten ha betydelse för progressionen och det neurologiska utfallet [67].
Sedan tidigare är det känt att FXIII-nivåerna sjunker under pågående hjärt‒lungmaskinkirurgi. Gödje et al använde sig av FXIII-koncentrat i en randomiserad placebokontrollerad studie vid elektiv kardiopulmonell bypass (n = 75). Det fanns ingen skillnad i blödning mellan grupperna, men vid subgruppsanalys sågs en signifikant mindre blodförlust hos patienter med FXIII-värden <70 procent av den normala [68]. Den enda stora perioperativa randomiserade kontrollerade studien av FXIII-koncentrat är den av Karkouti et al på 409 hjärt‒lungmaskinopererade patienter; rekombinant FXIIIA-koncentrat hade ingen effekt på transfusionsbehov och reoperationsfrekvens, troligtvis för att blödningarna var små med utebliven FXIII-brist [69]. I behandlingsgruppen sågs FXIII-aktivitet upp mot 1,4 kIE/l jämfört med 0,8 kIE/l i placebogruppen, det vill säga inom normalområdet, vilket troligtvis var onödigt höga nivåer. Liknande fynd sågs nyligen i en FXIII-substitutionsstudie på traumapatienter [70].
En Cochraneöversikt stöder inte användningen av FXIII-koncentrat i samband med kirurgi, baserat på 7 behandlingsstudier [71].
European Society of Anaesthesiology (ESA) föreslår ändå en behandling med 30 IE/kg FXIII-koncentrat vid FXIII-nivåer <0,3 kIE/l i samband med blödning och kirurgi [30]. En nyligen publicerad översiktsartikel ger rekommendationer kring behandling av förvärvade FXIII-defekter [72].
Vi har sökt i Socialstyrelsens statistikdatabas (tillgängliga data från 2021), och FXIII-koncentrat har bara givits till patienter med kongenitala FXIII-bristsymtom.
Konklusion
Ärftlig och förvärvad FXIII-brist är ovanlig, men kan övervägas vid utredning av blödningsbenägenhet då screeningproven PK(INR) och APTT utfaller normala. Prov kan skickas till koagulationslaboratorium.
Vid allvarlig behandlingsresistent blödning i samband med kirurgi eller trauma kan FXIII-koncentrat behöva ges efter kontakt med koagulationsspecialist. Viskoelastisk mätning kan då indikera svag koagelstyrka och ökad fibrinolys. Om inte FXIII-koncentrat finns tillgängligt kan behandlingen börja med plasma, vilket är kutym med så kallade initiala transfusionspaket med erytrocytkoncentrat, plasma och trombocytkoncentrat. Patienter med allvarligt trauma bör hanteras utifrån koncepten ATLS (advanced trauma life support) och skademinimering (damage control), och transport till sekundär-/tertiärcentrum bör övervägas. Vid fortsatt blödning och misstänkt koagulopati vid adekvat kirurgi samt tillägg med tranexamsyra, fibrinogenkoncentrat och protrombinkomplexkoncentrat kan FXIII-brist föreligga, och akuttransport av FXIII-koncentrat kan behöva beställas om patienten inte är transportabel. Doserna bör ligga på 30‒50 IE/kg × 2 eller flera.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. FXIII-dosrekommendationer för kongenitala defekter
- I händelse av akut svår skada kan man överväga att ge en dos FXIII-koncentrat. Koagulationsjouren, som ordinerar FXIII-koncentrat, ska kontaktas snarast; på blödningsriskkortet som patienten bär med sig framgår telefonnumret till den koagulationsenhet som handlägger patientens faktorbrist. Om FXIII-koncentrat saknas kan plasma övervägas inför/under transport till närmaste sjukhus med FXIII-koncentrat (patienten vet oftast detta), och sedan vidare transport till universitetssjukhus. Defekt FXIII-aktivitet ger också ökad fibrinolys, varför tranexamsyra intravenöst rekommenderas.
- FXIII-koncentratbehandling vid trauma/kirurgi individualiseras enligt rutiner kring olika typer av kirurgi, oftast tillsammans med tranexamsyra. Naderi et al rapporterade extra behandlingsdoser (fibrogammin) med god effekt hos 162 patienter inför elektiv kirurgi: 10 IE/kg vid små operationer, 30 IE/kg vid större och 50 IE/kg vid neurokirurgi [48]. Vid små operationer gavs en dos preoperativt och vid större operationer och neurokirurgi gavs 1 dos pre- och 1 dos postoperativt, samt ytterligare doser beroende på blödning och kirurgins svårighetsgrad, för att bibehålla en FXIII-dalvärdesaktivitet på 0,5–1,0 kIE/l, vilket verkar vara optimalt perioperativt och vid trauma.
- Till patienter som ska genomgå hjärtkirurgi ges extradoser postoperativt för att motverka den utspädning av FXIII som uppstår vid hjärt–lungmaskinkirurgi [49].
- Under graviditeten ges profylaxdoser i 2 veckors intervall med eftersträvade dalvärden på >0,1 kIE/l; under förlossningen bör FXIII-aktiviteten överstiga 0,3 kIE/l och vid kejsarsnitt 0,5 kIE/l [41, 44].
Fakta 2. En svensk patient med kongenital brist
- Kvinna, 42 år, utan hereditet för blödningssjukdom.
- Hon vårdades vid 14 dagars ålder för navelsträngsblödning, som slutade först efter blodtransfusion (30 ml). I det fortsatta förloppet var hematombenägenheten ökad, men rutinprov och blödningstid var normala.
- Vid drygt 2 års ålder fick hon en blödning på höger stortå som inte ville stanna efter att en liten flaska fallit på foten. Akut utredning på koagulationslaboratoriet i Malmö påvisade en svår FXIII-brist – i övrigt normala faktornivåer. Man avstod från förebyggande FXIII-substitution på grund av oro för blodsmitta. I stället ordinerades plasma vid behov.
- Vid ca 5 års ålder diagnostiserades, i samband med huvudvärk och övre luftvägssymtom, en intracerebral blödning (ICH) frontalt med ödem, som visade sig vara ett likvifierat hematom med färskt inslag. Hon behandlades med plasmarenat faktorkoncentrat innehållande FXIII. Efter några doser utvecklades dock neutraliserande alloantikroppar, som förhindrade fortsatt substitution.
- Under de kommande åren skedde episoder med intraabdominella och intramuskulära blödningar – spontana eller efter lindrigt trauma – som på grund av låg antikroppstiter initialt kunde behandlas med FXIII i form av faktorkoncentrat eller plasma i kombination med immunsuppression. Dock komplicerades bilden ytterligare av anafylaktiska reaktioner mot FXIII trots immunsuppression.
- Vid ca 14 års ålder inträffade en spontan episod av ICH i capsula interna med medvetandepåverkan och högersidig svaghet. Patienten erhöll färskfrusen plasma, intravenöst immunglobulin, steroider samt cyklofosfamid. Symtomen gick i regress efter rehabiliteringsinsatser.
- Vid 21 års ålder inträffade en tredje episod av ICH med DT-mässiga tecken på både äldre och färskt blödningsinslag, denna gång med kranialnervssymtom och partiella epileptiska kramper. I efterförloppet genomfördes trots anafylaxi en immuntoleransbehandling med FXIII-preparat (fibrogammin) och multipel immunsuppression enligt Malmömodellen [56]. Tolerans utvecklades inte, men de allergiska symtomen klingade av och patienten kunde därefter erhålla profylaktisk behandling med fibrogammin ca 1–2 gånger per vecka.
- Vid ca 40 års ålder hade patienten graviditetsönskemål, och för att minimera antikroppsnivåerna och möjliggöra detta gjordes behandlingsförsök med rituximab. Antikroppsnivåerna minskade, och med oförändrad substitutionsbehandling (Cluvot) erhölls lägstanivåer mellan 30 och 40 procent. Ett år senare var patienten gravid och födde sedermera komplikationsfritt en liten frisk flicka via kejsarsnitt.