Neuroradiologisk DT och MR utförs rutinmässigt på gravida, efter att remisserna bedömts ur ett berättigandeperspektiv.
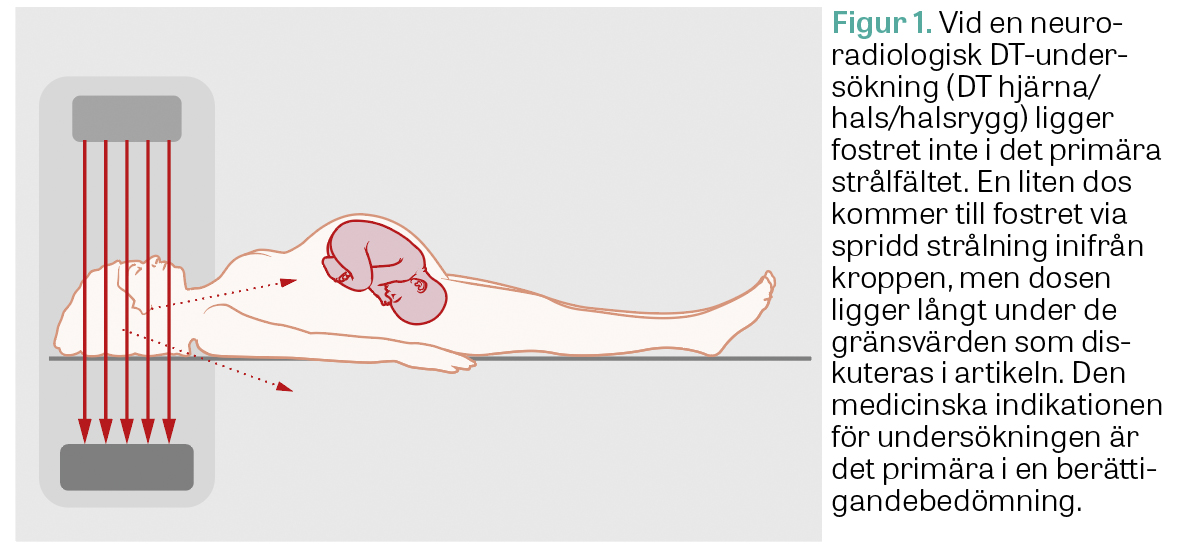
Vid neuroradiologisk DT (hjärna/hals/halsrygg) ligger fostret inte i det primära strålfältet, och dosen som når fostret via spridd strålning ligger långt under signifikanta gränsvärden.
MR utan kontrastmedel under graviditet har inga påvisade risker, men låg energideposition bör eftersträvas vid planering av undersökningen.
Jodkontrastmedel kan användas hos gravida om det föreligger en tydlig medicinsk indikation, men gadoliniumkontrastmedel bör undvikas i möjligaste mån.
Amning kan fortsätta som vanligt efter att jod- eller gadoliniumkontrastmedel har givits.
Många kvinnor är gravida under flera procent av sina liv. Sjukdom kan inträffa i olika livsskeden, även under graviditeten, och de flesta har då av naturliga skäl en ökad hälsomedvetenhet. Ibland behövs radiologisk diagnostik under graviditet eller amning, trots eventuell oro för strålning och andra potentiella risker. Återkommande ser vi i vårt arbete som radiologer att gravida undanhålls medicinskt berättigade undersökningar, ibland på grund av okunskap eller en skev bedömning av undersökningens risker. Osäkerheten ligger inte bara hos patienterna utan även hos många remittenter och radiologer. En sannolik orsak till att många läkare är osäkra kan vara att den nödvändiga informationen har funnits utspridd mellan olika källor och därmed varit svår att överblicka. Denna artikel syftar till att samla informationen och göra den tillgänglig. Det kan också vara svårt att värdera risker med stråldoser eftersom det kräver vissa förkunskaper, och det finns inte sällan en psykologisk drivkraft för att minimera risker för fostret, vilket kan utgöra en målkonflikt gentemot den gravida patientens hälsa.
Vi som författat den här artikeln arbetar på olika sätt med radiologi och representerar bland annat Svensk förening för neuroradiologi (SFNR), Svenska alliansen för magnetkamerasäkerhet (SAMS) och kontrastmedelsgruppen inom Svensk förening för medicinsk radiologi (SFMR). Syftet är att öka kunskapen om dessa frågor bland läkare och att bidra till att gravida och ammande som har behov av neuroradiologisk diagnostik får en korrekt och berättigad undersökning.
Artikeln fokuserar på neuroradiologisk diagnostik med datortomografi (DT) och magnetkameraundersökning (MR). DT utsätter patienter för joniserande strålning, vilket MR inte gör. Dessutom används olika sorters kontrastmedel (KM); vid DT används jodkontrastmedel (jod-KM) och vid MR används (primärt) gadoliniumkontrastmedel (Gd-KM). Förutsättningarna för att ge kontrastmedel vid graviditet och amning beskrivs nedan. Positronemissionstomografi (PET) samt hantering av överkänslighetsreaktioner nämns kortfattat. Radiologisk intervention och konventionell angiografi diskuteras inte här, utan blir föremål för individuell bedömning.
Akuta neurologiska sjukdomar är relativt ovanliga hos gravida, men allvarliga tillstånd förekommer (ibland associerade med preeklampsi eller eklampsi), såsom intrakraniella blödningar, ischemisk stroke, sinustrombos, PRES (posteriort reversibelt encefalopatisyndrom) och RCVS (reversibelt cerebralt vasokonstriktiossyndrom). Dessa är förknippade med hög morbiditet och mortalitet. Dessutom finns en liten men inte oväsentlig grupp patienter med inflammation, infektion eller malignitet i hjärna och ryggmärg.
I klinisk neuroradiologi utförs både DT och MR på gravida rutinmässigt, men varje remiss för bild- och funktionsdiagnostik ska bedömas ur ett berättigandeperspektiv [1, 2], vilket innebär att undersökningens risker och nackdelar vägs mot den medicinska nyttan. I bedömningen ska sannolikheten för positivt fynd, potentiell påverkan på behandling och den misstänkta sjukdomens allvarlighetsgrad övervägas. Att välja rätt modalitet är viktigt, och radiologen ansvarar för detta. Val mellan DT och MR görs på individuell basis beroende på klinisk frågeställning och tillgänglighet. Förstahandsmetod är vanligtvis densamma för gravida som för icke-gravida. Strokelarm genomförs enligt standardrutin för gravida, och både trombolys och trombektomi kan bli aktuella efter individuell bedömning. Vid all användning av kontrastmedel hos gravida och ammande patienter ska anvisningarna i Fass följas för respektive kontrastmedel.
Datortomografi – stråldos
Stråldosen kan variera mycket beroende på val av utrustning, undersökningsprotokoll och sjukhus. För en DT hjärna utan KM kan den effektiva stråldosen till patienten vara cirka 1–3 mSv [3]; ett typexempel kan vara 1,8 mSv (CTDIvol 45 mGy) (förkortningar, se Fakta 1). En viktig generell aspekt vid radiologisk strålhygien är att inte bestråla en större del av kroppen än nödvändigt, vilket är ännu mer angeläget hos gravida.
Fostret måste dock ligga direkt i strålfältet för att erhålla en så pass hög stråldos att det får konsekvenser för berättigandebedömningen. Det är också bara när fostret ligger direkt i strålfältet som ett löst blyskydd kan påverka fosterdosen – när andra delar av den gravida patienten avbildas kommer hela dosen till fostret via spridd strålning inifrån kroppen (Figur 1). Om fostret skulle ligga i strålfältet skulle ett blyskydd täcka för den anatomi som efterfrågas. Således är det aldrig motiverat ur ett strålsäkerhetsperspektiv att täcka en gravid patient med lösa blyskydd.
Fostrets känslighet för joniserande strålning är starkt beroende av dess ålder [4]. Dagens kliniska stråldoser ligger betydligt under tröskeln för deterministiska stråleffekter. Spontanabort vid mycket hög strålbelastning är tänkbar – framför allt före implantation – men kliniskt osannolik eftersom så stora doser normalt inte uppnås. Mellan 3 och 8 veckor efter befruktning finns snarare en risk för organmissbildningar –dock först när fostret fått en absorberad dos över ca 100 mGy, vilket skulle motsvara att modern genomgår flera tusen DT hjärna. Det innebär att organmissbildningar inte kan förväntas uppstå vid enstaka undersökningar. Risk för påverkan på centrala nervsystemet och därmed den mentala utvecklingen kräver en liknande tröskeldos (ca 100 mGy) i perioden 8–25 veckor efter befruktning [4]. Vid sedvanliga neuroradiologiska undersökningar (inklusive PET) kommer stråldosen till fostret sammanfattningsvis att ligga klart under gränsen för fosterskada och bör inte påverka ett eventuellt beslut om att avbryta graviditeten.
Under hela graviditeten finns en potentiellt ökad risk för barncancer och leukemi som en följd av joniserande strålning. Risken är ca 0,06 procent per 10 mGy, vilket motsvarar 1 cancerfall per 1 700 barn som har exponerats för en sådan stråldos in utero [4]. En DT hjärna ger enligt exemplet ovan en fosterdos på cirka 0,02 mGy [5]. Den motsvarar således 0,2 procent av den dos på 10 mGy som nämns ovan och ligger under det tidigare nämnda tröskelvärdet om 100 mGy med en faktor på 5 000.
En DT halsrygg (CTDIvol 9 mGy) ger den gravida patienten en stråldos som motsvarar en effektiv dos på ca 2,5 mSv – fosterdosen är ca 0,05 mGy [5]. Anledningen till att effektiv dos och fosterdos inte är proportionella mot patientens dos är att en annan kroppsdel, som ligger närmare fostret, undersöks (se Fakta 1). Stråldosen för DT-angiografi av halskärlen kan variera. Med ett CTDIvol på 13 mGy, vilket kan anses relativt högt, erhåller patienten en effektiv dos på ca 7 mSv. Fosterdosen är då ca 0,15 mGy [5]. Stråldosen är i princip densamma oavsett trimester vid dessa undersökningar.
Kontrastmedel vid datortomografi
Jodkontrastmedel (jod-KM) kan passera över placentabarriären, men det föreligger inga hållpunkter för mutagena eller teratogena effekter hos människa. I brist på kontrollerade studier av effekter på foster bör dock undersökning med jod-KM endast användas vid en tydlig medicinsk indikation, i enlighet med försiktighetsprincipen.
När jod-KM ges till en patient med normalt fungerande sköldkörtel orsakas en tillfällig nedreglering av tyreoideahormonproduktionen, vilken normaliseras efter några dagar. Hos den gravida kvinnan passerar både kontrastmedel och fritt jodid över placentabarriären. Från och med andra trimestern blir den fetala tyreoidea aktiv och känslig för variationer i jodkoncentration. Vid höga jodnivåer löper den omogna sköldkörteln hos fostret viss risk att stanna i det nedreglerade läget, vilket kan leda till hypotyreos. I retrospektiva studier där den gravida kvinnan givits intravenöst jodkontrastmedel i samband med datortomografi var dock risken för hypotyreos hos barnen påtagligt låg (0,6 procent) [6]. Nyfödda barn som exponerats för jodkontrastmedel intrauterint behöver därför ingen ytterligare kontroll utöver den neonatala screeningen som görs under första levnadsveckan för att säkerställa att barnet inte utvecklat hypotyreos. Undantag finns dock för prematura barn, vilka bör kontrolleras igen efter ytterligare en vecka [6].
Beträffande gravida med tyreoideasjukdom som ska erhålla jodkontrastmedel bör man vara medveten om risken för tyreoideapåverkan hos modern med sekundär påverkan på fostret. Tyreoideaprov bör kontrolleras noggrant, och konsultation med endokrinolog kan vid behov övervägas [6].
Magnetkameraundersökning
Det är välkänt att MR, till skillnad från DT, inte utsätter patienten för joniserande strålning, och därför är metoden ett bra och viktigt alternativ för alla patienter där joniserande strålning bör undvikas. Det finns dock andra sorters påverkan på patienten vid MR, som i vissa situationer kan spela roll.
De faktorer som kan påverka kroppens vävnader vid en MR-undersökning är det statiska magnetfältet, de snabbt varierande magnetfälten (gradienterna), det buller som dessa genererar samt tillförsel av energi genom de radiovågspulser som används. Det har gjorts retrospektiva studier på barn som genomgått intrauterin MR-exponering, och dessa har inte kunnat visa några negativa effekter i form av ökad frekvens av missbildningar, påverkad födelsevikt eller hörselpåverkan. Mest erfarenhet finns från 1,5 tesla (T), som använts mest i rutinsjukvård, men undersökning av gravida med 3 T har på senare tid blivit allt vanligare. Undersökning med högre fältstyrka är ofta att föredra med neuroradiologiska frågeställningar hos ickegravida, eftersom signal-till-brus-förhållandet ökar med fältstyrkan (dock kan vissa artefakter också öka). En högre fältstyrka är dock associerad med en högre resonansfrekvens, vilket gör att man snabbare kommer upp i högre nivåer av tillförd energi vid undersökningen. Av den anledningen kan 1,5 T ibland vara att föredra, och gravida bör undersökas i »normal operating mode« (max SAR [specifik absorptionsnivå] helkropp 2,0 W/kg, huvud 3,2 W/kg) för att minska uppvärmningen. Som tidigare nämnts finns dock inga identifierade hälsorisker associerade med MR-undersökning utan kontrastmedel under graviditet, oavsett graviditetslängd och fältstyrka (upp till och med 3 T) [7, 8]. I den mån det är tillgängligt kan MR-sekvenser med reducerad ljudnivå (så kallade tysta sekvenser) med fördel användas.
Kvinnor i fertil ålder tillfrågas rutinmässigt om de är gravida inför en undersökning med MR. I klinisk praxis utförs MR under alla delar av graviditeten, så länge undersökningen är berättigad. Om undersökningen kan vänta (exempelvis elektiva kontroller av känd och icke-akut patologi) utförs den efter partus, alternativt efter att den första trimestern är slut. Med andra ord skjuter vi ibland upp en MR som skulle infalla under den första trimestern av rena försiktighetsskäl, men bara om detta inte innebär någon medicinsk nackdel för patienten. Försiktighetsprincipen måste alltså väga tyngre än den medicinska nyttan för att undersökningen ska skjutas upp.
Fosterdiagnostik utförs allt oftare med MR. Tidsfönstret för detta beror helt på frågeställningen och kan ligga när som helst under graviditeten, ända fram till dagarna före förlossningen.
Kontrastmedel vid magnetkameraundersökning
Gadoliniumbaserade kontrastmedel används i praktiken mycket sällan på gravida, men är inte absolut kontraindicerade [9-12]. Som vid alla radiologiska undersökningar ska den medicinska nyttan med att ge kontrastmedlet vara tillräckligt stor i relation till risken, och det har rapporterats en ökad risk för fosterdöd samt för vissa reumatologiska och inflammatoriska sjukdomar efter intrauterin exponering för Gd-KM [7, 13]. Det finns MR-sekvenser som utan injektion av kontrastmedel kan framställa både arteriella och venösa angiografier samt perfusion. Om Gd-KM ändå ordineras till en gravid patient, vilket alltså sällan sker, bör den ansvariga radiologen kontrollera vilken graviditetsklass som anges i Fass för de kontrastmedel som övervägs. Om Gd-KM planeras vid en elektiv MR och patienten inte vet om hon är gravid eller ej kan ett graviditetstest övervägas innan undersökningen bokas in. Om Gd-KM har givits till en gravid patient utan att en risk–nyttabedömning har genomförts (exempelvis om graviditeten har varit okänd vid undersökningstillfället) föreligger dock ingen indikation för vidare uppföljning eller åtgärd, utan lugnande besked bör ges.
Sinustrombos
Sinustrombos är sannolikt den vanligaste neuroradiologiska frågeställningen som föranleder telefonkonsultation med radiolog angående gravida. Frågan handlar ofta om metodval – DT eller MR? Svaret beror på kontexten och på radiologens preferenser. Å ena sidan har MR flera starka fördelar; utöver att metoden inte innefattar joniserande strålning och har en större differentialdiagnostisk bredd så kan även sekundära komplikationer såsom venös stas och venösa infarkter påvisas med större känslighet och säkerhet. Å andra sidan kan MR ibland resultera i en viss osäkerhet avseende okomplicerad sinustrombos. De venografiska sekvenser som görs utan kontrastmedel (till exempel faskontrast) kan ibland vara svårtolkade eller falskt positiva, exempelvis vid långsamt flöde. DT har i den här situationen fördelen att jod-KM kan ges, varpå en pålitlig venografi kan erhållas. Således har DT och MR olika styrkor.
Förslagsvis kan MR inklusive venografi utan kontrastmedel användas som förstahandsmetod dagtid, om den är tillgänglig. Det kommer oftast att vara tillräckligt. Jourtid kan en pragmatisk linje vara att börja med en nativ DT för att utesluta blödning, och sedan planera för MR dagtid. Om det av kliniska skäl är viktigt med ett snabbt besked, eller om MR-tillgängligheten är begränsad, kan ett lämpligt alternativ vara DT utan och med kontrastmedelsvenografi direkt.
Positronemissionstomografi
Undersökning med PET-kamera kan i ovanliga fall bli aktuell under graviditet. Det vanligaste spårämnet är 18F-FDG, vilket sönderfaller med en halveringstid på 110 minuter. En kombinerad PET/DT-undersökning (vilket är det vanligaste) utsätter kvinnan och fostret för joniserande strålning som kommer från både spårämnets sönderfall och själva datortomografin. Detta ställer höga krav på berättigandebedömningen. Vid en FDG-PET/DT helkropp (skallbas till och med bäcken) kommer ca 10 mGy från PET-delen, medan den samtidiga datortomografin bidrar med ytterligare ca 20 mGy (absorberad dos till patienten). Som tidigare nämnts kommer en fosterdos på 10 mGy att inducera 1 fall av leukemi på 1 700 undersökta. Bedömningen ställs här på sin spets: vad är risken för kvinnan och därmed också för fostret om undersökningen inte utförs? Om det går att vänta med undersökningen till efter partus utan att äventyra kvinnans hälsa är detta naturligtvis den bästa lösningen. PET/MR ger en avsevärt lägre stråldos, men finns bara på enstaka universitetssjukhus i Sverige.
När PET bedömts vara berättigad och planeras för en gravid patient kan strålningen till fostret hållas nere, bland annat genom att bara ge halva dosen av radiofarmaka och i stället fördubbla skanningstiden (bildkvaliteten blir då i princip oförändrad). Genom god hydrering och kateterisering eller frekvent tömning av urinblåsan minskar fosterdosen, eftersom spårämnet ackumuleras i urinen [14]. DT-delen kan eventuellt göras med lågdosprotokoll, vilket är tillräckligt för attenueringskorrigering (om diagnostisk DT eller MR redan finns). En undersökning som inte kan skjutas upp till efter partus bör planeras i nära samarbete mellan nuklearmedicinare, radiolog och fysiker.
Amning
Efter fullbordad graviditet är det i Sverige vanligt att amma sitt barn. Hos många nyblivna föräldrar finns i dag en ökad medvetenhet om att miljögifter och dylika ämnen kan följa med bröstmjölken och en stark vilja att spädbarnet i så liten utsträckning som möjligt ska utsättas för potentiellt skadliga ämnen. Frågan om kontrastmedel och amning är relativt vanlig vid neuroradiologisk konsultation. Lokala riktlinjer skiljer sig åt, men ibland nämns alternativet att pumpa ut bröstmjölk före och efter kontrastmedelsinjektionen, med intentionen att barnet ska få dricka den första satsen ur flaska och att den andra satsen kasseras. Det finns dock ingen evidens som talar för att amningsuppehåll behövs.
Både jod-KM och Gd-KM elimineras snabbt från kroppen. Gd-KM utsöndras i mycket små mängder i bröstmjölk (<0,04 procent av intravenös dos) och enbart en liten andel (<1 procent) absorberas i spädbarnets mag–tarmkanal [15]. Den systemiska dosen till spädbarnet blir därför oerhört låg (<0,0004 procent av moderns intravenösa dos) och är flera tiopotenser lägre än de doser som används kliniskt inom neonatal diagnostik [16]. Liknande farmakokinetik föreligger för jod-KM [17]. Vid kliniska doser förväntas därför inga effekter på spädbarnet, och amningsuppehåll är således inte indicerat [13, 18]. Ett amningsuppehåll kan också i sig ha negativa effekter [15]. Amningsrutinen kan vara mycket känslig, inte minst för det nyfödda barnet, och att försöka växla mellan flaska och bröst kan störa denna process. Lyhördhet är dock viktig, och beslutet om huruvida amningen ska fortsätta eller avbrytas enligt ovan ska fattas av patienten efter att hon informerats professionellt om evidensläget.
Överkänslighetsreaktioner
Incidensen av allvarliga överkänslighetsreaktioner är 1/10 000 för vanliga jod-KM och 1/20 000 för Gd-KM. Akuta överkänslighetsreaktioner kan vara isolerade (urtikaria, illamående, kräkning etc) eller utgöra ett delfenomen i en systemisk reaktion (anafylaxi).
Vid tidigare reaktion av icke-anafylaktisk karaktär utlöst av kontrastmedel kan ny undersökning utföras med kontrastmedel, men byt om möjligt till en annan sort. Många patienter med tidigare reaktion reagerar inte igen vid förnyad injektion.
Har patienten tidigare fått en anafylaktisk reaktion och det inte går att ersätta den valda undersökningen med en annan metod (utan kontrastmedel), kan premedicinering med kortison och antihistamin (paraplybehandling) övervägas [19]. Allt detta avser både gravida och icke-gravida och sker enligt lokala riktlinjer.
När premedicinering ordineras till gravida eller ammande patienter ges samma läkemedel och samma doser som hos andra vuxna. Om det uppstår en överkänslighetsreaktion och/eller anafylaktisk reaktion hos en gravid patient behandlas även detta på samma sätt som hos andra vuxna [19].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Ida Blystad är ordförande, David Fällmar är vice ordförande, Tobias Granberg är vetenskaplig sekreterare, Margareta Nilsson är ledamot och Karin Sundström är kassör i SFNR. Jeanette Carlqvist är ledamot i kontrastmedelsgruppen i SFMR. Johan Wikström är tidigare ordförande i SFNR. Isabella M Björkman-Burtscher är styrelseledamot i SFNR och ledamot i SAMS.
Fakta 1. Absorberad och effektiv dos
Absorberad dos är den grundläggande enheten för stråldos och definieras som mängden absorberad strålningsenergi per massenhet i en viss punkt i en kropp. Enheten för absorberad dos är J/kg, som fått namnet Gray (Gy). Stråldoser till foster anges alltid som absorberad dos.
Effektiv dos är absorberad dos korrigerad dels för strålningens biologiska påverkan, dels för varje organs strålkänslighet. Enheten för effektiv dos är Sievert (Sv). Den stråldos patienten erhåller vid sin undersökning anges oftast som effektiv dos.
CTDIvol (datortomografiskt dosindex) är det stråldosbegrepp som används vid DT-undersökningar med enheten Gray (Gy). Det beskriver medelstråldosen i ett snitt i den undersökta volymen.