Barretts esofagus innebär metaplastiskt körtelepitel proximalt om den gastroesofageala övergången med samtidig intestinal metaplasi.
Risken för att få körtelcancer (EAC) vid Barretts esofagus är ca 0,1–0,5 procent/år och relateras till längden av segmentet samt ökar 10 gånger vid förekomsten av låggradig dysplasi.
Vid upptäckt av Barretts esofagus ska systematisk biopsitagning göras. Patienter med eller utan tydliga symtom på GERD (gastroesofageal refluxsjukdom) behandlas med en adekvat dos protonpumpshämmare (PPI).
Risken för utveckling av höggradig dysplasi/EAC hos patienter som behandlas med PPI eller genomgått antirefluxoperation är sannolikt minskad.
Vid Barretts esofagus utan dysplasi rekommenderas följande: vid kort utbredning (1–3 cm) utförs kontrollgastroskopi var 5:e år, vid lång utbredning (>3–10 cm) utförs kontrollgastroskopi var 3:e år och vid utbredning >10 cm remitteras patienten till specialistcentrum för uppföljning. Hänsyn ska alltid tas till individuella faktorer vid val av uppföljningsstrategi.
Vid låggradig dysplasi ska slemhinnan eradikeras på ett specialistcentrum.
Alla lesioner inom Barretts esofagus ska resekeras endoskopiskt.
Endoskopisk behandling är överlägsen konventionell kirurgi [48].
Gastroesofageal refluxsjukdom (GERD) karakteriseras av en ökad mängd magsaft som regurgiterar till esofagus och har en frätande effekt på slemhinnan med symtom som halsbränna, sura uppstötningar och lägesberoende/ansträngningsutlöst bröstsmärta. Den tillhörande inflammationen i matstrupens flerskiktade skivepitel (esofagit) kan oftast, men inte alltid, ses makroskopiskt vid gastroskopi, men påvisas mikroskopiskt i form av karakteristiska förändringar [1]. GERD är vanlig hos den vuxna befolkningen i västvärlden, och incidensen tycks öka. Detta innebär att många individer lider av hög symtombörda och nedsatt livskvalitet, vilket kan kopplas till betydande kostnader och socioekonomiska konsekvenser [2-6].
En tydlig och allvarlig manifestation av GERD är uppkomsten av esofageal skada i form av esofagit och körtelomvandlad slemhinna (metaplasi) och/eller peptisk striktur (i dag mycket ovanligt). Den körtelomvandlade slemhinnan, som ursprungligen alltid kallades Barretts esofagus, får stor klinisk betydelse när intestinal metaplasi uppstår. Detta ger förutsättningar för fortsatt cellomvandling (dysplasiutveckling), som i förlängningen kan leda till körtelcancer (adenokarcinom) i esofagus (EAC). EAC är en aggressiv form av cancer vars incidens ökar i vår del av världen [2, 7-9].
Denna artikel beskriver uppkomsten av det metaplastiska körtelepitelet och dess progress till dysplasi och cancer samt ger rekommendationer om hur viktiga signaler om framtida risker kan fångas upp, hanteras och förebyggas.
Definition, diagnos och prevalens
Barretts esofagus ska alltid misstänkas om man vid endoskopi ser körtelslemhinna som sträcker sig minst 1 cm proximalt om den anatomiska gastroesofageala övergången (gastroesophageal junction, GEJ). Diagnostisering kräver multipla biopsier från körtelslemhinnesegmentet för att dels dokumentera och karakterisera det metaplastiska epitelet, dels upptäcka eventuella dysplastiska körtelförändringar. Den körtelomvandlade slemhinnan kan indelas i 3 former: intestinal typ, gastrisk typ och blandform. Karakteristiskt för intestinal typ är förekomsten av bägarceller med mucininnehåll (färgas med hematoxylin–eosin/alcianblått, pH 2,5; se Figur 1).
Förekomst av intestinal metaplasi (specialized intestinal metaplasia) är numera en förutsättning för diagnosen i de flesta länder, inklusive Sverige [11-15]. Riskfaktorer för att utveckla Barretts esofagus hos patienter med GERD är hög ålder, fetma, manligt kön, kaukasisk etnicitet, rökning och familjehistoria av Barretts esofagus och/eller EAC [16, 17].
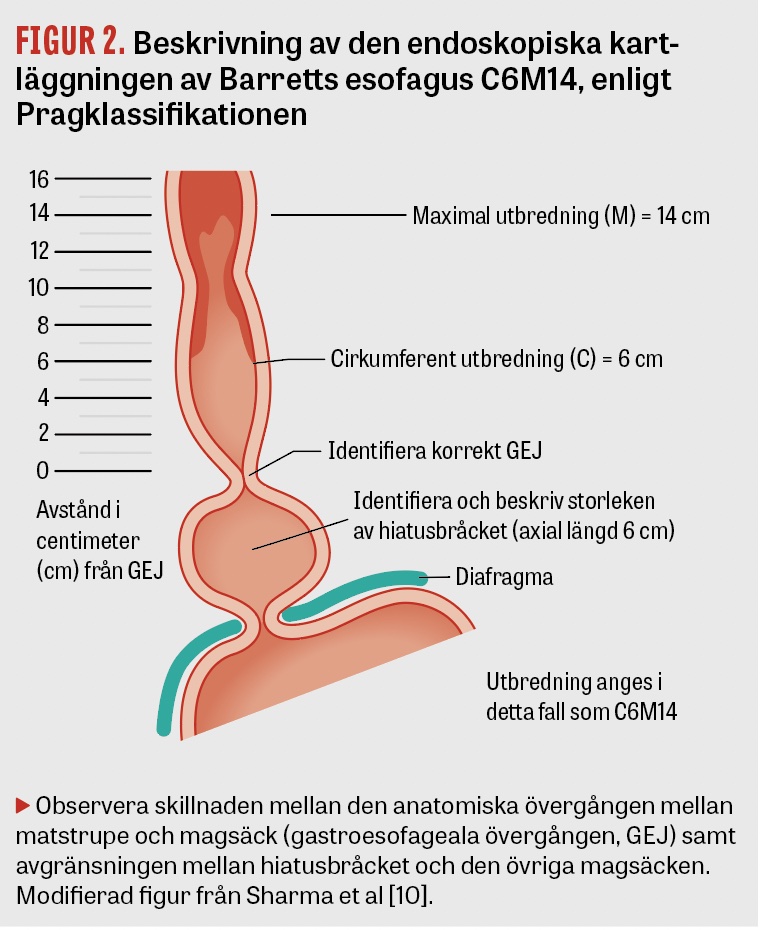
Prevalensen av Barretts esofagus varierar mellan olika delar av världen och har rapporterats ligga runt 10 procent i västliga och <5 procent i östliga länder [2-5]. På samma sätt finns en nord–sydlig gradient med dominans i norr. Ju striktare kriterier som använts, exempelvis Pragklassifikationen [10] för endoskopisk diagnos (Figur 2) och Seattleprotokollet [18] för histopatologisk diagnos (se nedan), desto lägre prevalenssiffror registreras. Av allt att döma är den verkliga prevalensen fortfarande relativt oklar.
Är det då rimligt att med screening aktivt leta efter Barretts esofagus hos patienter med GERD? Svaret har hittills varit »nej« på grund av ett flertal faktorer, exempelvis graden av obehag och invasivitet hos den traditionella och enda allmänt tillgängliga diagnostiska metoden, gastroskopi. En framtida diagnostisk teknik för screening kan vara Cytosponge [19]. Det är en svampliknande borste innesluten i en gelatinkapsel och fäst i en tråd som sväljs och vecklas ut i magsäcken. Borsten dras upp genom matstrupen, varefter celler tas från borsten och undersöks mikroskopiskt.
Uppkomstmekanismer
Studier av den genetiska uppsättningen hos patienter med GERD tyder på att patienter med Barretts esofagus har en ärftlig benägenhet för utveckling av intestinal metaplasi [20]. I de allra flesta fall utvecklas körtelmetaplasi som ett svar på kronisk vävnadsskada orsakad av reflux från magsäcken. Förmodligen är den Barrett-omvandlade slemhinnans metaplastiska celler mer resistenta mot fortsatt refluxinducerad skada än de nativa skivepitelcellerna och kan ses som ett sätt för organet/slemhinnan att skydda sig [21]. En sådan minskad känslighet kan resultera i att patienter med Barretts esofagus i större utsträckning tolererar pågående patologisk reflux och därför inte söker läkarvård och behandling. Patienter med Barretts esofagus, och framför allt de med en långsegmentvariant (>3 cm), karakteriseras av att de har mer reflux än vad som vanligen ses hos patienter med GERD och att denna reflux är jämnt fördelad över dygnets alla timmar. Andra faktorer, som innehåll av duodenala komponenter (galla och pankreassaft) i refluxvätskan, lägre vilotryck i nedre esofagussfinktern, minskad motilitet i matstrupen och större hiatusbråck, bidrar också till sjukdomens svårighetsgrad och ställer krav på behandlingen. Rollen som Helicobacter pylori spelar i patogenesen är intressant eftersom det föreligger ett omvänt förhållande mellan prevelansen av Barretts esofagus och Helicobacter pylori samt mellan EAC och Helicobacter pylori på populationsnivå [22, 23]. Det har spekulerats om att den atrofi av ventrikelslemhinnan som infektionen medför minskar refluxen av skadligt material från magsäcken.
Refluxatet består av olika delar magsyra, galla, pepsin, födoämnen och bakterier (mikrobiota). Mekanismerna genom vilka syra leder till slemhinneskada är tämligen väl kända. Gallsyrors betydelse för vävnadsskadan är däremot mer oklar, då deras förmåga att genomtränga cellmembranen kräver protonering [23]. Detta betyder att de blir cytotoxiska först i närvaro av syra. Dessa observationer kan förklara sambandet mellan gallsyrakoncentrationen i refluxatet och svårighetsgraden av refluxsymtomen och tillhörande vävnadsskada (esofagit). På samma sätt har det spekulerats om huruvida detta förhållande är förklaringen till den gynnsamma terapeutiska effekten av enbart syrahämning också hos patienter med Barretts esofagus.
Den vävnadsskada i esofagus som ses hos patienter med GERD åtföljs dels av en inflammatorisk reaktion i vävnaden, dels av en proliferativ vävnadsreaktion, som kan tolkas som en form av läkningsprocess. Därvid stimuleras olika populationer av stamceller, vilket sker på både skivepitel- och körtelepitelsidorna av den refluxinducerade skadan (Figur 3A). Körtelcellerna har en konkurrensfördel gentemot skivepitelets motsvarigheter, vilket leder till en utveckling och utbredning av framför allt körtelepitel (Figur 3B). Fortsatt obehandlad reflux kan då orsaka en molekylär omprogrammering av dessa prolifererande stamceller (sannolikt de så kallade kardiakörtlarna), vilket har föreslagits vara ursprunget till intestinal metaplasi [20, 22].
Prevention och riskminimering
Det är viktigt att hålla i minnet att kardiovaskulär sjukdom är den absolut största hälsorisken för patienter med Barretts esofagus, inte EAC [24]. Kardiovaskulär prevention är således en prioriterad handläggningsstrategi, men det är viktigt att i den kliniska handläggningen av GERD också väga in möjliga långsiktiga preventiva åtgärder för att motverka uppkomst av Barretts esofagus och på sikt även EAC. Från ett patofysiologiskt perspektiv uppstår frågan hur vanligt det är att Barretts esofagus utvecklas om patologisk reflux inte handläggs på ett optimalt sätt. Vissa kirurgiska ingrepp på esofagus, exempelvis esofagusresektion och rekonstruktion med ventrikeltub, resulterar i en kraftfull reflux till den kvarvarande normala delen av matstrupen. Under en 5-årsperiod utvecklas i ca 50 procent av fallen en körtelmetaplasi med intestinal metaplasi proximalt om en sådan anastomos [25]. Huruvida effektiv syrahämmande behandling förhindrar denna utveckling är ofullständigt studerat. Sleeve-gastrektomi är en operation som utförs på indikationen grav obesitas, och rapporter tyder på att den åtföljs av en årlig incidens av GERD på mellan 5 och 10 procent. Mekanismen är oklar, men sannolikt har operationen en negativ inverkan på His vinkel och ventilfunktionen i gastroesofageala övergången i kombination med att den resterande magsäcken (sleeven) utgör ett högtryckssystem. Prevalensen av Barretts esofagus 5 år efter sleeve-gastrektomi har i vissa rapporter angetts till strax under 10 procent [26, 27]. Dessa observationer ger en tydlig anvisning om sambandet mellan okontrollerad reflux och utveckling av Barretts esofagus.
Hos patienter med GERD som följs under lång tid med strikta vetenskapliga protokollformer och som antingen har en effektiv behandling med moderna protonpumpshämmare (PPI) eller har genomgått en välfungerande antirefluxoperation ser man anmärkningsvärt sällan en uppkomst av metaplastiskt körtelepitel [28-30]. Detta kan tala för en preventiv effekt av refluxbehandling. I den stora tyska Progerd-studien [31], som följde patienter med GERD handlagda inom allmänmedicinsk öppenvård (inget standardiserat behandlingsprotokoll), noterades en utveckling av Barretts esofagus efter 5 år hos ca 10 procent, framför allt hos dem som ursprungligen hade allvarlig esofagit (grad C eller D på Los Angeles-klassifikationen) vid behandlingens start. I samma studie noterades också ett samband mellan behovet av kontinuerlig medicinering och sjukdomsutveckling, vilket sannolikt indikerar sambandet mellan svårighetsgraden av GERD och risken att utveckla Barretts esofagus.
Skydd mot dysplasi och cancerutveckling?
Flera större studier, inklusive metaanalyser, har visat en minskad cancerrisk hos patienter med Barretts esofagus som behandlas med PPI [32-36]. Motsvarande observationer görs också i resultaten från den så kallade Aspect-studien [34], som randomiserade 2 557 patienter med långt segment av Barretts esofagus i 4 grupper (låg/hög dos PPI med/utan 300 mg ASA). Resultaten visade att 40 mg esomeprazol × 2 förlänger tiden för utveckling av EAC (tidskvot 1,27; 95 procents konfidensintervall [95KI] 1,01–1,58), vilket talar för att doseringen ska vara standard vid nydiagnostiserad Barretts esofagus. I en nyligen publicerad metaanalys samlades data från 12 studier med totalt 155 769 patienter, och resultaten talade för att PPI var associerade med en minskad risk för utveckling av höggradig dysplasi/EAC (oddskvot 0,47; 95KI 0,32–0,71). De flesta populationsbaserade studierna belastas dock med en betydande heterogenitet. Inte oväntat pekar resultat från andra studier och även en metaanalys mot att PPI inte påverkar utvecklingen av höggradig dysplasi/EAC, men även dessa studier har betydande metodologiska problem. Bland problemen kan nämnas att precisionen i diagnostiken varit suboptimal, att man inte tydligt korrigerat för övriga relevanta riskfaktorer, att följsamheten avseende det reella PPI-intaget varit oklar och att de PPI-behandlade patienterna möjligen hade svårare symtom och därmed utgjorde en selekterad grupp.
Tillgängliga data talar för att antiinflammatoriska läkemedel minskar risken för malign progression inom det metaplastiska intestinala epitelet [37]. Tillsammans med dubbel dos esomeprazol ökade hög dos av ASA skyddet mot utveckling av höggradig dysplasi/EAC jämfört med behandling med enbart dubbel dos PPI (tidskvot 1,38; 95KI 0,98–1,94) eller låg dos PPI + ASA (1,59; 95KI 1,14–2,23) [34].
Information om effekten av antirefluxkirurgi är på samma sätt divergerande [38-40]. Hos patienter med Barretts esofagus som följdes under lång tid efter antirefluxoperation kunde man påvisa en riskreduktion (incidenskvot) på 0,46 (95KI 0,20–1,08) och 0,26 (95KI 0,09–0,79) när analyserna begränsade sig till publikationer före respektive efter år 2000. I dessa studier noterades ingen skillnad i risken för EAC mellan dem som genomgått antirefluxkirurgi och dem som erhöll enbart läkemedelsbehandling. På samma sätt har man i en populationsbaserad studie från England noterat 36 procents riskreduktion för uppkomsten av EAC hos patienter med GERD efter en antirefluxoperation (hazardkvot 0,64; 95KI 0,52–0,78). Hos patienter med Barretts esofagus var motsvarande riskreduktion 0,47 (95KI 0,12–1,90). Nyligen presenterades data från en stor nordisk populationsbaserad studie inkluderande 942 071 patienter med GERD, varav 48 863 genomgått antirefluxoperation och 893 208 patienter behandlats enbart med läkemedel. Under en uppföljningstid på 15 år kunde man inte se någon effekt av antirefluxoperation på risken för EAC [40]. Inte heller kunde man notera någon skillnad mellan dem som erbjudits operation och de patienter med GERD som behandlats enbart med läkemedel.
Från ett patofysiologiskt perspektiv är det intressant att man inte tydligt kan se en mer skyddande effekt av antirefluxoperation (som kontrollerar hela den duodenogastroesofageala refluxen) än av endast PPI-behandling (som enbart kontrollerar syran), mot bakgrund av teoribildningarna kring betydelsen av de duodenala komponenterna i refluxatet för utveckling av både inflammation och dysplasi/neoplasi i distala esofagus (se ovan).
Praktisk handläggning
Det är viktigt för den fortsatta handläggningen av patienter med ett minst 1 cm långt körtelepitelsegment (inklusive eventuell körtelepiteltunga) proximalt om gastroesofageala övergången att den första endoskopin görs på ett korrekt sätt. Den ska ha fokus på identifiering av makroskopiska avvikelser (tumörer) och på påvisandet eller uteslutandet av intestinal metaplasi inom det metaplastiska segmentet. Avgörande är då att en systematisk så kallad förstagångskartläggning utförs. Om den ska vara pålitlig måste en eventuell esofagit först behandlas med PPI (standarddos × 2) under 8 veckor, eftersom pågående inflammation kan försvåra avgränsningen av körtelsegmentet samt bedömningen av eventuella dysplastiska förändringar. Segmentet beskrivs enligt Pragklassifikationen och anges som CxMx (Figur 2). Varje endoskopi på en patient med misstänkt Barretts esofagus måste utföras mycket noggrant [41]. Ett riktmärke ska vara att varje centimeter av körtelepitelsegmentet inspekteras under minst 1 minut. Det är viktigt att vara medveten om att dysplastiska förändringar har en högre benägenhet att utvecklas i synfältet (med patienten i vänster sidoläge) mellan klockslagen 12 och 03. I enlighet med Seattleprotokollets anvisningar [18] tas kvadrantbiopsier med en »jumbotång« med sugteknik på varannan centimeter av segmentet. I händelse av att låg- eller höggradig dysplasi påvisas ska diagnoser alltid bekräftas av specialiserad GI-patolog (Fakta 1).
Dysplastiskt Barrettepitel
Låggradig dysplasi bekräftad av specialiserad GI-patolog och påvisad vid uppföljande gastroskopi 6 månader efter förstagångskartläggningen har visat sig vara förenad med en 10-faldigt ökad risk för utveckling till höggradig dysplasi och EAC [42]. Eradikeringsbehandling av hela den metaplastiska slemhinnan ska därför alltid ske vid förekomst av dysplasi. I dag använder man olika ablativa tekniker som förstör de ytliga slemhinnelagren genom tillförsel av energi av olika modaliteter (Figur 4); den vanligaste är radiofrekvensablation. Om läkningsprocessen efter ablationen sker under behandling med PPI (standarddos × 2) återbildas den ursprungliga slemhinnetypen (skivepitel) utan kvarvarande körtelstrukturer under en period på 6–8 veckor [43].
Radiofrekvensablation (Figur 5) förstör ytepitelet till ett djup på 500 µm. Metoden är bevisat effektiv beträffande komplett eradikering av intestinal metaplasi och dysplasi och har förhållandevis få komplikationer. Radiofrekvensablation av eventuellt kvarvarande metaplastiskt epitel ska därför alltid göras efter resektion av fokala/synliga dysplastiska lesioner (se nedan). Radiofrekvensablation ska även erbjudas patienter med låggradig dysplasi utan fokala lesioner när denna påvisats vid två på varandra följande undersökningar. Samma ablativa behandling rekommenderas vid höggradig dysplasi utan fokala lesioner, men rekommenderas för närvarande inte vid Barretts esofagus med endast intestinal metaplasi (det vill säga utan dysplastiskt fokus). Eftersom recidiv kan uppkomma måste dessa patienter följas upp under minst 5 år efter ablationsbehandlingen.
Endoskopiska resektionstekniker
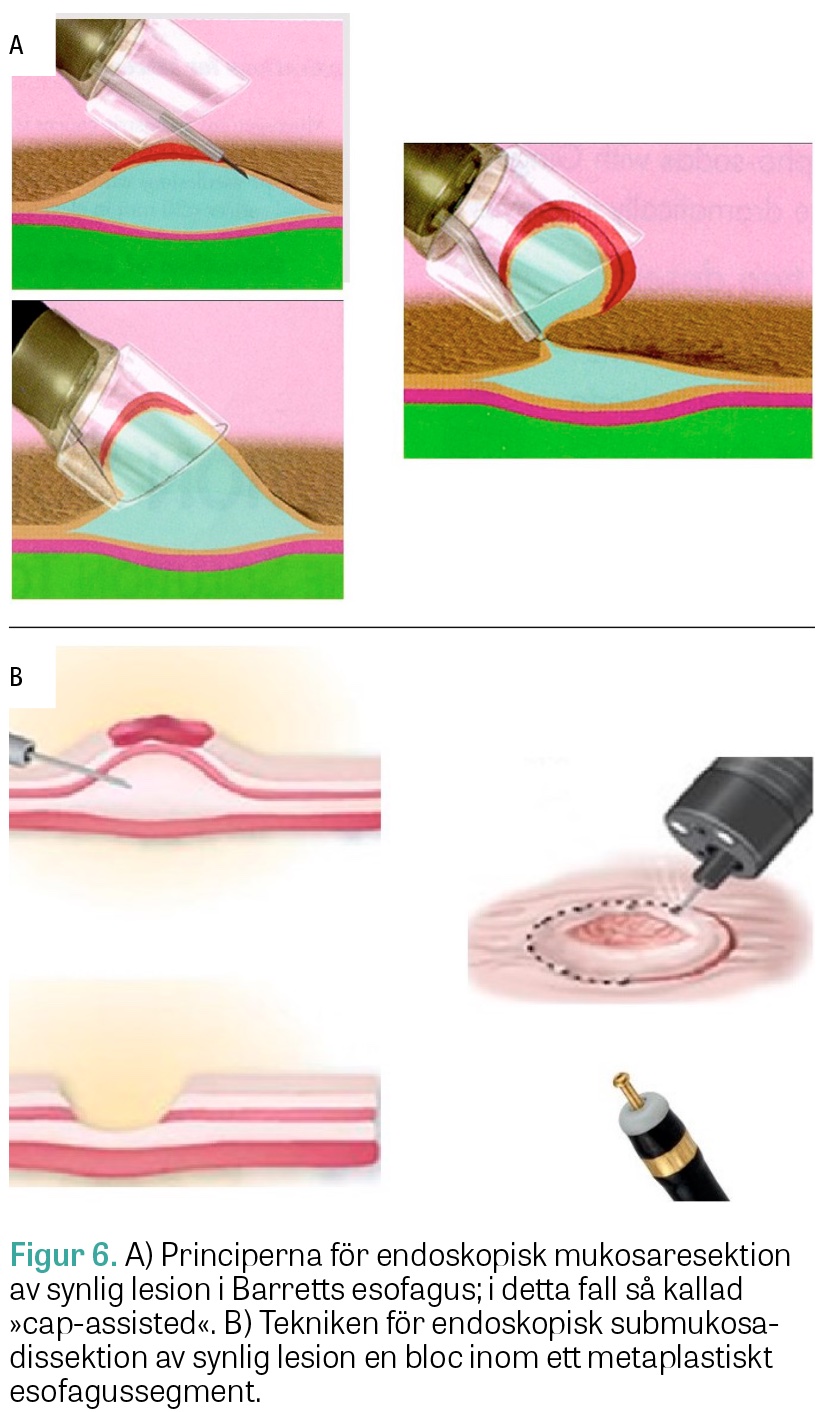
De endoskopiska resektionsteknikerna har revolutionerat behandlingen av synliga lesioner inom det metaplastiska epitelet [44-46]. Dessa behandlingar är högspecialiserade och ska utföras vid specialistcentrum. Vid resektionen avlägsnas ett ytligt slemhinnestycke ned till submukosanivå (Figur 4 och 6) genom antingen så kallad endoskopisk mukosaresektion eller endoskopisk submukosadissektion. De ger möjlighet att erhålla en definitiv och komplett PAD och information som är nödvändig att inhämta inför behandlingsbeslut (som alltid ska ske på en regional multidisciplinär beslutskonferens). Man har i studier påvisat att en mer avancerad neoplasi föreligger i 40‒50 procent av de PAD som erhållits från resekerade slemhinneförändringar jämfört med när den initiala diagnosen baserades enbart på endoskopiskt utseende och PAD från tångbiopsier. Tumörer som uppvisar ett morfologiskt genombrott, det vill säga sträcker sig genom hela submukosan, är inte lämpliga för endoskopisk behandling. För patienter med sådana förändringar kan traditionell resektionskirurgi bli aktuell i stället [45]. De flesta specialistföreningarna inom gastroenterologi rekommenderar sedan mer än 20 år tillbaka endoskopisk terapi som primär behandling av höggradig dysplasi och intramukosal EAC. Dessa tumörstadier kan inte fastställas enbart från material taget med biopsitång, men har sannolikt en mycket låg risk för utveckling av lymfkörtelmetastaser (<1 procent). Vid djupare engagemang, det vill säga ytlig submukosal invasion, uppskattas däremot risken till uppemot 10 procent, och vid ännu djupare invasionsgrad genom submukosan är denna risk betydligt högre (30‒60 procent).
Endoskopisk mukosaresektion (Figur 6A) som utförs med diatermislynga begränsas av hur stora slemhinnestycken som kan avlägsnas, varför man ibland behöver utföra resektionen i flera fraktioner, så kallad piecemeal-resektion, för att säkerställa fria laterala resektionsmarginaler vid mer utbredda neoplasier. Denna strategi anses dock mindre gynnsam ur ett tumörbiologiskt perspektiv. Vid endoskopisk submukosadissektion (Figur 6B) föreligger ingen sådan storleksbegränsning, utan även stora neoplasier kan avlägsnas en bloc. Hittills finns inga randomiserade studier som jämfört tumörfri långtidsöverlevnad vid endoskopisk mukosaresektion och endoskopisk submukosadissektion som behandling för dysplasi/adenokarcinom i esofagus.
Inte helt oväntat har studier visat att endoskopisk submukosadissektion ger fler radikala resektioner (R0) än endoskopisk mukosaresektion och att högre risk för lokala recidiv föreligger med den senare tekniken. Endoskopisk submukosadissektion tar dock längre tid och är behäftad med fler lokala komplikationer (blödning, perforation och strikturbildning). De enheter som byggt upp en betryggande erfarenhet av behandlingen rapporterar dock allt färre komplikationer. En rimlig rekommendation baserad på nuvarande evidensläge är att endoskopisk mukosaresektion utförs vid lesioner med storlek <10 mm, att både endoskopisk mukosaresektion och endoskopisk submukosadissektion utförs vid lesioner med en diameter mellan 11 och 20 mm och att endoskopisk submukosadissektion utförs vid lesioner >20 mm.
Läs även:
Författarintervjun med Anders Thorell
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Samtliga författare är medlemmar i en expertgrupp för uppgradering av »Nationella riktlinjer för utredning samt handläggning av Barretts esofagus«, utsedd av Svensk gastroenterologisk förening.
Fakta 1. Kontrollstrategier efter utförd förstagångskartläggning
- GERD-patient med körtelmetaplasi utan påvisbar intestinal metaplasi behandlas enbart för sin grundsjukdom (GERD).
- Barretts esofagus med intestinal metaplasi utan dysplasi kontrolleras med biopsitagning efter 1 år för att minska risken för felaktigt vävnadsprov. Vid fortsatt avsaknad av dysplasi bestäms uppföljning av patienten utifrån utbredningen av Barrettsegmentet enligt Pragklassifikationen. Vid kort segment (1–3 cm) görs kontrollgastroskopi vart 5:e år, vid långt segment (>3–10 cm) görs kontrollgastroskopi vart 3:e år och vid segment >10 cm remitteras patienten till specialistcentrum för uppföljning.
- Vid Barretts esofagus med bekräftad låggradig dysplasi med eller utan synliga lesioner ska patienten erbjudas ablations- eller annan eradikeringsbehandling.
- Vid Barretts esofagus med bekräftad höggradig dysplasi ska patienten remitteras till specialistcentrum.
- Vid Barretts esofagus med höggradig dysplasi utan synliga lesioner ska patienten kontrolleras efter 3 månader för verifikation.
- Barretts esofagus med verifierad höggradig dysplasi ska bli föremål för ablations- eller annan eradikeringsbehandling.
- Efter ablations- eller annan eradikeringsbehandling kontrolleras patienten med gastroskopi efter 3, 6 och 12 månader, sedan årligen i 5 år.
- Uppföljningens utformning 5 år efter framgångsrik eradikeringsbehandling kräver bättre vetenskapligt underlag än vad som finns i dag, men vart 3:e år bedöms vara rimligt.
- Patienter med synliga lesioner oavsett dysplasigrad ska resektionsbehandlas.
- Vid Barretts esofagus med bekräftad IND (indefinite for dysplasia*) rekommenderas gastroskopikontroller årligen tills diagnoserna intestinal metaplasi utan dysplasi eller låggradig dysplasi kan fastställas.
- Vid beslut om att inleda eller avsluta kontrollprogram måste hänsyn tas till individuella faktorer, såsom patientens egna preferenser, ålder (med tentativ övre gräns på 75 år), annan samtidig sjuklighet och operabilitet.
- Förtydligande flödesscheman finns att hämta i Thorell et al [48].
*Cellbilden i epitelet är avvikande, men kan inte klassificeras som äkta dysplasi oftast på grund av samtidig inflammation.