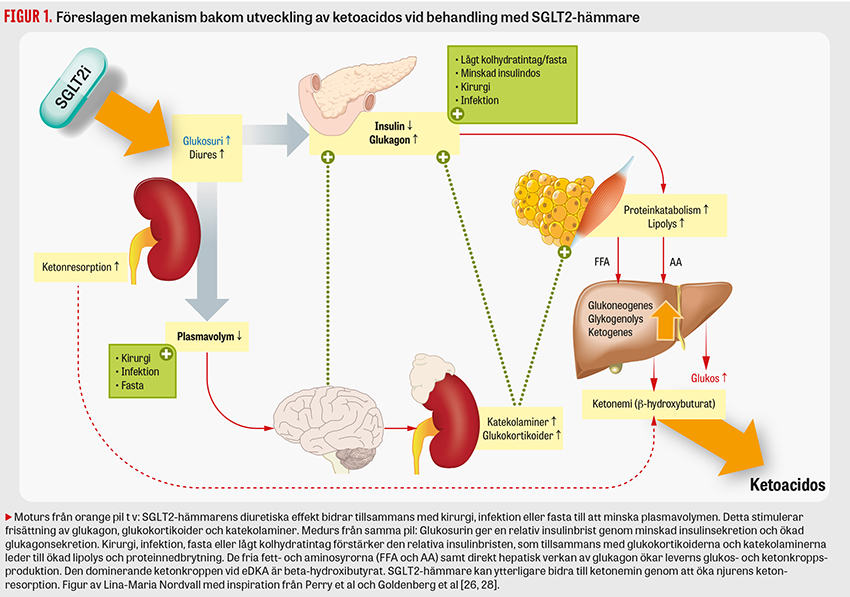
Vid relativ insulinbrist och/eller dehydrering kan SGLT2-hämmare utlösa euglykemisk ketoacidos (eDKA). eDKA ger ospecifika symtom som illamående, buksmärta, trötthet och takypné.
Vi föreslår:
Screena liberalt för blodketoner vid infektion, kirurgi, lågt kolhydrat-/vätskeintag, illamående, buksmärta eller svår sjukdom.
Pausa behandling med SGLT2-hämmare 3–4 dagar före operation (1–2 veckor före obesitaskirurgi) samt vid infektion, akut sjukdom, lågt kolhydratintag eller dehydrering.
Undvik SGLT2-hämmare vid insulinbrist, alkoholmissbruk och lågkolhydratdiet.
Undvik plötslig dosminskning av insulin perioperativt eller vid insättning av SGLT2-hämmare.
Förskrivning av antidiabetika tillhörande gruppen natriumglukos-kotransportör 2-hämmare (SGLT2i), till exempel empagliflozin (Jardiance) och dapagliflozin (Forxiga), blir allt vanligare på grund av utökade indikationer som njursvikt och hjärtsvikt. I och med ökad förskrivning har även mindre vanliga biverkningar som ketoacidos uppmärksammats. En fallbeskrivning som tidigare publicerats i Läkartidningen [2023;120:22113] belyser vikten av utsättning av SGLT2-hämmare vid akut sjukdom. Euglykemisk diabetisk ketoacidos (eDKA) associerad med SGLT2-hämmare är ett allvarligt tillstånd med potentiellt dödlig utgång och kompliceras av ett atypiskt förlopp med ospecifika symtom. eDKA liknar klassisk diabetisk ketoacidos (DKA) med pH <7,3, ketonemi och hypovolemi till följd av osmotisk diures, men har vanligen normala till lätt förhöjda blodglukosnivåer och benämns därför euglykemisk.
Vanliga symtom är kräkningar, illamående, buksmärta, trötthet och takypné. Exempel på utlösande faktorer är kirurgi, infektion, fasta, latent insulinbrist samt upphörd eller minskad insulinbehandling [1-3]. För att förebygga eDKA är det viktigt att sätta ut SGLT2-hämmare 3–4 dygn inför kirurgi samt i samband med infektion, akut sjukdom eller dehydrering [4]. Detta rekommenderas av läkemedelsmyndigheten i USA (FDA) samt kunskapsstödet UpToDate [5]. För att upptäcka tillståndet rekommenderas kapillär blodketonscreening »bedside« vid risksituationer samt vid symtom hos patienter som behandlas med SGLT2-hämmare [6, 7].
Incidens av SGLT2i-utlöst ketoacidos
Antalet rapporter om eDKA har ökat kraftigt de senaste åren och kan bland annat bero på ökad användning av SGLT2-hämmare. I en metaanalys från 2022 som inkluderade 7 kliniska prövningar (n = 42 375) fann man en 2,5 gånger förhöjd risk för eDKA med SGLT2-hämmare jämfört med placebo, GLP1-analoger eller DPP4-hämmare [8]. Författarna utförde även en systematisk översikt som inkluderade 5 kohortstudier (n = 318 636) vilka visade en eDKA-incidens mellan 0,6 och 4,9 fall/1 000 patientår. I Sverige har hälso- och sjukvårdspersonal rapporterat in 107 fall till Läkemedelsverkets biverkningsdatabas under perioden 2016–2022, men sannolikt föreligger en kraftig underrapportering. Enligt biverkningsrapporter till FDA ökade SGLT2-hämmare risken för acidos vid typ 2-diabetes 7-faldigt jämfört med DPP4-hämmare. I 71 procent av fallen var patienten euglykemisk [9]. Jämfört med metforminutlöst laktacidos (< 1 fall/10 000 patientår) tycks risken för eDKA vara betydligt högre [10]. Oavsett den sanna incidensen så är eDKA en allvarlig och potentiellt dödlig biverkan [11] som ofta kräver längre sjukhusvistelse än klassisk DKA [12].
Främst personer med diabetes riskerar ketoacidos. Huruvida det kan drabba även personer utan diabetes i samband med SGLT2i-behandling är inte väl studerat; förmodligen är tillståndet underdiagnostiserat då man inte misstänker ketoacidos hos personer utan diabetes. Fall finns dock rapporterade [13-16]. Syftet med den här översikten är att uppmärksamma kliniskt verksamma läkare på att SGLT2-hämmare bör sättas ut vid infektion, akut sjukdom eller dehydrering samt inför kirurgi. eDKA kan vara svårdiagnostiserad, men blir allt vanligare på grund av ökad förskrivning av SGLT2-hämmare. Frikostig screening för blodketoner vid risksituationer möjliggör prevention och tidigare upptäckt av eDKA.
SGLT2-hämmares verkningsmekanism
Vid normalt blodsocker återtas nästan all glukos från urinen till blodet. Detta sker främst tidigt i proximala tubuli via natriumglukos-kotransportör 2 (SGLT2) samt i mindre omfattning via SGLT1 mer distalt i proximala tubuli. Vid blodsocker över 11 mmol/l överskrids njurens förmåga att återta glukos, med glukosuri som följd [17]. Vid typ 2-diabetes är njurens förmåga att återta glukos förhöjd. Mekanismen bakom detta är oklar, men resorptionen av glukos via både SGLT1 och SGLT2 tycks vara ökad [18]. SGLT2i hämmar resorptionen av glukos och natrium från urinen tillbaka till blodet via SGLT2, och på så vis uppkommer glukosuri och osmotisk diures. Glukosurin bidrar till sänkning av HbA1c, viktnedgång, minskad insulinsekretion och minskad insulinresistens [19-21]. Natriuresen som initialt sker samtidigt med glukosurin är övergående inom ett par veckor på grund av kompensatoriskt ökad natriumresorption distalt om SGLT2 [22, 23]. Graden av glukosuri är proportionell till blodglukoskoncentrationen och mindre uttalad vid normalt blodsocker. Detta medför låg risk för hypoglykemi [17]. Normalt återtar SGLT1 glukos under sin maximala kapacitet. Vid hämning av SGLT2 blir koncentrationen av glukos högre vid SGLT1, och en högre andel glukos återtas därmed via SGLT1 [17, 22].
Patogenesen bakom euglykemisk ketoacidos
Patogenesen bakom eDKA är inte fullständigt klarlagd. Gemensamt för flera av riskfaktorerna är en insulinbrist – absolut eller relativ i förhållande till glukagon – samt att de ofta involverar hypovolemi, vilket ökar risken ytterligare. SGLT2-hämmare bidrar i sig till relativ insulinbrist samt kan bidra till hypovolemi. Som ett exempel leder en större operation, via kirurgisk stress och insulinresistens, till en relativ insulinbrist och kan även bidra till dehydrering via fasta och postoperativa kräkningar [6, 24]. Fastan och den postoperativa matledan ger via lågt kolhydratintag, minskad insulinsekretion och ökad glukagonsekretion ytterligare förstärkning av den relativa insulinbristen [7, 24]. Om patienten är insulinbehandlad sänks ofta dosen perioperativt, vilket kan ge absolut insulinbrist och ökar risken för eDKA [25]. Vid en sänkning av plasmavolymen signalerar hypotalamus till pankreas att öka glukagonsekretionen och till binjurarna att öka sekretionen av katekolaminer och glukokortikoider [2].
Både hypovolemin, den relativa insulinbristen och de förhöjda glukokortikoid- och katekolaminnivåerna signalerar till fett- och muskelvävnad att frisätta fett- och aminosyror som levern kan använda till glukos- och ketonkroppsproduktion (Figur 1). På ett liknande sätt kan även en infektion genom kräkningar, diarréer eller minskat vätskeintag kombinerat med ökad insulinresistens och minskat kolhydratintag utlösa en ketoacidos [6]. Det är i dag inte klarlagt i vilket skede kroppen dekompenserar till ketoacidos – kanske vid en viss grad av insulinbrist kombinerad med en viss grad av hypovolemi. Framtida studier får utvisa vilka andra mekanismer som bidrar till detta.
SGLT2-hämmare ökar njurens resorption av ketonkroppen acetoacetat, vilket teoretiskt kan öka graden av ketonemi samt minska halten av detekterbart acetoacetat i urin. Det anses därför i dag mindre lämpligt att screena för ketoner i urin (detekterar acetoacetat) jämfört med bedside-screening av blodketoner som mäter beta-hydroxibutyrat, den dominerande ketonkroppen vid eDKA [6, 7]. Balansen mellan glukosintag, hur mycket glukos som förloras via den SGLT2i-medierade glukosurin och hur mycket glukos levern förmår att producera som svar på den stress som utlöste ketoacidosen avgör om patienten uppvisar normo-, hyper- eller (i sällsynta fall) hypoglykemi. Vanligen är P-glukos vid SGLT2i-utlöst ketoacidos <14 mmol/l [4, 6].
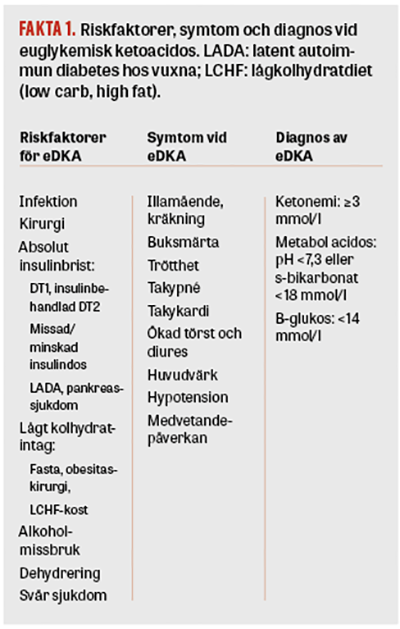
Riskfaktorer, symtom och diagnos
Risken för att utveckla ketoacidos är kraftigt förhöjd vid situationer när kroppen utsätts för stress, till exempel kirurgi, infektion eller svår sjukdom, se Fakta 1 [7, 17]. Situationer som bidrar till relativ insulinbrist, liksom situationer som bidrar till hypovolemi, kan i kombination med SGLT2-hämmare utlösa ketoacidos [3, 25]. Hämning av SGLT2, liksom kirurgi och infektion, påverkar både plasmavolym och plasmainsulin/glukagonkvoten. Den förmodade mekanismen bakom uppkomst av eDKA beskrivs i Figur 1 [2, 26]. SGLT2i-utlöst ketoacidos är vanligen, liksom metforminutlöst laktacidos, en metabol acidos med högt anjongap (anjongap = Na – [Cl + HCO3]) och det är möjligt men ej klarlagt att kombinationen metformin och SGLT2-hämmare ökar risken för ketoacidos [10, 27]. Vanliga symtom vid ketoacidos är illamående, kräkning, buksmärta och takypné [2]. Ketoacidos kan imitera såväl akut buk och infektion som förväntat postoperativt illamående. Diagnosen riskerar att försenas samt tillskrivas annan orsak, till exempel urinvägsinfektion, pneumoni, perioperativ blödning eller annan anledning till acidos, då symtomen är överlappande och screening för ketonemi inte vanligen ingår i rutinen. Det krävs en hög grad av misstänksamhet och aktiv screening för blodketoner vid risksituationer för att inte missa diagnosen [4, 7].
Förebyggande av euglykemisk ketoacidos
För att förebygga eDKA bör vi känna till tillståndet, sätta ut SGLT2-hämmare i risksituationer till exempel vid infektion eller inför kirurgi samt screena för blodketoner i risksituationer eller vid symtom på eDKA oavsett blodglukosnivå. Vi bör informera våra patienter om vikten av tillfällig utsättning vid infektion, operation, lågt kolhydratintag eller risk för uttorkning [12]. Om utsättning av SGLT2-hämmare inte hunnits med i god tid före operation (3–4 dygn) kan en långsam insulininfusion inom 24 timmar efter kirurgi troligen förebygga eDKA [24]. Undvik plötsliga dosminskningar av insulin till exempel i samband med kirurgi eller vid insättning av SGLT2-hämmare [17, 29]. Motverka postoperativt illamående och kräkningar proaktivt, stimulera till ätande och ge vid behov, när fasta eller lågt intag per os blir mer långvarigt, insulin- och dextros/glukosinfusion [7]. Undvik förskrivning av SGLT2-hämmare utanför godkänd indikation till patienter med typ 1-diabetes eller annan absolut insulinbrist, till exempel LADA (latent autoimmun diabetes hos vuxna) eller pankreassjukdom. Undvik SGLT2-hämmare i samband med lågkolhydratdiet eller alkoholberoende [1, 27].
Utsättning av SGLT2-hämmare minst 3 dygn före operationsdagen har visat sig förebygga eDKA [4, 27]. Perioperativt insjuknande i eDKA sker oftast i nära anslutning till operation (<2–3 dygn), men fall kan förekomma flera veckor efter operation [6]. I majoriteten av fallen har SGLT2-hämmare utsatts mindre än 3 dygn före operationsdagen [4]. Vid obesitaskirurgi gör en lång fasta, lågkolhydratdiet och kraftig postoperativ lipolys patienten extra sårbar för eDKA och motiverar utsättning 1–2 veckor preoperativt. Detta motsvarar tiden effekten kan hålla i sig hos vissa individer (<2 veckor) [4, 5, 27]. Behandling med ertugliflozin, som har längre halveringstid än kanagliflozin, empagliflozin och dapagliflozin, samt SGLT2-hämmare vid nedsatt njurfunktion motiverar ytterligare utsättning i god tid före operation (>3–4 dygn), då clearance-tiden kan vara förlängd [4, 7]. Glukosuri tyder på kvarvarande effekt av SGLT2-hämmare och motiverar blodketonscreening de närmaste dagarna postoperativt [7]. Även behandling med kombinationspreparat av SGLT2-hämmare och metformin, till exempel Synjardy, bör avbrytas minst 3 dygn före operation och 1–2 veckor före obesitaskirurgi. Med ett recept på enbart metformin kan patienten bättre bibehålla glykemisk kontroll genom att fortsätta med metformin fram till 1–2 dygn före operation.
Det är oklart hur länge eller ofta man ska screena för blodketoner i samband med en risksituation [6], men så länge patienten har bristfälligt intag per os är risken förhöjd, och med tanke på att ketoacidos oftast inträffar snart efter kirurgi bör blodketonscreening utföras dagligen hos inneliggande patient och avslutas först när eventuell ökning av ketoner vänt samt patienten mår väl och försörjer sig per os [7, 30]. Återinsättning av SGLT2-hämmare bör inte ske innan patienten försörjer sig per os, återfått en för individen normal GFR och inte har några tecken på acidos [7, 17].
Sammanfattning
Användningen av SGLT2-hämmare ökar, och det medför att även mindre vanliga men allvarliga biverkningar behöver förebyggas och hanteras. Risken för att utveckla euglykemisk ketoacidos är förhöjd under behandling med SGLT2-hämmare. Av 1 000 behandlade patienter kommer under ett år 0,6–4,9 att drabbas av eDKA. eDKA manifesterar sig ofta med nära normalt blodsocker och till en början vaga symtom som trötthet, illamående och buksmärta, vilket gör att rätt diagnos fördröjs eller aldrig ställs. Kännedom om eDKA är väsentlig för tidig diagnos och därmed undvikande av onödiga utredningar, ingrepp, förlängd sjukhusvistelse och i värsta fall död. För att upptäcka eDKA bör vi oavsett blodsocker screena för blodketoner vid risksituationer som kirurgi, infektion, lågt kolhydratintag, dehydrering eller akut sjukdom samt vid symtom på eDKA hos patient som behandlas med SGLT2-hämmare. För att förebygga eDKA föreslår vi att dessa sätts ut 3–4 dygn före operation (1–2 veckor före obesitaskirurgi) samt vid infektion, lågt kolhydratintag, dehydrering eller akut sjukdom. Vid misstänkt eller konstaterad insulinbrist bör SGLT2-hämmare undvikas. Om man inte kunnat sätta ut SGLT2-hämmare i god tid inför operation kan eventuellt en långsam lågdos-insulininfusion förebygga eDKA. Undvik plötslig dosminskning av insulin perioperativt eller vid insättning av SGLT2-hämmare.
Läs även:
Medicinsk kommentar: SGLT2-hämmare – bra för hjärta och njurar men tänk på riskerna
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2024-02-23)