Anaplastisk och lågt differentierad tyreoideacancer är sällsynta tumörer med snabb sjukdomsprogress och dålig prognos.
Hittills har behandlingen syftat till att uppnå lokal kontroll med radiokemiterapi och därefter kirurgi.
Nya framsteg inom tumörpatologi, molekylärpatologisk analys samt målriktade läkemedel medför att patienter med anaplastisk och lågt differentierad tyreoideacancer sannolikt nu kan behandlas mer framgångsrikt.
Primär kirurgi är aktuell för patienter med resekabla tumörer utan fjärrmetastaser, och kombinationsbehandling med kinashämmare bör vara förstahandsval vid påvisad BRAFV600E-mutation.
Akut multidisciplinär handläggning är avgörande för optimal onkologisk behandlingsplanering.
Årligen diagnostiseras cirka 700 patienter med sköldkörtelcancer i Sverige. Vanligen rör det sig om differentierad tyreoideacancer, som generellt har mycket god prognos. Anaplastisk tyreoideacancer (ATC) och lågt differentierad tyreoideacancer (PDTC) är sällsynta varianter av högmalign sköldkörtelcancer som växer lokalt infiltrativt, metastaserar tidigt och har hög dödlighet. Eftersom ICD-koden är densamma för all tyreoideacancer kan man inte skilja ut anaplastisk tyreoideacancer från övrig tyreoideacancer i Cancerregistret. Enligt det kirurgiska kvalitetsregistret SQRTPA (Scandinavian quality register for thyroid, parathyroid and adrenal surgery; https://sqrtpa.se/) opereras 25–30 patienter för anaplastisk tyreoideacancer varje år, och motsvarande siffra från Nationellt kvalitetsregister för tyreoideacancer [1] är 15–20 fall årligen. Att siffrorna skiljer sig åt kan delvis förklaras av varierande täckningsgrad, men incidensen ligger sannolikt högre eftersom många patienter aldrig blir aktuella för kirurgi. Incidensen av lågt differentierad tyreoideacancer är ännu lägre. Det är dock viktigt att beakta möjligheten av anaplastisk tyreoideacancer vid varje snabbväxande tumör på halsen, eftersom handläggningen kräver snabbt omhändertagande.
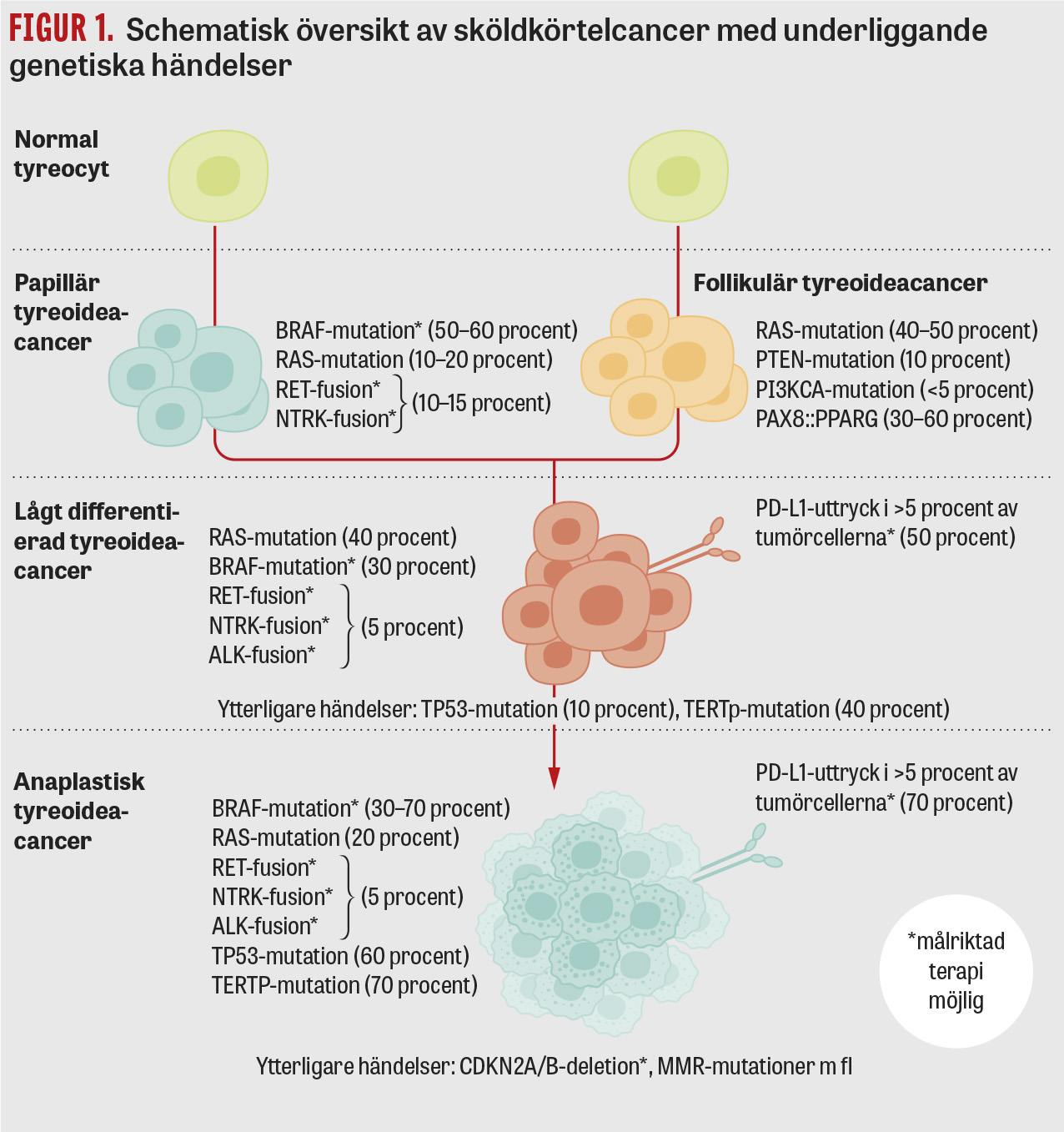
Förutom hög ålder finns inga kända riskfaktorer för anaplastisk/lågt differentierad tyreoideacancer. I motsats till differentierad tyreoideacancer saknar de samband med exponering för radioaktiv strålning. För båda diagnoserna gäller att flertalet fall utgår från en befintlig differentierad tyreoideacancer genom stegvis ökat antal mutationer [2] (Figur 1). Prognosen för anaplastisk tyreoideacancer är historiskt mycket dålig, med en medianöverlevnad på <12 månader [3]. I Sverige har behandlingsregimen fram till nu varit nästan uteslutande palliativt inriktad för lokal kontroll av tumörväxt på halsen, och patienten dör oftast av metastaserande sjukdom. Lågt differentierad tyreoideacancer ger inte ett lika dramatiskt insjuknande som anaplastisk tyreoideacancer, men långtidsmortaliteten är hög [4].
Klinisk bild. Sköldkörtelcancer upptäcks oftast då patienten söker vård på grund av en palpabel knöl på halsen [5]. De flesta patienter med anaplastisk tyreoideacancer har en hastig debut med snabbt (inom dagar/veckor) tillväxande resistens på halsen. Andra kan ha ett mer långsamt förlopp. Handläggning av patienter med misstänkt anaplastisk tyreoideacancer ska alltid betraktas som ett akut onkologiskt ärende [5]. I sammanhanget är det viktigt komma ihåg att >90 procent av palpabla förändringar i sköldkörteln är benigna (till exempel follikulärt adenom eller follikelnodös sjukdom) och att differentierad tyreoideacancer vanligen är långsamt växande tumörer som inte kräver snabbutredning.
Nya behandlingsmöjligheter. Den senaste forskningen visar att både molekylär diagnostik och målinriktad behandling av patienter med anaplastisk/lågt differentierad tyreoideacancer genomgått betydande förändringar som inger hopp om förbättrad sjukdomskontroll för denna hårt drabbade patientgrupp. Mot bakgrund av att det nationella vårdprogrammet för sköldkörtelcancer (Regionala cancercentrum i samverkan; 2021), som i första hand rekommenderar diagnostik med cytologi och primär accelererad strålbehandling med samtidiga cytostatika följd av avlastande kirurgi, ännu saknar rekommendationer avseende detta, sammanfattar vi här det aktuella kunskapsläget samt föreslår en uppdaterad handläggningsplan i konsensus med internationella riktlinjer baserad på data från de senaste kliniska fas 1- och 2-studierna. Den viktigaste utvecklingen som diskuteras närmare i denna artikel baseras på systemisk behandling med BRAF-/MEK-hämmare som även gett oss insikter om betydelsen av primär kirurgi vid resekabla tumörer.
I väntan på att det nationella vårdprogrammet för sköldkörtelcancer revideras är det viktigt att det multidisciplinära teamet som ansvarar för patienter med anaplastisk tyreoideacancer redan nu kan arbeta efter riktlinjer och rekommendationer som stämmer överens med det senaste kunskapsläget och att samtliga vårdgivare som kan komma i kontakt med patienter med anaplastisk eller lågt differentierad tyreoideacancer får möjlighet att uppdatera sig om dessa framsteg. I författarlistan ingår representanter för det nationella vårdprogrammet för sköldkörtelcancer.
Tumörbiologi och kliniska tumörstadier
Histologiska och molekylära kännetecken. Anaplastisk tyreoideacancer är en odifferentierad tumör med varierande kärnstorlek, utbredd förekomst av mitoser, nekros och invasiv växt. Olika histologiska undergrupper (rabdoid, sarkomatös, jättecellsvariant) förekommer och kan ibland förväxlas morfologiskt med lymfom, angiosarkom eller metastaser. Immunoreaktivitet mot vanliga tyreoideamarkörer (TTF1, PAX8 och tyreoglobulin) saknas. Vid tveksamheter kring diagnosen kan eftergranskning av subspecialiserad cytolog och patolog vara av stort värde.
ATC/PDTC som utgår från papillär tyreoideacancer är ofta BRAF-driven, medan ATC/PDTC som utvecklas från follikulär cancer många gånger uppvisar RAS-mutationer (Figur 1). Inaktiverande mutationer som är kopplade till tumörprogression, främst avseende TP53, TERT-promotorn och CDKN2A/B [5-7], är vanliga. Ingen enskild känd molekylär förändring särskiljer anaplastisk från lågt differentierad tyreoideacancer.
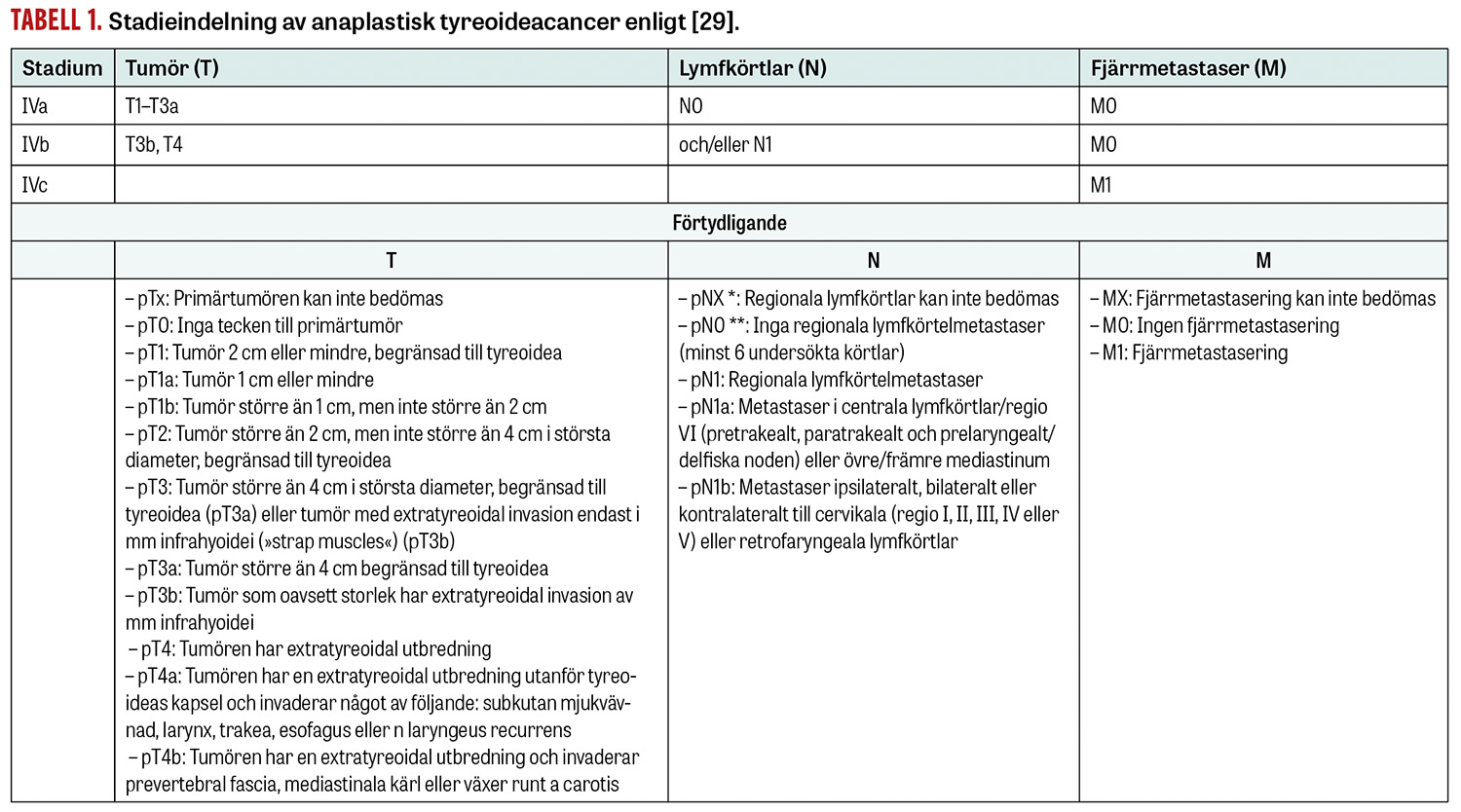
Stadieindelning. På grund av den mycket dåliga prognosen stadieindelas anaplastisk tyreoideacancer i stadium IVa–c (Tabell 1). Stadium IVa inkluderar primärtumör som är helt begränsad till tyreoidea (≤T3a) och saknar lymfkörtelmetastaser. Stadium IVb inkluderar primärtumörer med extratyreoidal växt och/eller lymfkörtelmetastaser på halsen, medan stadium IVc innebär att det finns fjärrmetastaser. En större ATC-fallserie klassade 11 procent som stadium IVa, 36 procent som IVb och 53 procent som stadium IVc vid diagnos [3].
Lågt differentierad tyreoideacancer stadieindelas på samma sätt som differentierad tyreoideacancer och redovisas ej närmare här [8].
Handläggning och diagnostik
Vid misstanke om anaplastisk tyreoideacancer ska patienten utredas skyndsamt, och vid konstaterad sjukdom ska behandling påbörjas snarast (<48 timmar) utan att standardiserat vårdförlopp initieras. Socialstyrelsen har beslutat att avancerad sköldkörtelcancer inte ska bli föremål för nationell högspecialiserad vård. Däremot rekommenderas nivåstrukturering av patientgruppen till en enhet inom respektive sjukvårdsregion, och därmed bör patienter omedelbart remitteras till närmaste sjukhus med högspecialiserad enhet för sköldkörtelcancer för multidisciplinär handläggning och behandlingsplanering.
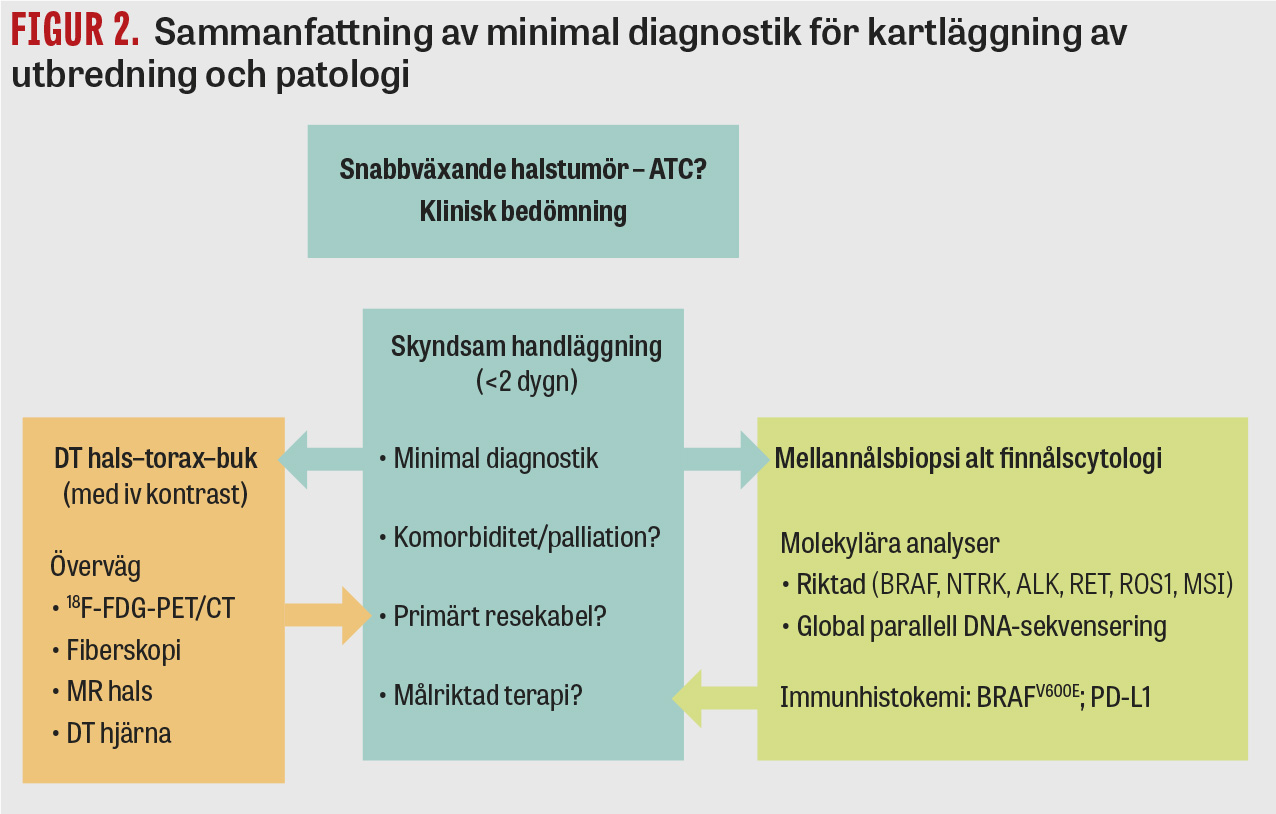
Figur 2 sammanfattar minimal diagnostik för att kartlägga sjukdomens utbredning och patologi som underlag för beslut om bästa behandlingsstrategi.
Minimal bilddiagnostik vid misstänkt ATC. DT hals–torax–buk med intravenös kontrast är förstahandsvalet för kartläggning av sjukdomsstadium. Vid neurologiska symtom som inger misstanke om hjärnmetastaser bör DT eller MR hjärna utföras. I de fall där primär kirurgi övervägs (se nedan) är 18F-FDG-PET/DT viktig för att bedöma spridning som inte tydligt framgår av DT. Undersökning med MR av halsen ger likvärdig information som DT hals.
Diagnosen lågt differentierad tyreoideacancer ställs först postoperativt genom rutinhistologisk undersökning av tumörmaterialet. Varken radiologi eller cytologi är primärt vägledande för att diagnostisera lågt differentierad tyreoideacancer.
Analyser vid misstänkt ATC och recidiverande PDTC. Diagnosen anaplastisk tyroideacancer kan ställas med finnålscytologi eller mellannålsbiopsi. Baserat på dagens kunskapsläge rekommenderas i första hand mellannålsbiopsi som ger möjlighet till analys av behandlingsprediktiva markörer för ATC/PDTC enligt följande prioritering:
1. Immunhistokemi med BRAF-VE1-antikropp, som har hög sensitivitet och specificitet för BRAFV600E-mutation, vilken förekommer hos 30–70 procent av patienterna med ATC [9].
2. Immunhistokemi för PD-L1 (programmed death ligand 1). 10–30 procent av ATC-tumörer visar starkt membranuttryck av PD-L1 i tumörceller eller lymfocyter. Olika PD-L1-antikroppar förekommer, till exempel klonerna SP263, 22C3, SP142 och E1L3N, men inga rekommendationer avseende klon vid just ATC-analys föreligger ännu.
3. Fokuserad parallell DNA-sekvensering för BRAF-mutationer och ALK/RET/NTRK-fusioner, där de sistnämnda har låg prevalens i ATC/PDTC men är av starkt behandlingsprediktivt värde. Molekyläranalys av mikrosatellit-instabilitet och tumörmutationsbörda kan även vara av värde inför immunmodulerande behandling.
Nya möjligheter vid anaplastisk tyreoideacancer
Det är avgörande att alla patienter med anaplastisk tyreoideacancer handläggs multidisciplinärt för att snabbast möjligt komma fram till en individuell behandlingsstrategi. Teamet består av specialister inom tyreoideakirurgi, onkologi, patologi och radiologi. Detsamma gäller för patienter med lågt differentierad tyreoideacancer och avancerad tumör vid diagnos eller progredierande sjukdom efter primär kirurgi. Lokal tumörkontroll är fortsatt avgörande för att förhindra att tillväxt av primärtumören eller lymfkörtelmetastaser komprimerar trakea, esofagus och/eller stora halskärl och hotar vitala funktioner.
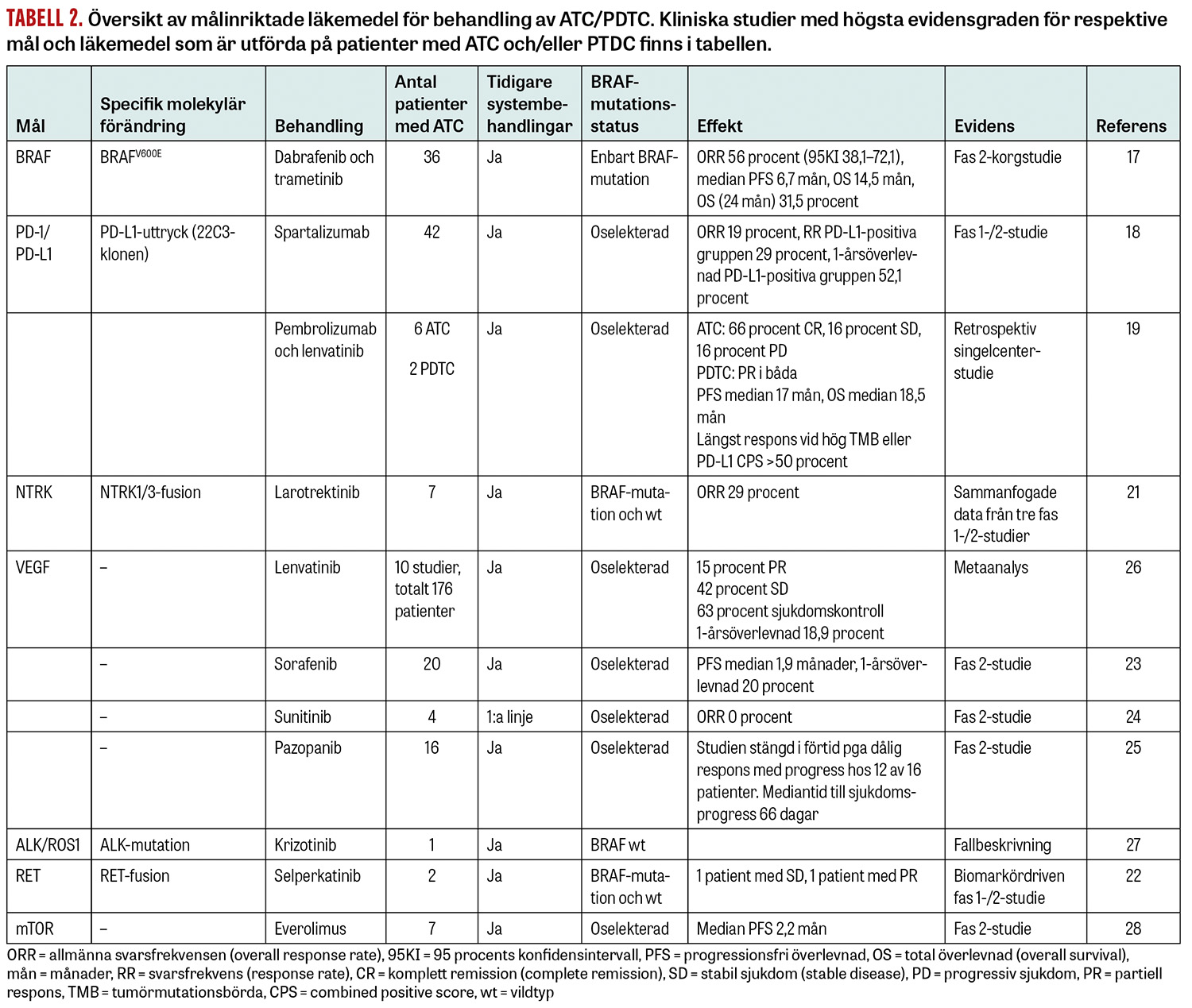
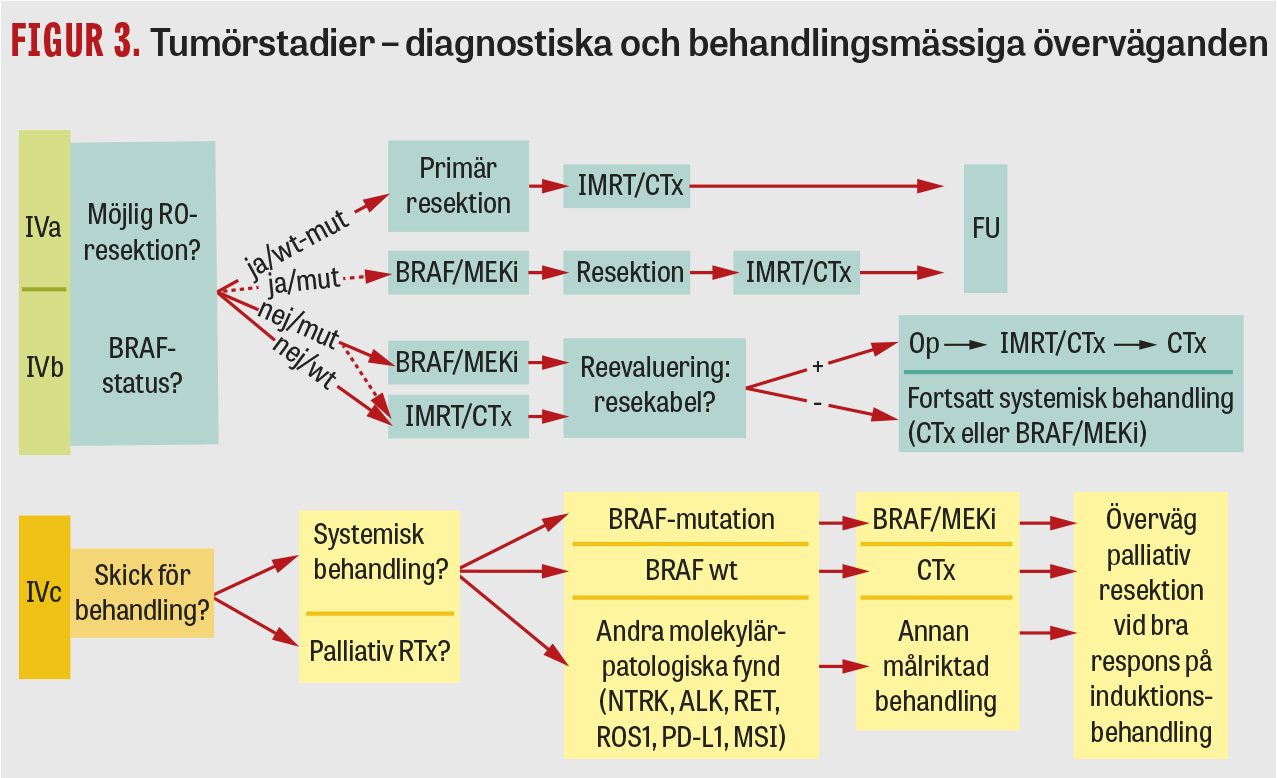
Vi sammanfattar här diagnostiska och behandlingsmässiga överväganden och diskuterar tillämpningen av de specifika behandlingsmodaliteterna strålbehandling, cytostatika och målriktande läkemedel i detalj (Figur 3, Tabell 2).
Tumörstadium IVa eller IVb. Primär kirurgi: resekabilitet bedöms utifrån genomförda radiologiska undersökningar, ibland kompletterad med laryngotrakeoskopi och en samlad klinisk bedömning av erfaren kirurg. I retrospektiva kohorter har patienter som opererats radikalt en bättre långtidsöverlevnad jämfört med icke-opererade [5, 10]. Erfarenhetsmässigt utgör denna grupp en minoritet. Nyttan med kirurgi, utöver att uppnå långvarig sjukdomskontroll för ett fåtal, är framför allt palliativ.
Preoperativ behandling: extern strålbehandling i kombination med cytostatika syftar till att krympa en initialt icke-resekabel anaplastisk tyreoideacancer och underlätta en eventuell operation [11, 12]. Preoperativ kombinationsbehandling av BRAF-muterade tumörer med BRAF- och MEK-hämmare kan medföra snabb regress och möjliggöra kirurgi [13].
Halskirurgi vid anaplastisk tyreoideacancer innebär en ökad risk för komplikationer inklusive recurrensnervskador. Vid ensidig tumör finns ingen anledning för total tyreoidektomi; målet är i första hand att avlägsna primärtumör och lymfkörtelmetastaser radikalt. Vid radiologisk regress efter onkologisk behandling kan sekundär kirurgi övervägas. Man bör så långt som möjligt undvika trakeostomi, som ofta medför lokala komplikationer till men för patientens livskvalitet.
Tumörstadium IVc. Vid anaplastisk tyreoideacancer med spridd sjukdom är det angeläget att göra en noggrann avvägning mellan nytta och risk avseende aktiva behandlingsinsatser. Att avstå onkologisk behandling till förmån för »best supportive care« kan efter individuell bedömning i vissa fall vara rätt beslut, och där kan vårdprogrammet »Palliativ vård« ge vägledning [14].
Systemisk behandling med målinriktade läkemedel, särskilt BRAF-/MEK-hämmare, är potentiellt av stort värde för selekterade patienter med anaplastisk tyreoideacancer i stadium IVc och kan förlänga både progressionsfri och total överlevnad [3, 5].
Lokoregional tumörkontroll är mycket betydelsefull vid stadium IVc-sjukdom och kan uppnås genom lokoregional strålbehandling eller tumörreducerande kirurgi, särskilt om inga mutationer vägledande för målinriktad behandling kan påvisas.
Strålbehandling vid anaplastisk tyreoideacancer
Dosplanering. Datortomografi rekommenderas som underlag för 3D-dosplanering. Behandling ges med dynamisk teknik för att uppnå en effektiv dos till tumörområdet samt minimera risken för strålningsrelaterade biverkningar, men kan ges med en enklare dosplan med statiska fält när snabb strålstart bedöms viktig. Behandlingsvolymen inkluderar primärtumören, cervikala lymfkörtlar och fossa supraclavicularis bilateralt samt främre övre mediastinum.
Preoperativ extern strålbehandling. Förslagsvis ges hypofraktionerad behandling med 3 Gy per fraktion till slutdos 45 Gy med behandling 5 dagar per vecka med samtidiga cytostatika som strålsensibiliserande medel (se nedan).
Postoperativ extern strålbehandling. För patienter i ett tillräckligt bra allmäntillstånd kan strålbehandling upp till slutdos på 65–70 Gy, eventuell med veckovis cytostatikabehandling (se nedan), erbjudas. Retrospektiva kohortstudier har visat förlängd överlevnad vid anaplastisk tyreoideacancer med postoperativ strålbehandling eller radiokemoterapi efter R0/R1-resektion av primärtumören [15].
Extern strålbehandling vid stadium IVc. För att uppnå lokal kontroll, förebygga obstruktion och förhindra fistulering eller malign sårbildning kan strålbehandling mot tyreoideatumören och eventuella halslymfkörtelmetastaser med 5 Gy i 5 fraktioner till slutdos 25 Gy mot tumörområdet ges, med en rekommenderad marginal på 0,5 cm. Vid symtomgivande metastaser från andra lokaler kan sedvanlig palliativ strålbehandling erbjudas som vid andra cancersjukdomar.
Kemoterapi vid ATC och PDTC
Preoperativ cytostatikabehandling. Som förstahandsval av cytostatika konkomitant med strålbehandling rekommenderas paklitaxel 60 mg/m2 som ges veckovis (dag 1, 8, 15), alternativt doxorubicin 20 mg/vecka (dag 1, 8, 15). Det finns inga jämförande studier till stöd för det ena eller andra alternativet; val av preparat får styras av lokal erfarenhet och eventuella kontraindikationer.
Cytostatika har ingen etablerad plats för behandling av lågt differentierad tyreoideacancer.
Systemisk målinriktad behandling vid ATC och PDTC
BRAF-/MEK-kinashämmare. Kombinationsbehandling med specifika BRAF- och MEK-kinashämmare följer samma principer och protokoll som redan är etablerade för andra BRAF-muterade tumörer, till exempel metastaserat malignt melanom. Samtidig behandling med MEK-hämmare har visats motverka resistensutveckling mot BRAF-hämmare [16].
Relativt snabb tumörrespons kan förväntas. En fas 2-studie som inkluderade patienter med BRAFV600E-mutation oberoende av tumördiagnos visade en tydlig behandlingseffekt av BRAF-hämmaren dabrafenib (Tafinlar; 150 mg × 2) i kombination med MEK-hämmaren trametinib (Mekinist; 2 mg × 1) på tumörprogression [17]. I patientgruppen med anaplastisk tyreoideacancer (n = 36) hade 56 procent en objektiv tumörrespons på behandlingen, och 31,5 procent av patienterna levde efter 24 månader.
BRAF-/MEK-hämmare, i första hand dabrafenib/trametinib, har således en given plats i den terapeutiska arsenalen mot anaplastisk tyreoideacancer och bör övervägas till alla patienter med BRAF-drivande mutation oavsett tumörstadium enligt flödesschemat i Figur 3. För patienter med primärt resekabla tumörer (stadium IVa) kan förväntas att neoadjuvant terapi snabbt krymper primärtumören så att efterföljande kirurgi blir mindre omfattande. För patienter med lokalt avancerad sjukdom (stadium IVb) finns chans att behandlingen – om den ger tillräcklig regress av primärtumören – tjänar som en överbryggning till eventuell operation. Samma gäller för PDTC-patienter med BRAF-mutation. Även om resultaten verkar lovande bör det dock betonas att denna rekommendation baseras på icke-randomiserade fas 2-studier. Utöver detta är det ur ett hälsoekonomiskt perspektiv viktigt att nämna att behandling med dessa läkemedel är kostsam och bör ges till patienter med tillräckligt gott allmäntillstånd som förväntas kunna dra nytta av medicinerna.
Immunkontrollpunktshämmare. PD-1- och PD-L1-antikroppar är numera en hörnsten i systemisk behandling av många solida tumörer. Det finns ett fåtal rapporter om monoterapi och kombination med andra läkemedel vid ATC/PDTC. I en fas 2-studie erhöll 42 patienter med anaplastisk cancer, samtliga med sjukdomsprogress trots annan systemisk behandling, PD-1-hämmaren spartalizumab var 4:e vecka [18]. Svarsfrekvensen var 19 procent för hela gruppen och 35 procent hos patienter med ≥50 procent PD-L1-uttryck i primärtumören. Inga oförväntade behandlingsrelaterade biverkningar noterades.
Kombinationsbehandling med tyrosinkinashämmaren lenvatinib och PD-1-hämmaren pembrolizumab gav lovande behandlingsresultat för 8 patienter med anaplastisk cancer i en retrospektiv kohortstudie [19]. Vid ESMO-konferensen hösten 2022 presenterades fas 2-studien ATLEP där man prospektivt undersökte samma behandlingskombination med preliminärt jämförbara ännu opublicerade resultat [20]. Det är därför mycket väl möjligt att trippelbehandling med BRAF-/MEK-/PD-1-hämmare kan komma att få en betydelsefull roll vid behandling av anaplastisk tyreoideacancer när resultaten av pågående kliniska studier är validerade och publicerade.
Andra målinriktade läkemedel. Tabell 2 sammanfattar vad som hittills utvärderats i kliniska prövningar vid systemisk behandling av ATC/PDTC med hämmare av TRK (tropomyosinkinas), multireceptor-tyrosinkinaser, RET (rearranged during transfection), ALK (anaplastiskt lymfom-kinas) och mTOR (mammalian target of rapamycin). Behandlingseffekt har observerats för TRK- och RET-hämmare när motsvarande mutationer påvisats i tumören [21, 22]. Behandling med tyrosinkinashämmare, till exempel lenvatinib och sorafenib, som är etablerad vid radiojodrefraktär differentierad tyreoideacancer, har begränsad klinisk nytta för patienter med ATC/PDTC [23-25]. Dock har en metaanalys visat upp till 63 procents sjukdomskontroll av lenvatinib för sammanlagt 176 patienter [26], vilket talar för användbarhet i selekterade fall.
Radiojodbehandling vid PDTC
Systemisk behandling med radioaktivt jod (I-131) har ingen plats vid anaplastisk tyreoideacancer eftersom tumörcellerna saknar jodupptag. Patienter med lågt differentierad tyreoideacancer kan ha behandlingsnytta av adjuvant radiojodbehandling, som då ges upprepat efter total tyreoidektomi enligt gängse rutiner för motsvarande behandling av differentierad tyreoideacancer. Behandlingsaktiviteten är 3,7 GBq upp till 7,4 GBq vid metastaser. Spårämnesupptag på postterapeutisk skintigrafi och nedgång i tyreoglobulinnivåer är tecken på behandlingsrespons och att upprepad radiojodbehandling är indicerad.
Sammanfattande diskussion
Molekylärgenetikens införande i den moderna patologin samtidigt med utvecklandet av skräddarsydd medicinering har revolutionerat cancervården. Diagnoser som förr uppvisade mycket hög mortalitet vid fjärrspridning är ibland botbara, och utvecklingen går framåt med stormsteg. För patienter med anaplastisk tyreoideacancer är prognosen fortsatt dyster, med en mycket hög mortalitet, och behandlingen är främst palliativt inriktad. Individanpassad diagnostik har dock möjliggjort identifiering av molekylära förändringar som lämpar sig utmärkt för målinriktad terapi, ibland med häpnadsväckande resultat. I denna översikt belyser vi vikten av proaktiv diagnostik med mutationsanalys för att kunna optimera behandlingen av snabbväxande högmaligna tumörer i sköldkörteln. Vi presenterar ett detaljerat flödesschema för handläggning främst avseende patienter med anaplastisk tyreoideacancer, som kommer att ligga till grund för en uppdatering av vårdprogrammet för samma patientgrupp. Den snabba utvecklingen inom området förutsätter att flödesschemat ses som ett »levande« dokument som uppdateras fortlöpande. Förhoppningen är att varje regionalt centrum för avancerad tyreoideacancer medverkar i den processen i syfte att förbättra vården för alla patienter med denna sällsynta och ännu illavarslande diagnos.
Mikael Nilsson är ordförande för Cancerfondens planeringsgrupp för sköldkörtelcancer. Jakob Dahlberg är ordförande för Nationellt vårdprogram för sköldkörtelcancer.
Potentiella bindningar eller jävsförhållanden: Renske Altena erhåller föreläsningsarvode av Mediahuset AB. Jan Zedenius är oavlönad medicinsk rådgivare för Akiram AB.
(uppdaterad 2024-05-07)