Kammartakykardier (VT) hos strukturellt hjärtsjuka patienter är ofta direkt livshotande.
Preventiv implantation av defibrillator (ICD) är indicerad hos de flesta VT-patienter med strukturell hjärtsjukdom.
Ablationsbehandling av VT är effektiv för att minska arytmirecidiv och framtida ICD-tillslag.
VT-ablation är ett komplext ingrepp som kräver ett multidisciplinärt samarbete på centrum med adekvata resurser och erfarenhet.
Lyckandefrekvens och risker varierar beroende på patientens underliggande hjärtstatus.
Vi analyserade våra egna VT-ablationer under perioden 2021–2022 och fann 18 procents recidivrisk efter 20 månaders uppföljning av 60 patienter. Två allvarliga komplikationer inträffade.
Andelen subakuta VT-ablationer vid arytmistorm var hög (63 procent), vilket är kopplat till ökad ingreppsrisk och större behov av vårdresurser jämfört med elektiv VT-ablation i ett tidigare skede av sjukdomsförloppet.
Kammartakykardi eller ventrikeltakykardi (VT) föreligger vid 3 på varandra följande extraslag från kammaren med en hjärtfrekvens över 100 per minut. En VT kallas för »ihållande« när den fortgår i över 30 sekunder. VT förekommer både hos strukturellt hjärtfriska patienter och vid strukturell hjärtsjukdom. VT hos hjärtfriska patienter har i regel en godartad prognos, men vid underliggande hjärtsjukdom, till exempel hos patienter med hjärtinfarkt, kan en VT vara livshotande och är därför en vanlig orsak till plötslig död. För att minska risken för VT är det viktiga att noga behandla den underliggande hjärtsjukdomen. Många patienter med strukturell hjärtsjukdom som haft en VT eller som bedöms ha en särskilt ökad risk att utveckla VT skyddas i dag med en implanterbar defibrillator (ICD). Därutöver används ofta ett antiarytmiskt läkemedel, amiodaron, för att minska risken för återfall i VT. Båda dessa behandlingar är dock begränsade genom olika biverkningar. Under de senaste åren har kateterburen ablationsbehandling av VT (»VT-ablation«) utvecklats till ett värdefullt behandlingsalternativ. Det finns i nuläget inga publicerade resultat av VT-ablation i Sverige. Denna artikel vill ge en aktuell översikt över möjligheter och risker med VT-ablation. Vi rapporterar även egna resultat av VT-ablation hos patienter med strukturell hjärtsjukdom.
Arytmimekanism
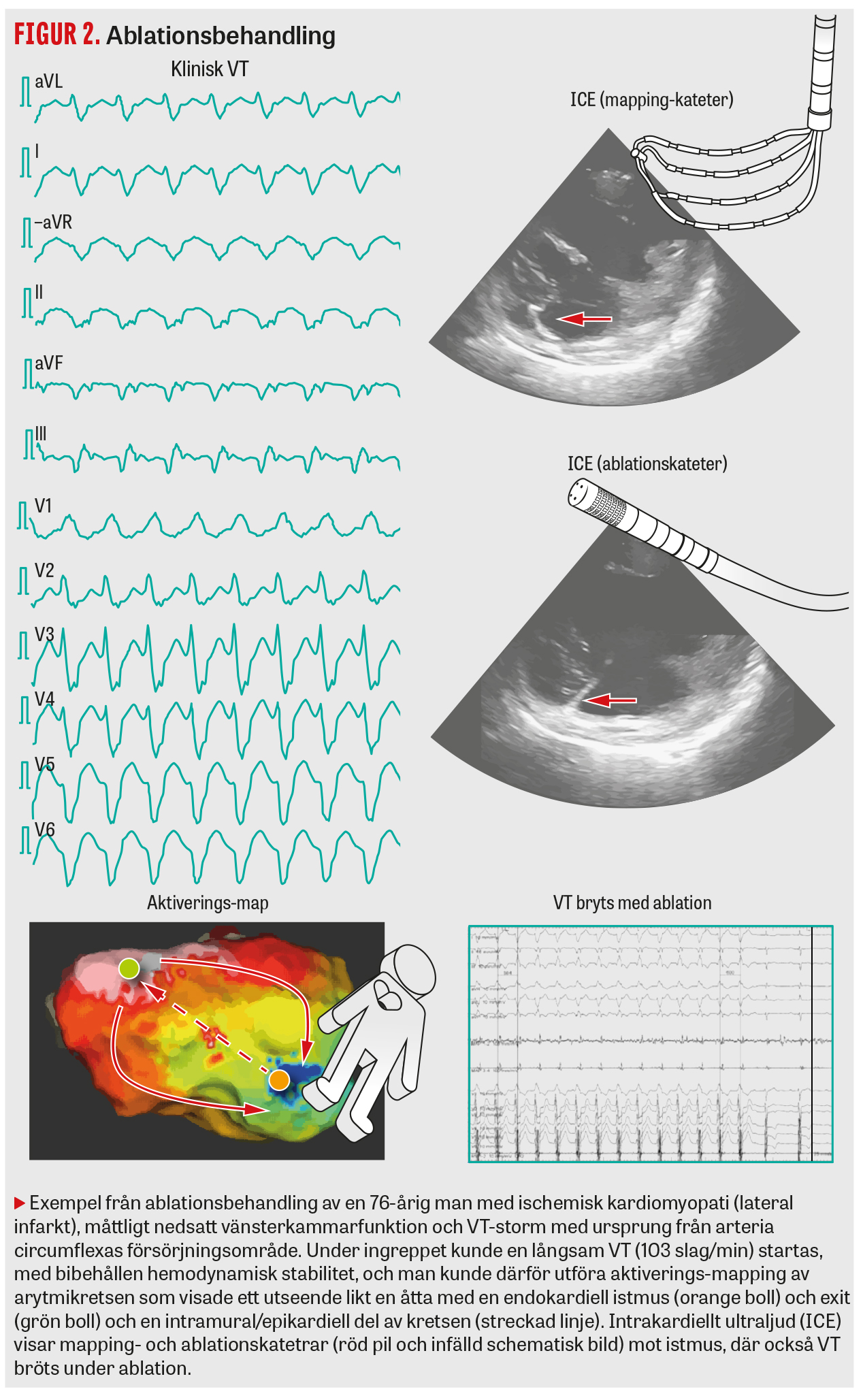
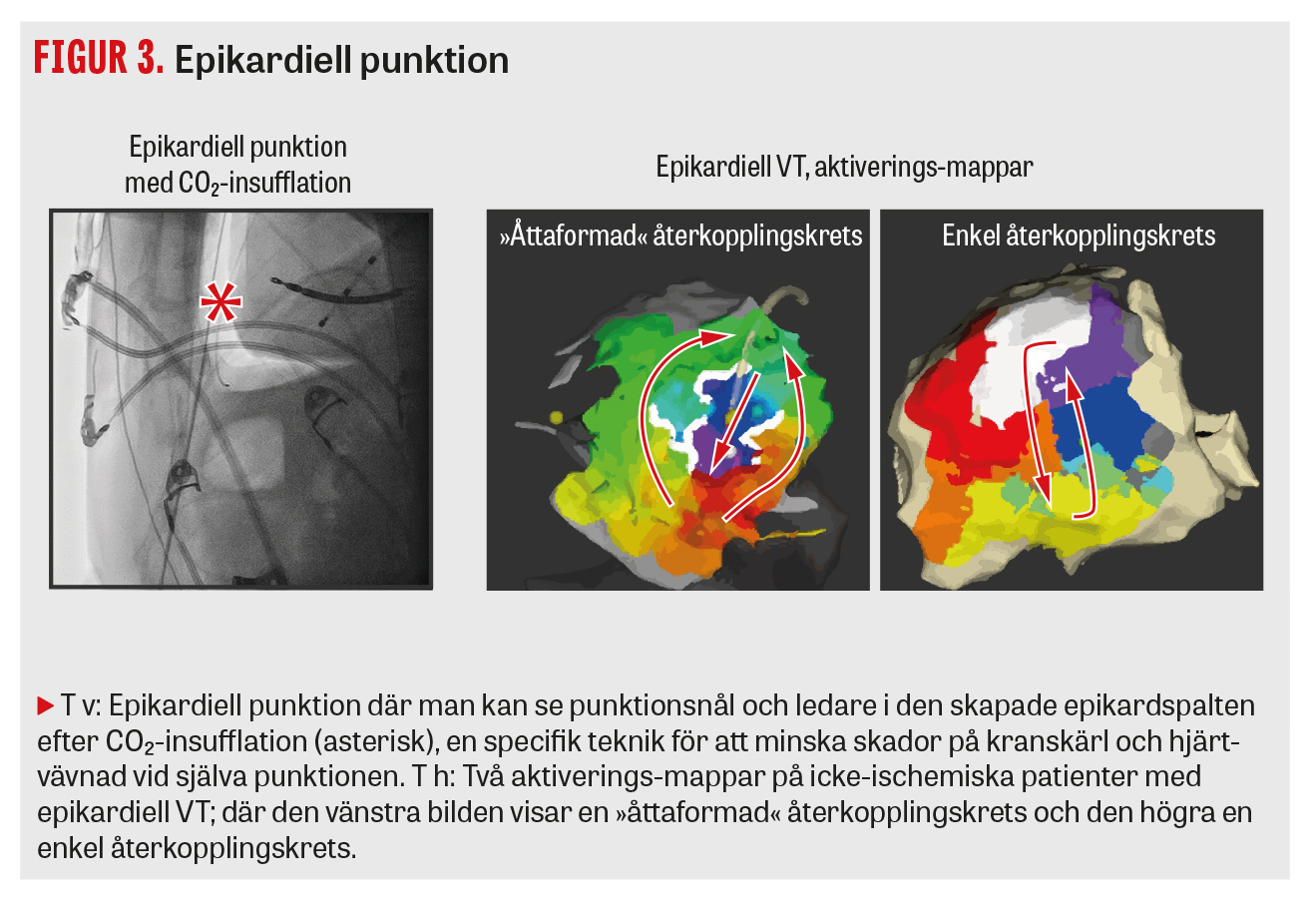
Arytmimekanismen vid VT hos patienter med strukturell hjärtsjukdom är vanligtvis en elektrisk återkopplingskrets som uppstår i områden med ärrvävnad (fibros), till exempel efter en tidigare genomgången hjärtinfarkt. Liknande ärr som substrat för VT kan även förekomma hos patienter utan tidigare hjärtinfarkt, såsom vid icke-ischemisk dilaterad kardiomyopati, efter tidigare hjärtmuskelinflammation eller vid mer sällsynta tillstånd såsom hjärtsarkoidos eller arytmogen högerkammarkardiomyopati. Överlevande myokardfibrer i ärrområden utgör i dessa fall substrat för återkopplingskretsar som kan ge upphov till regelbundna VT som är »monomorfa« på EKG (QRS-komplexen har samma utseende) [1]. Den klassiska återkopplingskretsen vid VT med ärrsubstrat ser vanligen ut som en åtta, med en skyddad istmus som bryter ut i friskare myokard, och ger upphov till ett specifikt EKG-utseende [2].
Klinisk presentation
Den kliniska presentationen vid VT är varierande, från en enstaka arytmiepisod med relativt få symtom och spontan terminering till svår hemodynamisk påverkan, degeneration till kammarflimmer och plötslig död. Hos patienter med ICD kan VT utlösa behandling med elektrisk chock, vilket ofta upplevs som plågsamt och indikerar ökad risk för upprepade VT, försämring av den underliggande hjärtsjukdomen och dålig prognos. En ICD kan även ge värdefull information om arytmibördan och uppmärksamma förekomst av VT som inte leder till chockbehandling. Så kallad »VT-storm« (≥3 VT-episoder inom ≤24 timmar) innebär att patienten drabbas av upprepade VT-episoder. Detta är ett allvarligt tillstånd som kräver akut specialiserat omhändertagande.
Polymorf VT (QRS-komplex med olika utseenden) eller kammarflimmer förekommer mer sällan och påträffas först och främst i samband med akut hjärtinfarkt (vilket är skälet till att akut hjärtinfarkt fortfarande innebär en hög risk för plötslig död), men kan även inträffa vid andra situationer som akut myokardit, långt QT-syndrom, Brugadas syndrom och elektrolytrubbningar. Polymorf VT (eller kammarflimmer)-storm kan även uppstå efter den akuta fasen vid hjärtinfarkt och kan då leda till en kritisk klinisk situation där ablationsbehandling kan vara den enda effektiva behandlingen [3].
Behandlingsrekommendationer
Riktlinjerna för behandling av VT hos patienter med strukturell hjärtsjukdom utgivna av den europeiska kardiologföreningen rekommenderar ICD för denna patientgrupp (klass I-indikation med evidensnivå A) [4]. ICD är ett effektivt skydd mot plötslig död men förhindrar inte uppkomsten av arytmier. Antiarytmikabehandling vid strukturell hjärtsjukdom är begränsad till betablockad, amiodaron och sotalol, som i många fall är ineffektiva eller har begränsad nytta på grund av allvarliga biverkningar [5].
Ablationsbehandling av VT har ofta använts vid upprepade arytmier (VT-storm), och studier visar på relativt goda resultat i denna patientgrupp (68 procent arytmifrihet efter 1 år i en stor retrospektiv multicenterstudie) [6]. Hos VT-patienter med ischemisk hjärtsjukdom och ICD har två randomiserade studier (Smash-VT och VTACH) rapporterat att VT-ablation minskar antalet ICD-chocker och VT-recidiv jämfört med standardbehandling (enbart ICD) [7, 8].
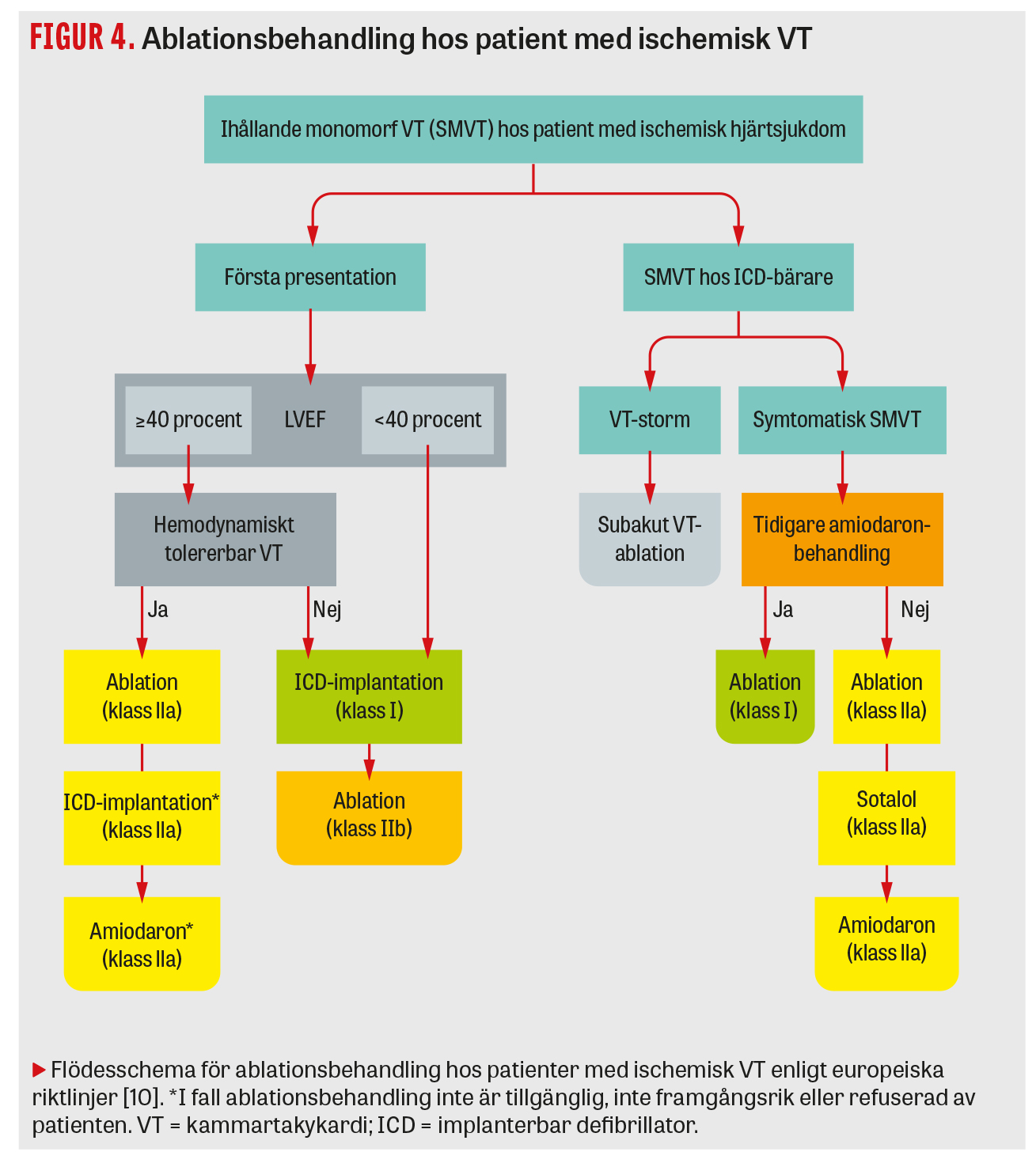
En tredje studie (Vanish) på patienter som utvecklade VT trots pågående antiarytmisk läkemedelsbehandling visade att VT-ablation minskade risken för död, ICD-chock och VT-storm jämfört med utökad antiarytmikabehandling [9]. De senaste europeiska riktlinjerna har därför förstärkt indikationen för ablationsbehandling hos patienter med ischemisk hjärtsjukdom: a) ablation jämställs med amiodaron för ICD-patienter med symtomatisk VT och rekommenderas i första hand när amiodaron inte har effekt; b) ablation kan utföras utan ICD-implantation hos patienter med hemodynamiskt stabil VT och LVEF (ejektionsfraktion från vänsterkammaren) >40 procent (Figur 4). För icke-ischemisk VT finns fortfarande inga specifika randomiserade studier, men observationella data pekar på en sämre lyckandefrekvens än vid ischemisk VT, varför ablation rekommenderas först efter amiodaronbehandling (indikation IIa). Anledningen till lägre lyckandefrekvens hos dessa patienter är att arytmisubstratet ofta är beläget i mitten (intramuralt) eller på utsidan (epikardiellt) av hjärtmuskeln, och således mer svåråtkomligt än vid ischemisk hjärtsjukdom, då det oftare är lokaliserat i hjärtmuskelns insida (endokardiellt).
Efter de europeiska riktlinjerna publicerades nyligen Partita-studien, där patienter med strukturell hjärtsjukdom och ICD randomiserades till VT-ablation eller standardbehandling efter att de drabbades av sin första ICD-chock för VT [10]. Studien, som avbröts i förtid, visade en signifikant mortalitetsreduktion i gruppen med VT-ablation. Partita-studien har således för första gången visat på en mortalitetsvinst om VT-ablation utförs i ett relativt tidigt skede av sjukdomsförloppet. Man bör dock vara försiktig i tolkningen av dessa resultat, då det var få patienter som dog i standardbehandlingsgruppen, och merparten dessutom av icke-kardiella dödsorsaker. Slutligen bör det nämnas att de europeiska riktlinjerna poängterar vikten av att VT-ablation centraliseras till högspecialiserade enheter då det rör sig om ett tekniskt komplext ingrepp med allvarliga ingreppsrelaterade risker.
VT-ablation
Det primära målet med ablationsbehandlingen är att eliminera den kritiska delen (istmus) av återkopplingskretsen. I regel föreligger ett flertal arytmisubstrat samtidigt i ett ärrområde, vars kartläggning och ablation kräver stor operatörsvana och avancerat teknikstöd. Det är viktigt att betona den stora vikten av ett välfungerande multidisciplinärt perioperativt samarbete med narkos, intensivvård, bildgivande diagnostik, specialister i hjärtsvikt, ischemisk hjärtsjukdom, kranskärlsröntgen, ICD-behandling, omvårdnad och hälsoprofessioner.
Förberedande undersökningar
EKG och bildundersökning
12-avlednings-EKG är ett viktigt underlag inför planering av ablationsingreppet. En noggrann analys av EKG i sinusrytm kan avslöja misstänkta arytmisubstrat, exempelvis Q-vågor vid genomgången infarkt eller PQ-förlängning vid substrat från kamrarnas skiljevägg (septum). Ett EKG taget under VT ger värdefull information om återkopplingskretsens lokalisation [11]. Basalt hjärtultraljud görs för bedömning av vänsterkammarfunktionen (LVEF), vilket är viktigt för uppskattning av ingreppsrisken samt ger information om regionala rörelseförändringar där arytmisubstratet kan vara beläget. Undersökningen visar även förekomst av kammartromb, vilket kan påverka ablationsplanen (inläggning av karotisartärfilter eller endast epikardiell ablation). Magnetkameraundersökning ger mer detaljerad information om vävnadskarakteristik och är speciellt intressant vid icke-ischemisk VT, som ofta har intramurala eller epikardiella substrat. Datortomografi kan också ge information om substrat (väggförtunningar), kranskärlsanatomi och även närliggande extrakardiella strukturer (lunga, lever och kolon) vid en eventuell epikardiell punktion.
Kranskärlsröntgen
I de flesta fall är kranskärlsröntgen inte indicerad, då VT-patienter med ischemisk hjärtsjukdom sällan har akut koronarsyndrom. En nyligen publicerad studie har visat att kranskärlsröntgen i det akuta skedet inför ablation hos patienter med VT-storm (monomorf VT) utan tecken till akut koronarsyndrom inte förbättrar ablationsresultatet [12]. Speciellt bör implantation av stent i icke kliniskt relevanta kranskärlslesioner undvikas, då dubbel antiaggregationsbehandling då initieras med ökad blödningsrisk vid ablationstillfället som följd. Kranskärlsröntgen används ofta vid epikardiella ingrepp för att kartlägga kärlanatomin.
Uppskattning av ingreppsrisk och behov av cirkulatoriskt stöd
Risken för hemodynamisk instabilitet under ingreppet värderas med hjälp av skattningsskalan PAINESD, som inkluderar kroniskt obstruktiv lungsjukdom (KOL), ålder >60 år, ischemisk hjärtsjukdom, hjärtsvikt av NYHA-klass III/IV, LVEF <25 procent, VT-storm och diabetes [13]. Vi har som rutin att använda oss av profylaktiskt cirkulatoriskt stöd (extrakorporeal membranoxygenering, Ecmo) för patienter med hög PAINESD-poäng och vid okontrollerbar VT-storm. Detta kräver ett tätt samarbete med toraxanestesi och -intensivvård, inkluderande perfusionister.
Ablationsingreppets utförande
Narkosstöd
Generell anestesi är att föredra, då ingreppen är relativt långvariga (vanligtvis 4–6 timmar) och ofta medför upprepad induktion och elkonvertering av VT. Vidare ger generell anestesi möjlighet till ett kontrollerat och påverkbart andningsmönster, vilket i hög grad förbättrar kateterstabiliteten.
Åtkomst (access)
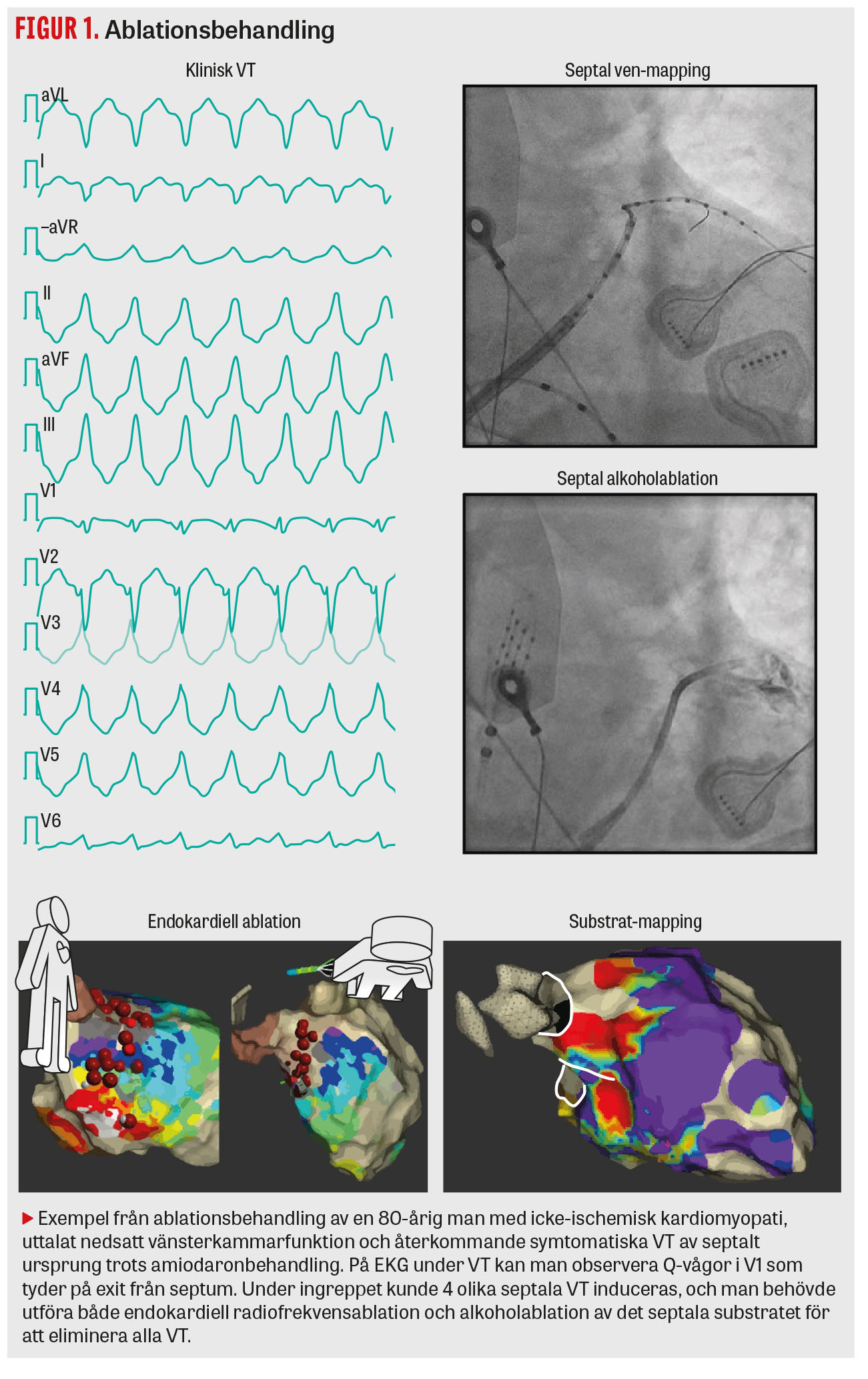
Åtkomst via femoralvenen är standard, och man når vänster kammare genom punktion av förmaksseptum. Arteriell åtkomst kan behövas för att nå vänster kammare via aorta och kan underlätta åtkomsten av vissa områden i kammaren, till exempel runt aorta och mitralisklaffarna (Figur 1) och den anterolaterala papillarmuskeln. Vid misstanke om substrat som kräver epikardiell ablation görs en perikardpunktion direkt vid ingreppets start. Vi har nyligen börjat att insufflera koldioxid i perikardiet för att minska komplikationsrisken vid själva perikardpunktionen (Figur 3).
VT-induktion
Även om ett EKG taget under pågående VT är tillgängligt brukar man i regel inducera VT vid ingreppets start för registrering av den exakta VT-morfologin, samt för att bättre kunna utvärdera ablationsresultatet vid ingreppets slut genom försök till reinduktion.
Kartläggning av VT-substrat (mapping)
De elektriska och anatomiska förhållandena i hjärtkammaren kartläggs noggrant med hjälp av en så kallad mapping-kateter och signalerna lagras i en 3-dimensionell karta med ett dedikerat datasystem (Figur 1–3). Arytmisubstratet kan kopplas till områden med elektriska impulser av låg amplitud och/eller långsam konduktion. Denna form av »substratmapping« gör det möjligt att eliminera VT-substratet helt utan induktion av arytmi. Alternativet är att kartlägga återkopplingskretsen under pågående VT (aktiverings-mapping), vilket kan vara mycket påfrestande, särskilt för sjukare patienter och vid snabb VT [14]. Genom stimulering med kateter (pace-mapping) i misstänkta målområden för ablation undersöks om man kan skapa en EKG-morfologi genom pacing som liknar den kliniska VT:n.
Ablation
Behandlingen utförs med en ablationskateter som avger värmeenergi (radiofrekvensablation) från sin spets mot de områden som misstänks orsaka VT. I vissa fall ligger substratet djupt intramuralt, ofta i septum, och kan då vara mycket svårt att nå med radiofrekvensablation. I dessa fall har man på några centrum börjat med mapping av det septala vensystemet och även behandling med lokal alkoholinstillation (Figur 1) [15]. Det finns även möjlighet att utföra så kallad septal bipolärablation med två ablationskatetrar från höger och vänster kammarseptum samtidigt [16]. En ny energiform, pulsfältablation (Pulsed field ablation), PFA, används sedan några år tillbaka vid flimmerablation och kan komma att utgöra ett effektivt behandlingsalternativ vid VT-ablation i framtiden.
Utvärdering och eftervård
Vanligtvis görs ett nytt försök till VT-induktion vid ingreppets avslutande för att utvärdera resultatet. Efter ingreppet kan patienten återgå till hjärtavdelningen redan samma kväll efter sedvanlig postoperativ övervakning på uppvakningsavdelning. Följande dag kan majoriteten av patienter skrivas ut till hemmet och återgå till normal fysisk aktivitet en vecka senare. Vid epikardiell ablation kan perikarditliknande bröstsmärtor ibland uppstå under den följande månaden.
Resultat och risker med VT-ablation
Tidiga registerstudier rapporterade en recidivrisk under det första året på 23–49 procent [16]. Resultaten är svårtolkade då VT-ablation är ett tekniskt krävande ingrepp och dess utfall och risker är starkt kopplade till det utförande centrumets erfarenheter, resurser och volym samt patientgruppens sammansättning. Liksom vid flimmerablation är resultaten bättre om ablation utförts tidigt i sjukdomsförloppet (4 och 12 procent recidivrisk i Partita respektive Smash-VT) [8, 10] jämfört med i ett senare skede (59 procent recidivrisk i Vanish) [9]. Vid icke-ischemisk kardiomyopati är VT-ablationsresultaten sämre, med runt 50 procent recidivrisk efter 2 år i en nylig multicenterregisterstudie [17]. Allvarliga ingreppsrelaterade risker har uppskattats till omkring 7 procent (död, stroke, allvarliga blödningar och perforation) [16] men varierar stort mellan olika rapporter. Ett exempel på detta är dödligheten vid VT-ablation, som var 0 procent i Partita [10], jämfört med 5 procent i ett stort register av patienter med VT-storm [6].
Egna resultat
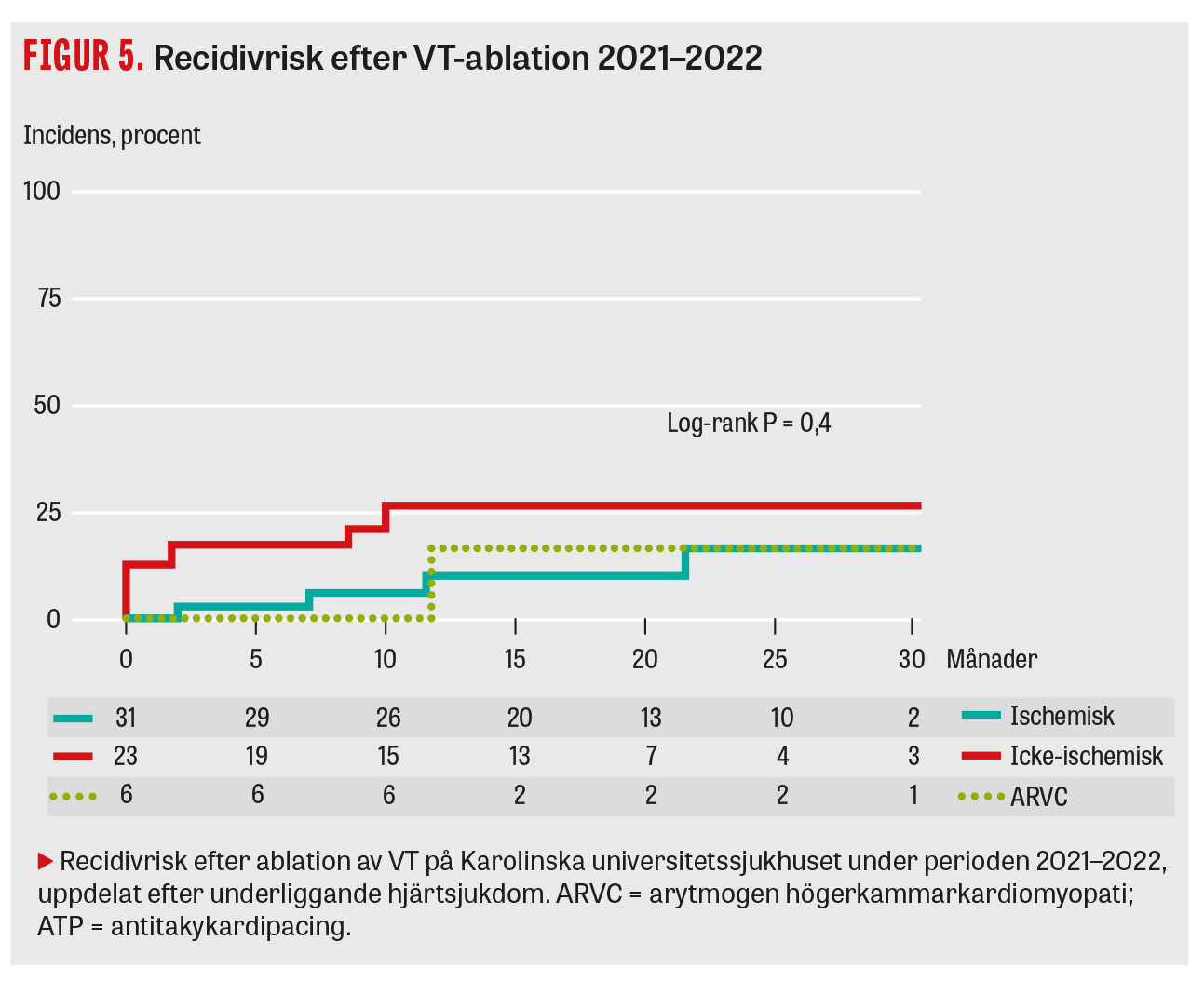
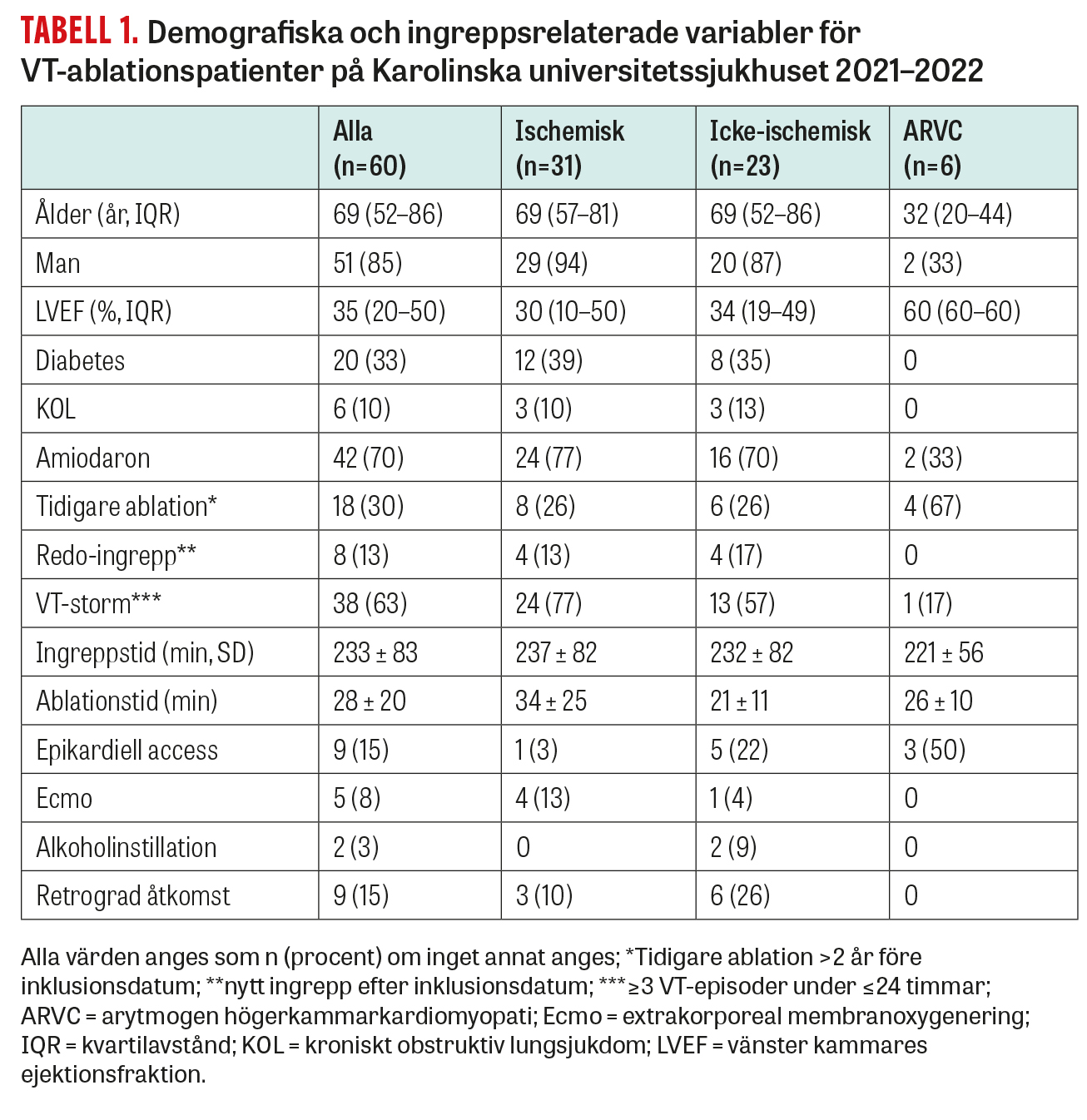
Under 10-årsperioden från 2013 till 2022 genomfördes totalt 1 714 ablationer för VT i Sverige, varav 440 (26 procent) på Karolinska universitetssjukhuset (data från Svenska kateterablationsregistret). Förvånande nog har antalet VT-ablationer per år endast ökat marginellt över tid och ligger i Sverige med 1,7 ingrepp per 100 000 invånare/år (2022) lägre än i Danmark (2,3/100 000) [18] och mycket lägre än i Tyskland (cirka 9,1/100 000 år 2020) [19]. Under det senaste decenniet har det skett en omfattande utveckling av teknisk utrustning och operationsmetoder. För att få en bild av metodens aktuella effektivitet och säkerhet sammanställde vi resultat av VT-ablationer utförda hos oss under 2021 och 2022. Det gjordes 68 VT-ablationer på 60 patienter med strukturell hjärtsjukdom under denna tidsperiod. Medianåldern var 69 år, majoriteten var män med ischemisk hjärtsjukdom och den övervägande delen av patienterna genomgick ett subakut ablationsingrepp på grund av VT-storm (Tabell 1). Ingreppen var relativt långvariga (genomsnitt 233 minuter), och speciella tekniker som epikardiell access, Ecmo och alkoholinstillation användes i 27 procent av fallen. Vid en uppföljningstid på 20 (9–33) månader hade 11 (18 procent) patienter fått recidiv i form av ICD-behandling eller dokumenterad VT (Figur 5). För denna utfallsanalys har man tillåtit ett andra ablationsförsök inom 6 månader vid VT-recidiv, vilket utfördes på 8 patienter, varav 4 ånyo fick recidiv.
I linje med andra studier [17] var recidivrisken högre för patienter med icke-ischemisk än med ischemisk hjärtsjukdom (26 vs 13 procent), även om den inte var signifikant (log-rank P = 0,4). Under uppföljningstiden avled 7 patienter; ingen av dessa hade en till synes arytmirelaterade dödsorsak. Ingreppsrelaterade allvarliga komplikationer inträffade i 2 fall (en stroke och ett komplett AV-block där risken var överhängande på grund av ett septalt VT-substrat) och icke-allvarliga i 6 fall (samtliga urinvägsinfektioner efter KAD vilka medförde förlängd vårdtid).
Sammanfattningsvis är recidivrisken och komplikationsrisken relativt låg jämfört med liknande registerstudier från utländska centrum. Noterbart är den relativt höga andelen subakuta ablationer som utfördes på grund av VT-storm (63 procent), något som rapporterats betydligt lägre i utländska registerstudier (15–34 procent) [6, 12]. Man kan spekulera om huruvida våra VT-patienter i mindre utsträckning genomgick ablation i ett tidigt skede av sjukdomsförloppet, vilket leder till att majoriteten får behandlas subakut i stället. Denna behandlingsstrategi är problematisk då patienten oftare befinner sig i ett instabilt hemodynamiskt läge med behov av cirkulatoriskt stöd och risk för dekompensation av andra organsystem. Det är således inte förvånande att studier har visat på högre ingreppsrisk vid subakut VT-ablation av VT-storm [6]. Tidig identifiering av VT-patienter lämpliga för ablationsåtgärd samt en effektiv struktur av vårdförloppet vid ablationscentrumet bör förbättra denna situation och öka andelen elektiva VT-ablationer. Slutligen kan vår låga ingreppsrelaterade mortalitet (0 procent) spegla att en del av de allra svårast sjuka patienterna inte blir erbjudna VT-ablation, även om patientgruppen vi analyserat är relativt liten och detta således endast utgör spekulationer.
Konklusion
Kammartakykardier hos patienter med strukturell hjärtsjukdom är ofta direkt livshotande, och de flesta patienter har indikation för ICD. Kateterablation har utvecklats till en effektiv behandlingsstrategi för att minska arytmibördan och således framtida ICD-tillslag hos denna patientgrupp. Ett välfungerande multidisciplinärt samarbete är avgörande för patientsäkerhet och resultat och inbegriper toraxanestesiologisk kompetens och möjlighet till cirkulatoriskt understöd för de allra sjukaste patienterna. Våra ablationsresultat är i fas med data från andra länder, även om vår andel subakuta VT-ablationer är högre. VT-ablation bör övervägas tidigare i sjukdomsförloppet för bättre resultat och minskade ingreppsrelaterade risker.
Potentiella bindningar eller jävsförhållanden: Finn Åkeström har uppburit konsultarvoden från Johnson & Johnson och Abbott. Mats Jensen-Urstad har uppburit konsultarvoden från Johnson & Johnson och Medtronic. Frieder Braunschweig har deltagit i adjudicering av kliniska händelser i studier sponsrade av Biotronik och Medtronic.