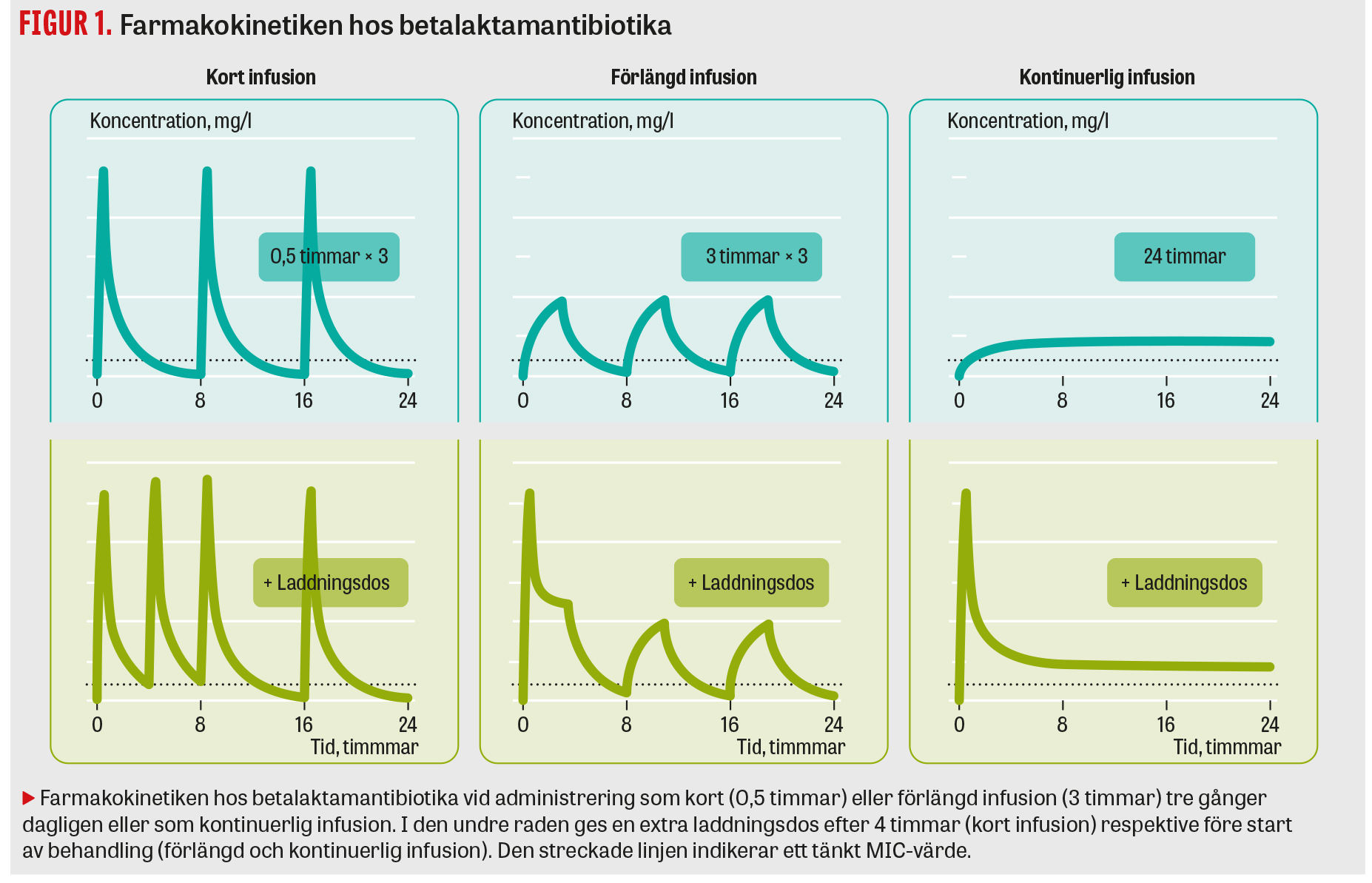
Effekten av betalaktamantibiotika beror på hur stor del av tiden som den fria (ej proteinbundna) koncentrationen överstiger MIC-värdet (minsta inhibitoriska koncentrationen) för den aktuella bakterien (fT > MIC).
Förlängd infusion under 3–4 timmar eller kontinuerlig infusion leder till en ökad fT > MIC jämfört med kort infusion och rekommenderas till kritiskt sjuka Iva-patienter som behandlas med exempelvis piperacillin–tazobaktam eller meropenem.
Kontroll av antibiotikakoncentrationer i plasma (TDM) bör övervägas när det finns anledning att misstänka en avvikande farmakokinetik som kan leda till subterapeutiska koncentrationer, särskilt vid gramnegativa infektioner.
Betalaktamantibiotika (penicilliner, cefalosporiner, karbapenemer) utgör en hörnpelare i behandling av akuta bakteriella infektioner. Den terapeutiska effekten av betalaktamantibiotika beror på hur stor del av tiden som den fria (ej proteinbundna) antibiotikakoncentrationen överstiger MIC-värdet (minsta inhibitoriska koncentrationen) för den aktuella bakterien (fT > MIC).
Hos kritiskt sjuka patienter påverkas ofta farmakokinetiken för betalaktamantibiotika bland annat genom en ökad distributionsvolym, initialt ökad renal clearance och hypoalbuminemi, vilket kan orsaka lägre (subterapeutiska) plasmakoncentrationer av betalaktamantibiotika [1-3]. Därför bör högre initial dosering av betalaktamantibiotika användas till dessa patienter; Svenska infektionsläkarföreningens vårdprogram för sepsis rekommenderar att en extra dos ges efter 3–4 timmar vid septisk chock [4].
Betalaktamantibiotika ges vanligen som injektion eller som kort infusion under 30–60 minuter. Förlängd eller kontinuerlig infusion ökar fT > MIC med samma dosering (Figur 1) och rekommenderas bland annat av Surviving sepsis campaign för vuxna patienter med sepsis och septisk chock [5]. I ett nyligen publicerat internationellt konsensusdokument gjordes en systematisk litteraturgenomgång av evidensen för att ge förlängd (>1 timme) eller kontinuerlig infusion [6]. Resultat av publicerade studier och slutsatser i konsensusdokumentet sammanfattas här tillsammans med rekommendationer för behandling vid svenska sjukhus.
Klinisk evidens för kritiskt sjuka vuxna patienter
Möjlig nytta av förlängd eller kontinuerlig infusion i form av minskad mortalitet hos kritiskt sjuka patienter har undersökts i 20 randomiserade studier. Bara en studie visade på minskad mortalitet, och i den ingick endast 21 patienter.
Sammanfattningsvis finns, baserat på publicerade randomiserade studier, ingen evidens för minskad mortalitet. Ett flertal retrospektiva studier har däremot visat lägre mortalitet hos kritiskt sjuka patienter som har behandlats med förlängd eller kontinuerlig infusion, särskilt vid infektioner som orsakas av Gramnegativa bakterier, inklusive Pseudomonas aeruginosa. Klinisk utläkning har utvärderats i 14 randomiserade studier.
Resultaten varierade, men visar sammantaget på viss nytta av förlängd eller kontinuerlig infusion, särskilt vid luftvägsinfektioner (relativ risk [RR] 1,1; 95 procents konfidensintervall [95KI] 1,03–1,19). Dock sågs en signifikant publikationsbias, och vid justerad analys sågs inte längre någon statistiskt signifikant skillnad (RR 0,97; 95KI 0,83–1,12). I de flesta av studierna användes kontinuerlig infusion.
Evidens för patienter som inte är kritiskt sjuka
Data från 6 randomiserade studier med patienter som inte var kritiskt sjuka (ej Iva) visade ingen skillnad i mortalitet med förlängd eller kontinuerlig infusion. Inte heller i randomiserade studier med cancerpatienter (totalt 4 stycken) sågs någon skillnad i mortalitet beroende på infusionshastighet. Endast en observationsstudie har rapporterat minskad mortalitet med förlängd infusion av piperacillin–tazobaktam, meropenem eller imipenem–cilastatin hos patienter med levercirros och bakteriemi. Hos patienter som inte var kritiskt sjuka (8 randomiserade studier) påvisades inte heller någon skillnad i klinisk utläkning med förlängd eller kontinuerlig infusion.
Begränsningar i publicerade studier
De publicerade studierna har svagheter som gör det svårt att dra säkra slutsatser om nyttan av förlängd eller kontinuerlig infusion av betalaktamantibiotika. Antalet patienter har ofta varit för lågt för att kunna påvisa statistiskt signifikanta skillnader mellan behandlingsgrupperna. Det finns en stor variation mellan studierna sett till patientpopulation, infusionshastighet, typ av infektioner, orsakande bakterier och deras känslighet för antibiotika. Flertalet studier har utvärderat kontinuerlig infusion, snarare än förlängd infusion som ofta ges under 3–4 timmar. Det behövs randomiserade studier med fler patienter och studier av patientgrupper som kan förväntas ha störst nytta: kritiskt sjuka patienter med infektioner som orsakas av gramnegativa bakterier, inklusive P aeruginosa, som generellt har högre MIC-värden än grampositiva bakterier.
Laddningsdos vid start av behandling
Vid förlängd eller kontinuerlig infusion kommer antibiotikakoncentrationen att stiga långsammare än vid kort infusion (Figur 1). Genom att ge en laddningsdos med kort infusion vid start av behandling uppnås snabbare en terapeutisk koncentration, vilket är teoretiskt tilltalande. Laddningsdos användes i 15 av 21 randomiserade studier, och i en subgruppsanalys sågs ett bättre kliniskt utfall hos patienter som fick en laddningsdos (RR 1,10; 95KI 1,03–1,18). I de tre randomiserade studier som visade bättre kliniskt utfall hos kritiskt sjuka patienter gavs laddningsdos som följdes av kontinuerlig infusion. Det finns inte tillräckligt med data för att säkert avgöra vad som är den optimala strategin vad gäller dos och infusionshastighet av laddningsdosen, eller när underhållsdoseringen ska påbörjas.
Monitorering av antibiotikakoncentrationer
Läkemedelskoncentrationsbestämning (therapeutic drug monitoring, TDM) kan användas för att säkerställa att patienten har adekvat dosering och som stöd för individanpassad behandling. Tre randomiserade studier, som inkluderade kritiskt sjuka patienter (n = 41) och patienter med neutropen feber (n = 32) eller brännskador (n = 38), har undersökt effekten av TDM. Sammantaget visar studierna att TDM resulterar i att en större andel av patienterna uppnår relevanta farmakokinetiska/farmakodynamiska (PK/PD) mål (till exempel 100 procent fT > MIC). Däremot har man inte kunnat visa på någon statistiskt signifikant skillnad i kliniskt utfall, vilket är väntat med tanke på det låga antalet patienter. Evidensen är otillräcklig för att säkert säga vilka PK/PD-mål som är mest kliniskt relevanta; i konsensusdokumentet anges minst 50–70 procent fT > MIC vid kort och förlängd infusion och en antibiotikakoncentration (fri substans) minst 4 gånger högre än MIC-värdet vid kontinuerlig infusion. Författarna diskuterar också kort den metodologiska osäkerheten vid MIC-bestämning och föreslagna strategier för att använda epidemiologiska brytpunkter (epidemiological cut-off value, ECOFF) eller 4 gånger det uppmätta MIC-värdet. Fler studier behövs för att avgöra vilka patienter som har störst nytta av TDM. Teoretiskt bör nyttan vara störst hos patienter som har en avvikande farmakokinetik med risk för subterapeutiska koncentrationer, till exempel kritiskt sjuka eller överviktiga patienter, patienter med nedsatt njurfunktion/hemodialys och vid Gramnegativa infektioner.
Rekommendationer i konsensusdokumentet
Baserat på den evidens som redovisas ovan presenteras i konsensusdokumentet 16 slutsatser och rekommendationer kring förlängd eller kontinuerlig infusion och TDM [6]. Författarna rekommenderar att förlängd eller kontinuerlig infusion ska ges till kritiskt sjuka patienter för att minska mortalitet och/eller öka klinisk utläkning. Däremot rekommenderas inte förlängd eller kontinuerlig infusion till patienter som inte är kritiskt sjuka och vårdas på vanlig avdelning (ej Iva). Vid start av kontinuerlig infusion bör en initial laddningsdos ges, men på grund av brist på evidens ges ingen rekommendation vare sig för eller emot laddningsdos när förlängd infusion används. Samtliga dessa rekommendationer klassades som »conditional recommendation, very low certainty of evidence«. Konsensusgruppen föreslår att TDM ska övervägas från fall till fall, men anser att det inte finns stöd för att använda detta rutinmässigt.
Praktiska aspekter inom intensivvård
Förlängd infusion av betalaktamantibiotika innebär vanligtvis inga större problem inom intensivvården, där det finns stor vana av att ge flera infusioner samtidigt. Då betalaktamantibiotika ofta har begränsad blandbarhet krävs dock som regel att patienten har en kärlinfart i form av en central venkateter med flera lumen. Förlängd infusion under 3–4 timmar har en praktisk fördel jämfört med kontinuerlig infusion. Det är också det normala administreringssättet för flera nya antibiotika, till exempel cefiderocol och meropenem–vaborbaktam, som ges som 3-timmarsinfusion. Förberedda ordinations-, spädnings- och infusionsmallar underlättar ordinationerna och rekommenderas vid införande av förlängd infusion som rutin. Det bör också finnas en rutin där det tydligt framgår att en laddningsdos ska föregå den första förlängda infusionen vid insättning av aktuella preparat. En utbildningsinsats till läkare och sjuksköterskor kan vara till nytta för att förklara den teoretiska bakgrunden och det praktiska genomförandet av den nya rutinen.
Rekommendationer från RAF
RAF (Referensgruppen för antibiotikafrågor) är en expertförening inom Svenska läkaresällskapet, som bland annat fungerar som remissinstans åt den europeiska brytpunktskommittén (EUCAST) samt ger råd om dosering av antibiotika. Under 2020 gjordes en enkätundersökning om förlängd och kontinuerlig infusion och TDM som skickades till 78 Iva-enheter i Sverige, varav 55 (71 procent) svarade [7]. Nio Iva-enheter (16 procent) angav att förlängd infusion av meropenem, piperacillin–tazobaktam och cefotaxim användes vid mer än 10 procent av doseringstillfällena. Användningen var högst vid universitetssjukhusen. En tredjedel (18/55) av enheterna angav att de någon gång hade använt TDM för meropenem, 13 hade använt TDM för piperacillin–tazobaktam och 8 hade använt TDM för cefotaxim. En viktig begränsning i upplevd nytta av TDM var otillräckliga möjligheter att få snabbt svar på analyserna; bara 9/27 (33 procent) angav att man oftast får svar inom 24 timmar. Enkäten visade sammantaget stora skillnader i användningen av förlängd och kontinuerlig infusion samt TDM av betalaktamantibiotika vid svenska Iva-enheter.
Mot bakgrund av det nya konsensusdokumentet menar vi att det är dags att införa rutiner och ordinationsmallar för förlängd infusion av betalaktamantibiotika vid samtliga Iva-enheter i landet. Förlängd infusion under 3–4 timmar har som sagt vissa praktiska fördelar och bedöms ha effekt jämförbar med kontinuerlig infusion. Evidensläget är fortfarande relativt svagt, och man får diskutera vid varje sjukhus hur de nya rutinerna ska implementeras och för vilka patienter. Flertalet patienter som är infekterade av antibiotikakänsliga bakterier får tillräcklig exponering för antibiotika även med kort infusion.
Förlängd infusion rekommenderas i första hand för patienter som är kritiskt sjuka och som har en misstänkt eller påvisad infektion med gramnegativa bakterier. I praktiken blir det därför oftast aktuellt vid behandling med cefotaxim, piperacillin–tazobaktam eller meropenem på Iva. Administrering med kort infusion är tillräcklig vid behandling av patienter på vanlig vårdavdelning, och det finns ingen evidens för att förlängd eller kontinuerlig infusion har bättre effekt i denna patientgrupp. I de flesta fall kan samma dosering användas som normalt (till exempel 4 g × 4 av piperacillin–tazobaktam), men infusionshastigheten sätts i stället till 3–4 timmar. För att säkerställa adekvata koncentrationer tidigt i behandlingen rekommenderar vi att en laddningsdos ges som kort infusion (30 minuter) innan förlängd infusion påbörjas (Figur 1). Nya studier, till exempel Bling III, som är en nyligen avslutad randomiserad studie av kontinuerlig infusion av betalaktamantibiotika på Iva, kan ge information som gör att rekommendationerna behöver revideras.
TDM bör övervägas hos patienter där det finns anledning att misstänka en avvikande farmakokinetik (kritiskt sjuka, överviktiga, patienter med njursvikt/hemodialys), särskilt vid allvarliga gramnegativa infektioner. Syftet är både att säkerställa tillräckligt höga (terapeutiska) koncentrationer och att undvika alltför hög exponering som medför ökad risk för neurotoxicitet eller andra biverkningar. Det finns fortfarande en osäkerhet kring vilka målvärden som ska användas. I enlighet med konsensusdokumentet tycker vi att minst 50–70 procent fT > MIC bör eftersträvas vid kort och förlängd infusion, eller en fri koncentration av antibiotika som är minst 4 gånger högre än bakteriens MIC vid kontinuerlig infusion, med reservation för den metodologiska osäkerhet som finns vid MIC-bestämning. Om förlängd infusion inte bedöms lämplig kan kort infusion med högre dygnsdos och tätare doseringsintervall än normalt ofta användas för att öka exponeringen utan att överskrida den rekommenderade maximala dygnsdosen, exempelvis 6 g/dygn för meropenem och 12 g/dygn för cefotaxim. Tillgänglighet till metoder för koncentrationsbestämningar med snabbt svar (inom 24 timmar) är avgörande för implementeringen av TDM och bör vara ett prioriterat utvecklingsområde vid sjukhusen.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.