Vård efter hjärtstopp utgör en betydande andel av svensk intensivvård med ca 6 000 intensivvårdsdygn per år.
Det finns i dag inga interventioner i intensivvården med hög evidens som har visat sig kunna minska de hjärnskador som uppkommer i samband med hjärtstopp.
Rutinmässig koronarangiografi rekommenderas inte om patienten inte har ST-höjning på EKG.
Temperaturkontroll med målet att hålla medvetslösa patienter feberfria i 72 timmar rekommenderas.
Sedering i 24 timmar rekommenderas.
I Sverige påbörjas varje år hjärt–lungräddning (HLR) vid 8 500 hjärtstopp (ca 6 000 utanför sjukhus och 2 500 på sjukhus), varav ca 1 600 patienter (ca 700 utanför sjukhus och 900 på sjukhus) var vid liv 30 dagar efter hjärtstoppet [1]. Hos 90 procent av överlevarna är det neurologiska utfallet gott [1]. Den viktigaste gynnsamma prognostiska faktorn är om patienten har en initial defibrillerbar rytm (ventrikelflimmer eller pulslös ventrikeltakykardi). Andra betydelsefulla faktorer är om hjärtstoppet är bevittnat och HLR påbörjats tidigt. Bland icke-defibrillerbara rytmer är överlevnaden sämre vid asystoli jämfört med pulslös elektrisk aktivitet. Andelen överlevare är högre bland män än kvinnor, men skillnaderna försvinner när initial rytm beaktas [1]. De patienter som överlever hjärtstoppet initialt och är fortsatt medvetslösa vårdas på en intensivvårdsavdelning. I Sverige registreras drygt 6 000 intensivvårdsdygn per år med huvuddiagnos hjärtstopp (både på och utanför sjukhus), och den sammantagna överlevnaden bland dem som läggs in på Iva är cirka 50 procent [2]. European Resuscitation Council (ERC) och European Society of Intensive Care Medicine (ESICM) gav 2021 ut uppdaterade evidensbaserade riktlinjer för vård efter hjärtstopp, inklusive riktlinjer för neurologisk prognosbedömning [3, 4]. Nyligen publicerade undersökningar av europeiska och svenska intensivvårdsavdelningar visade variation både i omhändertagandet och i följsamheten till riktlinjerna för vård efter hjärtstopp [5-7]. Flertalet svenska intensivvårdsavdelningar ansåg att det fanns ett behov av svenska riktlinjer för intensivvård efter hjärtstopp [7].
Merparten av evidensen för vården efter hjärtstopp kommer från studier på hjärtstopp som sker utanför sjukhus med förmodad kardiell genes. Resultaten från dessa studier har extrapolerats till den vård som ges vid alla hjärtstopp. Nyare studier antyder att hjärtstopp som sker på respektive utanför sjukhus visar mindre skillnader än man tidigare trott och att skillnaderna i utfall i huvudsak beror på de kortare tiderna till HLR, defibrillering och mer avancerade åtgärder/behandlingar på sjukhus [8, 9]. I denna artikel sammanfattar HLR-rådets arbetsgrupp (Fakta 1) ERC/ESICM:s riktlinjer från 2021 för vård efter hjärtstopp hos vuxna (Fakta 2, Figur 1) samt relevanta studier som publicerats därefter.
Tidiga åtgärder
Intensivvården efter hjärtstopp påbörjas direkt efter att egen bärande cirkulation etablerats (ROSC, return of spontaneous circulation). I den tidiga fasen ligger fokus på stabilisering och att hitta genesen till hjärtstoppet. Snabb och säker transport till akutmottagning, intensivvård eller kranskärlsröntgen under hög beredskap för att kunna hantera eventuell akut försämring prioriteras.
Tidig diagnostik
Akut kranskärlsröntgen är indicerad vid ST-höjningsinfarkt (STEMI); transport till annat sjukhus kan krävas. Hos patienter utan ST-höjning på EKG finns uppdaterade riktlinjer från European Society of Cardiology, som inte rekommenderar att akut kranskärlsröntgen genomförs rutinmässigt [10]. Detta ska endast övervägas när sannolikheten för kranskärlsocklusion bedöms som hög till exempel vid fortsatta arytmier och/eller cirkulatorisk instabilitet [10]. Rekommendationen baseras på fyra mindre randomiserade studier som nyligen har publicerats och inte visat någon överlevnadsvinst med akut kranskärlsröntgen hos hjärtstoppspatienter utan ST-höjning jämfört med transport direkt till Iva och eventuell kranskärlsröntgen i senare skede [11-14]. Om icke-kardiell genes misstänkts, alternativt om akut kranskärlsröntgen inte identifierar orsaken till hjärtstoppet, görs i regel akut DT hjärna och torax. Övriga undersökningar utförs på indikation. Beakta risken för trauma efter bröstkompressioner och falltrauma. EKG-remsor från ambulans bör sparas/efterlysas, då de kan underlätta diagnos till exempel vid hjärtstopp orsakade av primär arytmi. Ekokardiografi rekommenderas för att bedöma underliggande hjärtsjukdom, vänster- och högerkammarfunktion samt för att ge vägledning till hemodynamisk behandlingsstrategi.
Post-cardiac arrest syndrome
Efter ROSC uppstår »post-cardiac arrest syndrome«, som innefattar posthypoxisk hjärnskada, myokarddysfunktion, systemisk respons på ischemi och reperfusion samt den patologi som orsakade hjärtstoppet. Svårighetsgraden korrelerar med hjärtstoppets duration, och ischemi- och reperfusionsskadorna aktiverar immun- och koagulationskaskader som resulterar i ett sepsisliknande syndrom inklusive vasodilatation, endotelskada och störd mikrocirkulation. Hjärtfunktionen återhämtar sig i regel inom 2–3 dagar. Inom 3 dagar efter hjärtstoppet orsakas de flesta dödsfall av cirkulatorisk svikt eller multiorgansvikt. I ett senare skede är avbrytande av livsuppehållande behandling på grund av dålig neurologisk prognos vanligast, vilket utgör mer än 2/3 av dödsfallen på Iva.
Syrgasbehandling
Innan SpO2 kan mätas administreras FiO2 100 procent, därefter titreras FiO2 till behandlingsmålet SpO2 94–98 procent (PaO2 10–13 kPa). Högre syresättningsmål undviks eftersom det teoretiskt kan öka mängden fria syreradikaler, vilka är en mediator av hjärnskador. Liksom vid andra hjärnskador undviks hypoxemi (PaO2 <8kPa). Randomiserade studier har jämfört lägre och högre syresättningsmål under intensivvården, utan effekt på neurologiskt utfall eller nivåer av biomarkörer för hjärnskada i blod [15, 16]. I den randomiserade multicenterstudien Exact (Reduction of oxygen after cardiac arrest) sågs ingen signifikant skillnad i överlevnad vid utskrivning hos hjärtstoppspatienter med lägre prehospitalt syresättningsmål efter ROSC SpO2 90–94 procent jämfört med SpO2 98–100 procent. Studien avbröts i förtid på grund av pandemin, men påvisade fler hypoxiperioder i gruppen med lägre syresättningsmål [17].
Ventilation
Respiratorinställningar bör vara lungprotektiva (tidalvolym 6–8 ml/kg), som vid allmän intensivvård [18]. Normokapni (PaCO2 4,5–6,0 kPa) rekommenderas. Hypokapni undviks på grund av risken för cerebral vasokonstriktion med efterföljande hypoperfusion. Mindre studier har visat ökat cerebralt blodflöde vid lindrig hyperkapni (PaCO2 6,0–7,3), med en möjlig neuroprotektiv effekt [15, 19]. I den nyligen publicerade randomiserade multicenterstudien Targeted therapeutic mild hypercapnia after cardiac arrest (TAME) (n = 1 800), där mild hyperkapni jämfördes med normokapni, fann man dock inga skillnader i överlevnad med god neurologisk funktionsnivå [20].
Cirkulation
Nuvarande riktlinjer rekommenderar att undvika hypotension (mål-medelartärtryck [MAP] >65 mm Hg) för att uppnå urinproduktion >0,5 ml/kg/h samt ett normalt eller sjunkande laktat. Blodtrycket upprätthålls med vätskor, noradrenalin och/eller inotropi beroende på individuella patientfaktorer. Steroider rekommenderas inte rutinmässigt vid »post-cardiac arrest syndrome«. Hypokalemi <4 mmol/ml ska undvikas på grund av risken för arytmier. Vid refraktär cirkulatorisk chock på basen av kardiell genes övervägs mekaniska cirkulationsstöd såsom Impella, aortaballongpump eller arteriovenös extrakorporeal membranoxygenering (Ecmo). Ecmo under pågående HLR (extrakorporeal CPR, eCPR) är en resurskrävande behandling som i första hand har studerats i selekterade patientgrupper med defibrillerbar första rytm [21-23]. Evidensläget för eCPR är begränsat, och resultaten divergerar i de tre randomiserade studier som genomförts beroende på kontext och patientpopulation. Den nuvarande rekommendationen är att eCPR kan övervägas i selekterade fall när resurser för Ecmo finns.
Behandlingsmålet att undvika hypotension är baserat på observationsstudier. Tre randomiserade studier har undersökt om ett högre målvärde för MAP, 80/85–100 mm Hg, är neuroprotektivt [15, 24, 25]. En studie visade lägre nivåer av biomarkörer för hjärnskada hos patientgruppen med högre MAP, medan man i en annan studie inte såg några skillnader på MR hjärna [15, 24]. Den danska BOX-studien från 2022 randomiserade 800 patienter vid två sjukhus till MAP-målvärdet 63 mm Hg eller MAP 77 mm Hg utan att kunna påvisa några skillnader i biomarkörer för hjärnskada eller i överlevnad med god neurologisk funktion [25]. Sammanfattningsvis har ingen studie rapporterat bättre neurologiskt utfall vid högre blodtrycksmål.
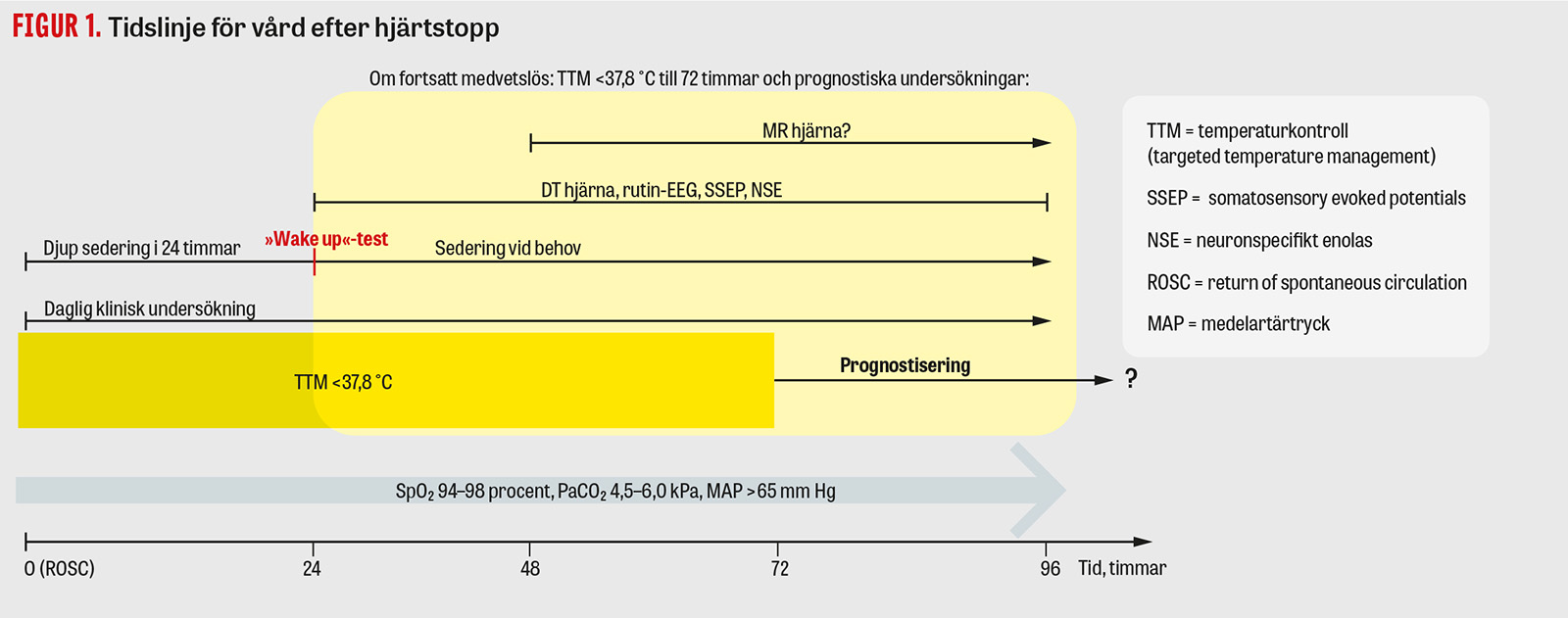
Temperaturkontroll (TTM) <37,8 °C
Hypotermi är neuroprotektiv och skyddar mot de hjärnskador som uppkommer vid global ischemi och reperfusion, vilket utnyttjas vid hjärtkirurgi och vid asfyxi hos nyfödda samt har visat neuroprotektiv effekt i djurstudier vid hjärtstopp när hypotermibehandling startas tidigt i förloppet (under pågående HLR, alternativt kort efter ROSC).
Flera randomiserade kliniska studier har undersökt nedkylning (32–34 °C) redan prehospitalt eller på sjukhus, påbörjad upp till 2–3 timmar efter hjärtstoppet, och har kunnat påvisa ökad överlevnad och bättre neurologisk funktion i selekterade hjärtstoppspopulationer [26-29]. De senare studierna, TTM1 och TTM2, där även effekten mot normotermi (det vill säga att undvika feber, definierad som ≥37,8 °C) studerades, kunde däremot inte påvisa denna effekt av hypotermibehandling [30, 31]. Sammantaget rekommenderar i dag ERC/ESICM normotermi (TTM <37,8 °C) de första 72 timmarna efter ett hjärtstopp så länge patienten förblir medvetslös, men det går inte att utesluta en positiv (eller negativ) effekt i vissa subgrupper av TTM mellan 32 och 36 °C.
Patienter som inkommer lindrigt eller måttligt hypoterma efter hjärtstoppet ska inte värmas aktivt, om inte komplikationer föranleder snabbare uppvärmning. Om patientens kroppstemperatur stiger och konservativa metoder inte räcker för att hålla temperaturen <37,8 °C (paracetamol, avklädning, fläkt) används en kylmaskin (ytkylning eller intravaskulär kylning) för temperaturkontroll. Kylmaskinen ställs in med måltemperatur 37,5 °C för att undvika att kroppstemperaturen stiger ytterligare (framför allt första timmarna efter start av kylmaskinen). Om patienten inte vaknar när sedering stoppas (eller om sedering behöver fortgå av medicinska skäl) fortsätter TTM <37,8 °C fram till 72 timmar efter hjärtstoppet. När kylmaskin används förekommer huttring (shivering) vid TTM <37,8 °C. Huttring ökar syrgaskonsumtionen och kan behandlas med »counter warming« (värmning av temperaturreceptorer i huden med till exempel Bair Hugger), ökad sedering, magnesium, klonidinbolus eller, om dessa inte hjälper, med tillägg av muskelrelaxantia.
Sedering
Samtliga studier på temperaturkontroll efter hjärtstopp har inkluderat djup sedering under temperaturkontroll oavsett temperaturmål. Det är ännu inte fastställt om djup sedering i sig har en gynnsam effekt. I väntan på bättre evidens rekommenderar svenska HLR-rådet djup sedering i minst 24 timmar [32]. I första hand rekommenderas kortverkande sedering och analgetika (propofol och remifentanil).
Behandling av kramper
Kliniska kramper, inklusive myoklonier, och/eller epileptisk anfallsaktivitet på EEG ses hos en tredjedel av patienterna. Kramper, framför allt ett tidigt myoklont status (definierat som generaliserade myoklonier i mer än 30 minuter), är oftast ett tecken på dålig neurologisk prognos. När elektrografiskt status epilepticus utvecklas från en kontinuerlig EEG-bakgrund kan prognosen vara god, och det kan dröja mer än 2 veckor innan kramperna avtar och patienten vaknar upp igen. Det är osäkert om kramper bidrar till ytterligare hjärnskada eller endast är ett uttryck för den anoxiska hjärnskadan. ERC/ESICM rekommenderar behandling av kramper, men evidensen för behandling bedömdes som låg eftersom inga relevanta studier gjorts. I första hand rekommenderas levetiracetam eller valproat som tillägg till sedering. En studie har därefter rapporterat att neurologisk funktion inte påverkades av behandling av elektrografiskt status epilepticus [33]. Behandling med antiepileptika påbörjas i regel för att kunna sätta ut sederande läkemedel och genomföra väckningsförsök och neurologisk prognostisering utan kvarvarande effekt av sederande läkemedel enligt nuvarande riktlinjer.
Kontinuerlig EEG-övervakning kan användas för att följa behandlingen av elektrografiska kramper samt för att identifiera patienter med tidig återkomst av kontinuerlig bakgrundsaktivitet, vilket är ett tecken på god neurologisk prognos. Kontinuerlig EEG är en resurskrävande undersökning som inte ingår i ERC/ESICM-algoritmen för neuroprognostisering (Figur 2). I en randomiserad studie sågs inga skillnader i patientutfall vid monitorering med kontinuerlig EEG i 30–48 timmar jämfört med 2 upprepade rutin-EEG inom samma tidsram efter hjärtstopp [34].
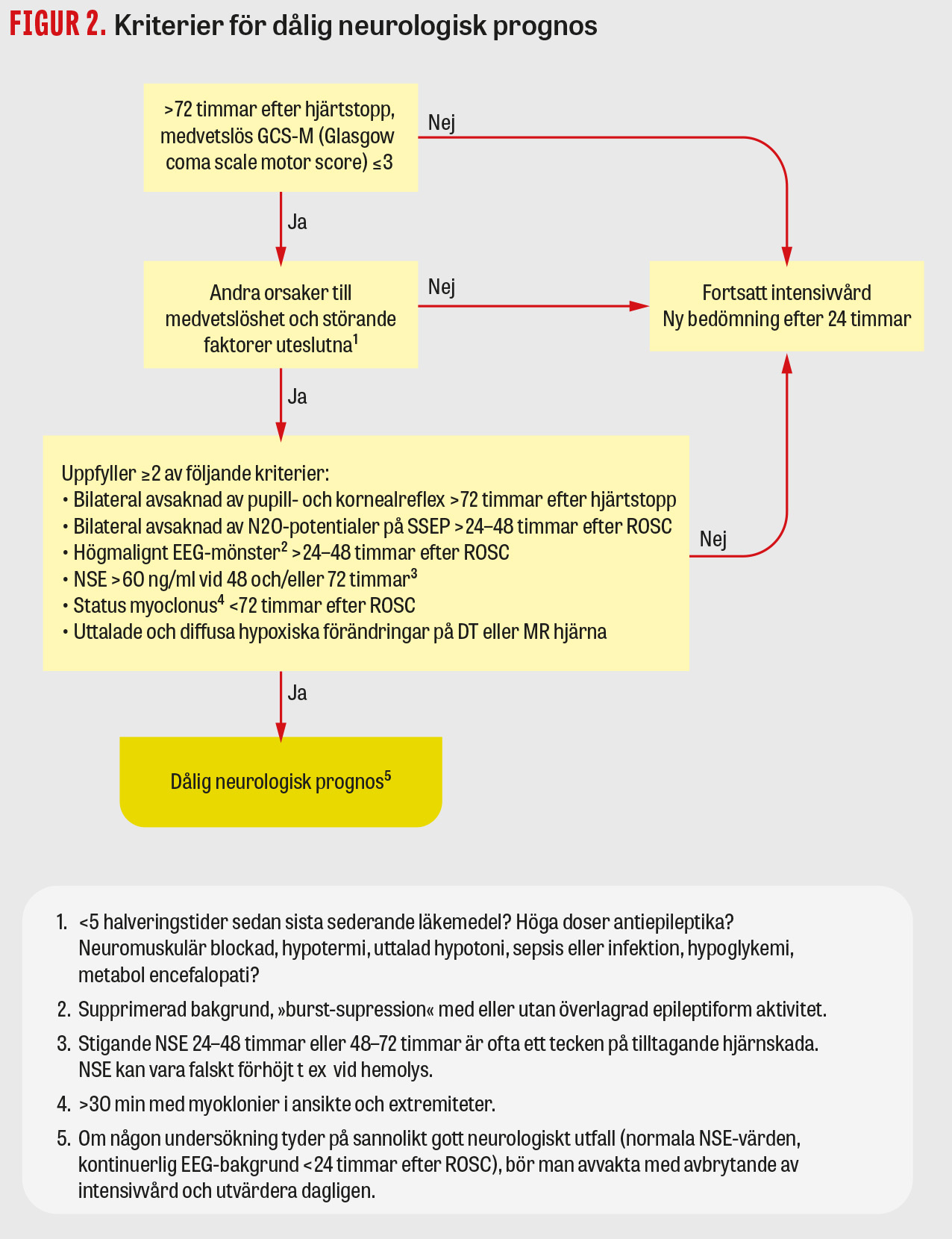
Multimodal neurologisk prognosbedömning
Den multimodala neurologiska prognosbedömningen för ställningstagande till fortsatt vårdnivå görs tidigast 72 timmar efter hjärtstoppet (Figur 2). Andra orsaker till medvetandesänkning ska uteslutas. Baserat på rekommendationer för hjärndödsdiagnostik rekommenderas att den kliniska neurologiska undersökningen som ligger till grund för prognosbedömningen görs tidigast 5 halveringstider efter sista sederande läkemedel, det vill säga 24 timmar för propofol och 1 timme för remifentanil. Även höga doser antiepileptika kan ha en sederande effekt, vilket måste övervägas vid prognosbedömningen.
Kriterierna för dålig prognos presenteras i Figur 2. Om kriterierna inte uppfylls, eller någon undersökning tyder på sannolikt gott neurologiskt utfall (normala värden av neuronspecifikt enolas [NSE] eller tidig återkomst av kontinuerlig bakgrundsaktivitet på EEG (< 24 timmar)], ska man avvakta med avbrytande av intensivvård och utvärdera dagligen.
Enligt europeiska riktlinjer ska EEG inför prognosbedömningen göras >24 timmar efter hjärtstoppet. Effekter av sedativa läkemedel kan påverka bakgrundsmönstret på EEG från kontinuerligt till diskontinuerligt, eller till och med »burst-suppression«, som klassificeras som ett högmalignt mönster och ingår i kriterierna för ett sannolikt dåligt neurologiskt utfall (Figur 2). EEG-mönstret kan förbättras över tid om hjärnan återhämtar sig, men även försämras när sekundär hjärnskada successivt utvecklas.
Vid undersökning av SSEP (somatosensory evoked potentials) stimuleras medianusnerven elektriskt och de uppåtgående signalerna registreras i plexus brachialis, hjärnstammen och kortex. Bilateral avsaknad av kortikala N20-potentialer och samtidigt bibehållna potentialer över plexus brachialis och hjärnstammen (som tecken på registreringens kvalitet) ingår i kriterierna för neurologiskt utfall (Figur 2). SSEPtest görs efter EEG, eftersom undersökningen oftast är normal om bakgrundsaktiviteten på EEG är kontinuerlig. SSEP påverkas inte av sedering i de doser som används vid vård efter hjärtstopp. Muskelrelaxantia kan användas vid registrering av EEG och SSEP för att undvika muskelartefakter.
Förhöjda nivåer av hjärnskademarkören NSE i blod (≥60 ng/ml vid 48 eller 72 timmar) ingår i kriterierna för dålig neurologisk prognos. Ofta tas även ett prov redan vid 24 timmar, då stigande koncentration från 24 till 48 (eller från 48 till 72) timmar är ett tecken på att sekundär hjärnskada utvecklas. NSE finns i röda blodkroppar och frisätts i blodet vid hemolys. Observera att NSE kan vara falskt förhöjt vid hemolys, neuroendokrina tumörer och småcellig lungtumör. För att detektera hemolys i prov mäter laboratorier fritt Hb. Halveringstiden för Hb är betydligt kortare (4 timmar) än för NSE (24 timmar), varför NSE kan vara falskt förhöjt även när laboratoriet inte rapporterar hemolys i provet.
DT hjärna görs inför prognosbedömning om det inte gjorts tidigare och kan med fördel upprepas, då sekundär hjärnskada kan utvecklas under vårdtiden. MR hjärna, om indicerad, utförs efter 2–5 dygn, oftare hos patienter med osäker prognos vid övriga undersökningar.
Avslutande av livsuppehållande behandling
Patientnyttan med intensivvård värderas kontinuerligt baserat på pågående organsvikt, grundsjukdomar och patientens habituella funktionsnivå. Före 72 timmar efter hjärtstoppet bör den bedömningen dock hållas skild från vad man tror om det neurologiska utfallet. Många patienter med dålig neurologisk prognos går inte att identifiera genom mulitmodal neuroprognostisering vid 72 timmar efter hjärtstoppet på grund av kvarvarande sederingsbehov, låg sensitivitet hos undersökningarna eller låg tillgänglighet (oftast SSEP). I en andel av fallen kan fler/upprepade undersökningar genomföras och kriterierna för dålig prognos uppfyllas. När kriterierna för dålig prognos inte uppfylls krävs ytterligare specialkunskap för att bedöma möjligheterna till återhämtning.
Organdonation
Några enstaka procent av patienterna har så svåra anoxiska hjärnskador att hjärnödemet leder till inklämning och hjärndöd. Organdonation efter hjärndöd (donation after brain death, DBD) kan bli aktuell efter hjärndödsdiagnostik. Efter hjärtstopp är dock avbrytande av livsuppehållande behandling efter multimodal neuroprognostisering vanligare, och donation efter cirkulationsstillestånd (donation after circulatory death, DCD) kan vara möjlig.
Konklusion
Vård efter hjärtstopp utgör en betydande andel av svensk intensivvård med ca 6 000 vårddygn.
Det finns i dag få eller inga interventioner med hög evidens som har visat sig kunna minska de hjärnskador som uppkommer i samband med hjärtstopp.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. HLR-rådets expertgrupp för vård efter hjärtstopp
Expertgruppen utformar och sprider riktlinjer för vård efter hjärtstopp i Sverige. Syftet är att skapa förutsättningar för en optimal och jämlik sjukhusvård, uppföljning och rehabilitering. Till gruppen finns även en referensgrupp knuten.
Fakta 2. Behandlingsmål för intensivvård efter hjärtstopp hos vuxna, medvetslösa patienter
- Oxygenering: SpO2 94–98 procent.
- Ventilation: PaCO2 4,5–6,0 kPa, tidalvolym 6–8 ml/kg.
- Cirkulation: MAP (medelartärtryck) >65 mm Hg, minskande eller normalt laktat, urinproduktion 0,5 ml/kg/h.
- Akut kranskärlsröntgen vid ST-höjningsinfarkt.
- Temperatur: TTM (targeted temperature management) <37,8 °C i 72 timmar så länge patienten är fortsatt medvetslös.
- Multimodal neuroprognostisering: ≥72 timmar efter hjärtstoppet.
- Sedering i 24 timmar.