I Sverige lever ca 100 000 personer med Alzheimers sjukdom.
Behovet av diagnos och effektiv behandling ökar med en åldrande befolkning.
Antikroppsbehandling riktad mot amyloid-beta har nyligen erhållit begränsat godkännande i EU och Storbritannien och har tidigare godkänts i bland annat USA, Kina och Japan.
De nya läkemedlen har visat lovande resultat, men kan orsaka ödem och blödningar i hjärnan. MR kan tidigt upptäcka biverkningarna, kallade ARIA, och är vägledande för om behandling ska fortgå, avbrytas eller avslutas helt.
Ett införande av de nya läkemedlen i Sverige skulle kräva stora kringresurser och prioriteringar, vilket manar till nationell förberedelse och samordning med god representation från berörda specialiteter.
Alzheimers sjukdom är den vanligaste kognitiva sjukdomen, och i Sverige är omkring 100 000 personer drabbade [1]. Sjukdomen leder till progressiv förlust av minne och kognitiva funktioner samt påverkan på aktiviteter i det dagliga livet (ADL). En åldrande befolkning, med ökad risk för kognitiv sjukdom, innebär ett allt större medicinskt och samhällsekonomiskt behov av diagnostik samt säker och effektiv behandling [2]. Samhällskostnaderna för kognitiva sjukdomar hos personer över 65 år i Sverige 2019 har uppskattats till 82 miljarder kronor, varav större delen återfinns hos kommunerna. Samtidigt som nya behandlingar mot Alzheimers sjukdom inger hopp kräver de, förutom finansiering för läkemedelskostnader, även stora kringresurser. Det kan skapa en påtaglig kostnadsökning, särskilt för regionerna [3].
Nuvarande läkemedel
Existerande behandlingar för Alzheimers sjukdom har funnits i mer än 20 år på den svenska marknaden. De har visat en måttlig men signifikant effekt på symtom vid Alzheimers sjukdom och utgörs av tre kolinesterashämmare (donepezil, galantamin och rivastigmin) samt en NMDA-antagonist (memantin). Data från Nationella kvalitetsregistret för kognitiva sjukdomar/demenssjukdomar (Svedem) har visat att effekterna av pågående behandling består över tid och tycks reducera mortaliteten [4]. Någon effekt på den underliggande sjukdomen har dock inte kunnat visas, eftersom behandlingseffekten avtar helt inom veckor efter utsättandet [5].
Nya behandlingar
Alzheimerforskningen, där Sverige har gjort stora bidrag, har rönt stora framgångar de två senaste årtiondena vad beträffar biomarkörer i blod och likvor, diagnostiska kriterier och bilddiagnostik. Detta har visat vägen för försök med sjukdomsmodifierande behandling. I januari 2024 fanns 164 läkemedelsprövningar med 127 olika läkemedel för Alzheimers sjukdom, varav 32 i fas 3-prövningar med flera olika typer av verkningsmekanismer [6].
En huvudsaklig inriktning för behandlingsförsöken har varit att minska mängden av amyloid-beta som ansamlas i olika former i hjärnan vid Alzheimers sjukdom. För knappt 20 år sedan publicerades de första resultaten gällande aktiv immunterapi, vaccin, mot amyloid-beta [7]. På grund av biverkningsprofilen gick utvecklingen med tiden allt mer över mot passiv immunterapi med intravenös infusion av monoklonala antikroppar. Antikropparna riktar sig mot olika lösliga och/eller olösliga amyloid-beta-komponenter med syfte att förhindra ansamling i plack samt även uppluckra existerande plack [7]. Dessa antikroppar har visat positiva resultat i studier på primära och sekundära variabler i tidiga sjukdomsfaser (lindrig kognitiv störning och lindrig demens vid Alzheimers sjukdom), vilket innebär effekt på både kognition, ADL och relevanta biomarkörer i cerebrospinalvätska och plasma. Även en påtaglig reduktion av amyloid-beta i hjärnan sågs vid undersökning med positronemissionstomografi (PET) [8, 9].
Kliniska godkännanden och behandling i Sverige i dag
Tre antikroppspreparat som kommit särskilt långt avseende studier och godkännandeprocesser är adukanumab, donanemab och lekanemab [7]. Adukanumab var det första som erhöll ett accelererat godkännande i USA i juni 2021. Tillverkaren meddelade dock i januari 2024 att man planerade att avveckla läkemedlet, enligt uppgift för att satsa mer på lekanemab och ett läkemedel riktat mot ansamling av proteinet tau [10]. Lekanemab, som baserats på forskning från Uppsala, erhöll accelererat godkännande i USA i januari 2023, följt av ett sedvanligt godkännande i juli 2023, för behandling av lindrig kognitiv störning eller lindrig alzheimerdemens. Lekanemab har sedan dess också godkänts i Förenade Arabemiraten, Japan, Hongkong, Israel, Kina, Storbritannien och Sydkorea [11]. European Medicines Agency (EMA) avslog ansökan om registrering för lekanemab inom EU i juli 2024, eftersom balansen mellan risk och nytta bedömdes otillfredsställande. Beslutet överklagades dock, och i november 2024 meddelade EMA att man anser att nyttan av lekanemab överstiger riskerna hos patienter som är heterozygoter eller saknar bärarskap av ε4-alleler av genen för apolipoprotein E (APOE), samma bedömning som tidigare gjorts i Storbritannien [12]. Parallellt blev donanemab i juli 2024 det tredje läkemedlet att erhålla kliniskt godkännande i USA, och i september 2024 blev det även godkänt i Japan [13]. EMA bedömer i skrivande stund ansökan för donanemab.
Innan eventuella godkända preparat kan bli aktuella för användning i större utsträckning krävs dock hälsoekonomiska bedömningar av de nya behandlingarna, vilket är en komplicerad och tidskrävande process för att säkerställa rättvis, jämlik och ändamålsenlig läkemedelsanvändning [3]. Flertalet av de multicenterstudier som utgör underlag för godkännandena har inkluderat svenska patienter. Avslutningen av studierna har öppnat för licensförskrivning, så att de som deltagit i studierna kan få fortsatt behandling. Detta har redan skett i Sverige, vilket medför att vi redan idag, i liten skala, behövt skapa en klinisk hantering av uppföljningen av dessa patienter.
Bilddiagnostik viktig del av utredningen
Basal kognitiv utredning görs huvudsakligen inom primärvården och omfattar sjukhistoria från patient och närstående, läkarundersökning, kognitiv bedömning, funktionsbedömning, blodprov samt hjärnavbildning [14]. I Sverige används i dag huvudsakligen datortomografi (DT) som förstahandsmetod för kognitiv utredning. Vid utvidgad kognitiv utredning, som oftast görs i specialistsjukvård, kan lumbalpunktion, kompletterande magnetresonanstomografi (MR) och/eller PET bli aktuell. Förutom att utesluta andra behandlingsbara orsaker till kognitiv svikt syftar avbildningen i dag även till att stärka misstanken om underliggande sjukdom som orsak till den kognitiva störningen, exempelvis vaskulära resttillstånd vid vaskulär demens och atrofimönster vid olika kognitiva sjukdomar [14].
MR kan påvisa små blödningsrester
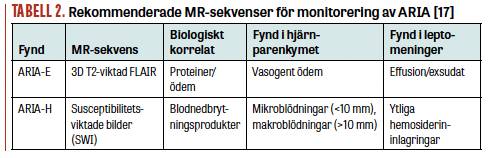
Vid Alzheimers sjukdom sker ansamling av amyloid-beta, förutom i senila plack i hjärnan, ofta även i hjärnans blodkärl. Patologisk inlagring av amyloid-beta i kärlväggar kallas för cerebral amyloid angiopati (CAA) och leder till en försvagning av kärlväggen och mikroaneurysm, vilket i sin tur ger risk för blödningar. Förekomsten av CAA vid Alzheimers sjukdom har angetts till 48 procent, jämfört med 23 procent hos åldersmatchade personer utan Alzheimers sjukdom [15]. Förutom vanliga hjärnblödningar, som oftast är symtomatiska och förhållandevis ovanliga, förekommer ofta mikroblödningar vid CAA som framför allt är belägna nära hjärnbarken i storhjärnsloberna. Det förekommer även små subaraknoidala blödningar. Dessa blödningar lämnar efter sig blodrester i form av hemosiderin, vilket har magnetiska egenskaper och kan detekteras med MR som mikroblödningsrester och kortikal superficiell sideros. Eftersom CAA är överrepresenterat vid Alzheimers sjukdom kan mikroblödningsrester och kortikal superficiell sideros stärka en befintlig misstanke om Alzheimers sjukdom i samband med diagnostiken [16].
De nya läkemedlen kan ge allvarliga biverkningar
De nya antikroppsbehandlingarna har generellt tolererats väl av patienterna, men allvarliga och livshotande händelser har inträffat i ett fåtal fall. I fas 3-studier noterades 3 dödsfall som tillskrevs behandlingen med donanemab under studiens gång och 1 dödsfall med lekanemab i förlängningsstudien [8, 9]. Noggrann säkerhetsmonitorering är således betydelsefull [17]. En vanlig biverkan är så kallade ARIA (amyloid-related imaging abnormalities), det vill säga avvikande fynd vid MR hjärna [17]. De flesta fall av ARIA leder inte till några symtom, och de är oftast spontant övergående, men kan ändå kräva anpassning av dosering, uppehåll eller utsättning av behandlingen [18]. De vanligaste symtomen är huvudvärk, förvirring, illamående och yrsel. Mindre vanliga symtom är dimsyn och andra synstörningar, gångstörningar och krampanfall. En klinisk utmaning är att symtomen är relativt ospecifika och att ARIA ofta kan vara asymtomatiska, men trots detta har klinisk betydelse [17].
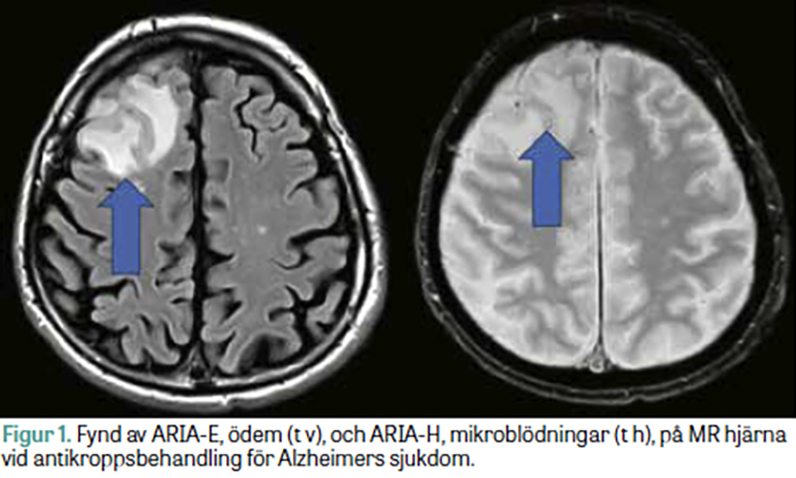
ARIA-E och ARIA-H
ARIA förekommer i två former. Subtypen ARIA-E (edema/effusion) avser förekomst av vasogent ödem och leptomeningeal påverkan, medan ARIA-H (hemorrhage) avser mikroblödningar och kortikal superficiell sideros [17]. Figur 1 exemplifierar fynd av ARIA-E och ARIA-H. Noterbart är att ARIA-liknande fynd kan uppstå även spontant utan antikroppsbehandling vid CAA, så kallad inflammatorisk CAA [16]. Ökningen av ARIA i samband med antikroppsbehandlingar tros bero på nedbrytningen och borttagandet av amyloid-beta i kärlväggarna, vilket ökar det perivaskulära dränaget och kan leda till uppluckring av blod–hjärnbarriären [17].
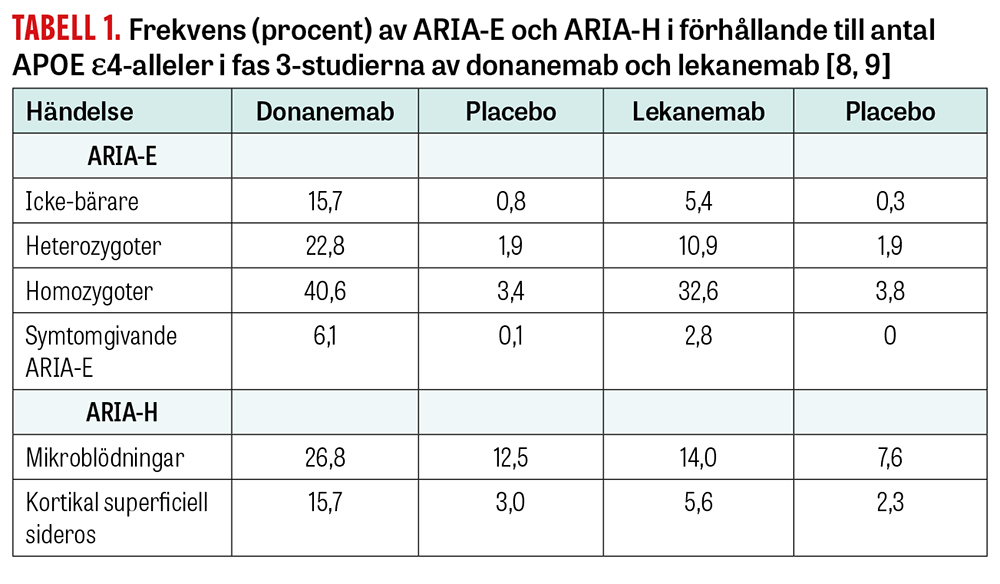
Kända riskfaktorer för ARIA är dosen av antikroppar, förekomst av CAA samt bärarskap av ε4-alleler av genen för APOE. APOE ε4, som i grunden också är en riskfaktor för Alzheimers sjukdom, ökar inte bara risken för ARIA utan leder även till tidigare uppkomst av ARIA vid antikroppsbehandling, fler återfall samt allvarligare symtombild [17]. Tabell 1 visar förekomsten av ARIA-E och ARIA-H i fas 3-studierna. Ovanstående innebär att kunskap om vilken APOE-genotyp patienten bär kan vara betydelsefull för riskvärdering. Noterbart är att godkännandet för lekanemab i Storbritannien och EU är begränsat till icke-bärare och heterozygoter av APOE ε4 [11]. Det förekommer i dag, men är inte rutin, att blodprov tas för detta genetiska test på minneskliniker i Sverige. Eftersom varje ε4-allel ökar risken att insjukna i Alzheimers sjukdom, så kräver dock eventuell testning avvägning av etiska aspekter samt rådgivning för anhöriga och patient.
Kliniskt betydelsefull säkerhetsmonitorering med MR
De patienter som under behandlingen utvecklar ARIA-E av radiologiskt svår eller medelsvår grad, alternativt lindrig grad tillsammans med symtom, ska temporärt avbryta behandlingen, och den ska inte återupptas förrän både eventuella symtom och radiologiska fynd har gått i regress. Vid lindrig ARIA-H i kombination med symtom rekommenderas att behandlingen tillfälligt avbryts. Vid medelsvår eller svår ARIA-H ska behandlingen avbrytas tills symtom gått i regress och den radiologiska bilden är stabil [18] – detta för att undvika risken för allvarligare blödningar och komplikationer. Regelbundna MR-undersökningar blir således nödvändiga för att monitorera patienter med pågående behandling [17]. I dag görs stora ansträngningar för att bättre förstå vilka som kan drabbas av ARIA och bättre kunna identifiera dem som riskerar att drabbas av allvarligare biverkningar. Handhavandet av antikroppsbehandlingar mot Alzheimers sjukdom kommer sannolikt att underlättas med dedikerade MR-protokoll, blodbiomarkörer och subkutan administrering av antikropparna.
Ökat behov av MR och radiologisk kompetens
Ovanstående risker, och särskilt det faktum att ARIA ofta är asymtomatiska, gör att ett införande av nya alzheimerläkemedel i klinisk vardag kommer att ställa markant ökade krav på bilddiagnostiska resurser [17]. Förutom kliniska bedömningar och påvisande av amyloid-beta-patologi (i blod eller likvor eller med PET) kommer aktuella patienter att behöva genomgå MR som baslinjeundersökning och för riskstratifiering baserat på förekomst av blödningsrester och eventuellt APOE-status. I de kliniska prövningarna av de nya läkemedlen har man haft som krav att MR-undersökning av hjärna ska ha utförts innan en behandling startas. Vidare ska MR utföras ytterligare 3 gånger första halvåret samt vid oväntad klinisk försämring [18]. Vid Karolinska universitetssjukhuset beräknas ett begränsat införande om exempelvis 100 patienter innebära en ökning med ungefär 600 MR-undersökningar av hjärnan per år, till en kostnad av ca 3,5 miljoner kronor. Ökningen motsvarar ca 3 procent av det totala antalet neuroradiologiska MR-undersökningar som utförs årligen på sjukhuset. Införandet av läkemedlen skulle således starkt påverka de neuroradiologiska klinikerna vid universitetssjukhusen i ett första skede, och senare även på andra radiologiska kliniker vid ett bredare införande. Förutom tillgång till MR-kameror och rätt protokoll kommer det även att ställa stora krav på kompetens och resurser för att bedöma ARIA-fynd. Redan i dagsläget har många radiologiska kliniker svårt att hitta tillräcklig bemanning med en ständigt stigande efterfrågan på radiologisk diagnostik. Även om datorstöd utvecklas för att underlätta dessa ARIA-bedömningar [19] är den praktiska nyttan av detta ännu oklar, och det förväntas ta tid innan det finns godkänt för kliniskt bruk och kan användas i rutinsjukvård.
Svenska rekommendationer för ARIA-övervakning
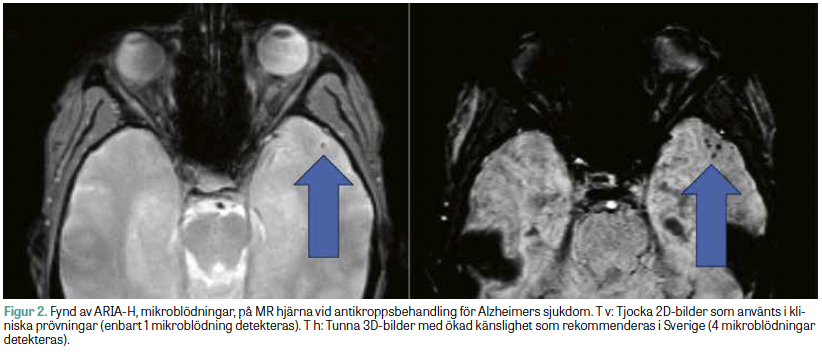
För att detektera och följa ARIA bör helst en MR-kamera med en fältstyrka på 3 Tesla användas, eftersom känsligheten för blodnedbrytningsprodukter ökar med fältstyrkan. Det är dock inte bara fältstyrkan som spelar roll. I de kliniska prövningarna har ofta enkla MR-sekvenser använts med tjocka (5 mm) 2D-snitt, bland annat traditionella T2*-viktade bilder och så kallad FLAIR-sekvens. Mycket talar dock för att modern 3D-baserad bildtagning med tunna snitt och susceptibilitetsviktade bilder (SWI) är att föredra på grund av högre känslighet av relevanta fynd, eftersom SWI har högre känslighet för mikroblödningar och 3D-sekvenser underlättar jämförelser av undersökningar över tid [20]. Figur 2 illustrerar skillnaden i känslighet för mikroblödningar vid ARIA-H mellan T2*-viktade bilder och SWI. Denna modernare standard är tillgänglig på alla svenska universitetssjukhus och hos de flesta mindre vårdgivare och har således potential att möjliggöra säkrare terapimonitorering, vilket skulle kunna påverka risk–nytta-värderingen av läkemedlen, men frågan är inte okomplicerad, då studierna som använts som underlag för kliniskt godkännande använt tjockare och enklare bildsekvenser. Frågan har diskuterats av styrelsen för Svensk förening för neuroradiologi (SFNR), som rekommenderar ett förenklat och tidseffektivt MR-protokoll för rutinkontroller baserat på modern standard; se Tabell 2. Vid baslinjeundersökning inför behandlingsstart används ett bredare MR-protokoll för neurodegenerativa sjukdomar, där man även inkluderar de tjockare snitten för att indikationen ska vara direkt jämförbar med tidigare kliniska prövningar. På SFNR:s webbplats återfinns förutom rekommenderade MR-protokoll även svarsmallar för demensdiagnostik, inklusive bedömningen av ARIA [21].
Betydelsen för sjukvårdssystemet
En avgörande fråga vid eventuellt godkännande av läkemedlen är deras medicinska och samhällsekonomiska nytta i förhållande till prissättningen och kostnaderna för läkemedelshantering och monitorering. Detta kommer att kräva noggranna analyser från Tandvårds- och läkemedelsförmånsverket. Utmaningarna för hälso- och sjukvårdssystemet kommer att vara stora, men inte nödvändigtvis oövervinneliga. Erfarenheter från andra specialiteter, speciellt inom onkologin, visar att även behandlingar som krävt PET-undersökningar, genetiska analyser och blodtest kan införas med god planering. Samtidigt visar tidigare erfarenheter från neurologin att biokemiska analyser och korta MR-kontroller kan ha stor betydelse för att skapa en adekvat risk–nytta-bedömning vid behandling med vissa monoklonala antikroppar (exempelvis riskstratifiering för progressiv multifokal leukoencefalopati vid behandling med natalizumab) [22].
En svårighet är dock att nya läkemedel för Alzheimers sjukdom skulle beröra en potentiellt mycket stor patientgrupp [23]. En svensk populationsbaserad studie visade att ungefär 6 procent av hemmaboende 70-åringar skulle kunna ha indikation för behandling med lekanemab [24]. Samtidigt har en studie av svenska förhållanden dock visat att enbart en liten andel (13 procent) av patienterna på en minnesklinik skulle uppfylla strikta kriterier för behandling [25].
En tänkvärd aspekt är också att Sverige skiljer sig från USA och övriga Europa avseende utredningsstrategi. I Sverige används DT som primär hjärnavbildningsmetod för de flesta personer med kognitiv svikt, och endast en mindre andel genomgår MR, vilket är en dyrare och mer begränsad resurs. En europeisk enkätundersökning från 2017 som omfattade 193 radiologiska kliniker i 28 länder visade att 72 procent av utredande centrum redan använder MR som förstahandsmetod vid kognitiv utredning [26]. Sverige har också en stark tradition av lumbalpunktion och likvoranalys för att mäta nivåer av amyloid och tau, medan man i andra delar av världen i högre utsträckning använder amyloid-PET. När riktlinjer för kliniskt införande av antikroppsbehandlingar mot Alzheimers sjukdom införs finns därför en påtaglig risk att metodvalen, som är anpassade för europeisk och amerikansk tradition, skulle innebära en stor omställning för svensk sjukvård – inte minst avseende behovet av amyloid-PET och antalet MR-undersökningar. Diagnostik och monitorering baserad på blodprov samt förbättrade bedömningsmodeller, som nyligen sammanfattats i Läkartidningen [27], kan på sikt underlätta för sjukvårdssystemet. Biomarkörernas roll i diagnostiken av Alzheimers sjukdom har dock också nyligen debatterats i Läkartidningen [28-30], talande för olika perspektiv kring diagnostiken även inom Sverige.
Behov av nationell förberedelse och samordning
Det finns i nuläget inget vårdprogram eller annat samlat kunskapsunderlag för hur den svenska sjukvården ska implementera dessa behandlingar i kliniskt bruk. Nyligen har Region Stockholms läkemedelskommittés expertgrupp för äldres hälsa publicerat ett utlåtande där man avråder från ytterligare licensförskrivning av lekanemab och donanemab, och man påpekar särskilt att många praktiska frågor kvarstår [31]. Samtidigt har NT-rådet beslutat om nationell samverkan för dessa läkemedel. En svårighet med planeringen är att de aktuella patientflödena omfattar en rad olika specialiteter, bland annat allmänmedicin, geriatrik, psykiatri, neurologi, klinisk genetik, radiologi, neuroradiologi och nuklearmedicin. Det finns således ett stort och angeläget behov av samordning, förberedelser och fortbildning med särskild hänsyn till de förutsättningar som råder i Sverige. Ett svenskt nationellt vårdprogram genom samverkan mellan nationella programområden eller svenska nationella riktlinjer från Socialstyrelsen skulle exempelvis proaktivt kunna begränsa resursbehoven genom kloka val. Oavsett hur dessa utformas så förväntas dock införandet av nya läkemedel för Alzheimers sjukdom innebära ett ökat behov av kringresurser och bilddiagnostik. Detta kan leda till flaskhalsar och undanträngningseffekter om inte kapaciteten samtidigt höjs. Det kommer också att bli en utmaning att erbjuda likvärdig vård i hela landet, då det redan nu råder skillnader i befintliga resurser mellan olika regioner. Detta gäller inte minst ledtider i utredning och diagnostik, där det kommer finnas ett behov av att hitta patienter tidigt, då de fortfarande är aktuella för behandling. Sammantaget kommer de ökade resursbehoven att leda till behov av horisontella prioriteringar som rimligen behöver förankras i samhället på politisk nivå.
Sammanfattning
Behandlingen av Alzheimers sjukdom står inför ett potentiellt paradigmskifte. Införandet av sjukdomsmodifierande läkemedel i tidigt skede av sjukdomen ger hopp om allt bättre behandling, men innebär samtidigt en stor samhällsekonomisk utmaning. Nyligen har det första läkemedlet erhållit ett begränsat godkännande inom EU, och ytterligare ett annat läkemedel är under bedömning. Detta kommer, förutom subvention av läkemedel, även att kräva påtagligt ökade resurser hos regionerna, bland annat i form av infusionskapacitet och diagnostiska undersökningar. En särskilt komplicerad fråga kommer att vara behovet av ökade MR-resurser för säker uppföljning av behandlingarna. Eftersom man redan i dag i Sverige har behandlat tidigare studiedeltagare på licens med dessa nya läkemedel finns det möjligheter att bygga på erfarenheter kring hur detta bäst kan lösas för ett nationellt vårdprogram eller nationella riktlinjer samt vidare kunskapsspridning nationellt och internationellt när bredare användning eventuellt blir aktuell.
Potentiella bindningar eller jävsförhållanden: Anne Börjesson Hanson har medverkat som klinisk prövare för AC Immune, Alector, Araclon, Biogen, Eisai, GSK, Janssen-Cilag, Novartis, Novo Nordisk och Roche samt erhållit arvode från Bioarctic, Lilly, Novo Nordisk och Roche. Hans Basun är anställd av och aktieägare i Bioarctic AB. Lars-Olof Wahlund har erhållit arvode för rådgivande kommitté från Bioarctic AB.
Rättad 2024-11-29 avseende värden för ARIA-E och lekanemab i Tabell 1.
(uppdaterad 2024-12-03)