Akut njurskada är ett heterogent multifaktoriellt syndrom och uppstår ofta sekundärt till andra sjukdomar och organsvikter.
Trots att nya biomarkörer existerar så används fortfarande förändringar i kreatinin eller diures – bägge mått på njurfunktion – för att gradera njurskada.
Akut njurskada är associerad med ökande morbiditet och mortalitet.
Akut njurskada bör monitoreras noggrant och njurarna skyddas i görligaste mån. Om njurfunktionen försämras bör man påbörja njurersättningsterapi.
Vår syn på akut njurskada har ändrats. Den beskrivs inte längre som en enskild sjukdom, utan anses numera vara ett multifaktoriellt syndrom med komplex och varierande patofysiologi och prognos [1]. Historiskt har över 50 olika definitioner av akut njurskada använts, och av det har följt att rapporterad incidens och utfall har varierat kraftigt. Angående nomenklaturen så används »akut njurskada« (AKI, acute kidney injury) för sänkt njurfunktion under 1–7 dagar, »akut njursjukdom« (AKD, acute kidney disease) för sänkt njurfunktion under 8–90 dagar och »kronisk njursjukdom« (CKD, chronic kidney disease) för sänkt njurfunktion under 91 dagar och uppåt. Vidare används termen »terminal njurskada« (ESRD, end-stage renal disease) för irreversibel förlust av njurfunktionen där patienten är permanent dialysberoende (Figur 1).
Det är viktigt att ha i minnet att en patient med en redan manifest kronisk njursjukdom kan få en akut njurskada, det vill säga »akut på kronisk« njursjukdom (acute on chronic renal failure), och då är oddsen betydligt sämre.
Publiceringen av RIFLE-kriterierna (Risk, injury, failure, loss, and end-stage kidney disease), följt av AKIN (Acute kidney injury network) samt den nuvarande konsensusklassificeringen KDIGO (Kidney disease improving global outcomes) år 2012 [2] har varit instrumentell för studier. Dessa visar generellt hög incidens av akut njurskada globalt, liksom ett starkt samband mellan svårighetsgrad av akut njurskada och hög risk för kort- och långsiktiga komplikationer, inklusive kronisk njursjukdom och terminal njurskada med behov av livslång njurersättande behandling med dialys eller njurtransplantation samt ekonomiska konsekvenser [3-6]. Mortaliteten hos kritiskt sjuka patienter med akut njurskada och akut njursjukdom är hög, men varierar beroende på Iva-population [7].
Akut njurskada: patofysiologi
Akut njurskada kan förorsakas av en kombination av ett flertal bakomliggande orsaker (låg hjärtminutvolym, sepsis, omfattande kirurgi, läkemedel med mera) och patofysiologiska mekanismer (hypoperfusion, inflammation) och uppvisar en varierande klinisk presentation i form av allvarlighetsgrad och utveckling över tid [8]. Flera olika patofysiologiska processer sker simultant eller i sekvens hos en och samma patient: endoteldysfunktion, påverkan på mikrocirkulationen, tubulär skada, venös stas och intrarenal inflammation (Figur 2). En mångfald av olika immunologiska celler från både njuren och den systemiska cirkulationen spelar roll för utvecklingen, platåfasen och återhämtningen av akut njurskada [9].
Akut njurskada: definition, diagnos och gradering
Akut förlust eller sänkning av njurfunktion definieras traditionellt genom ansamling av biomarkören kreatinin i serum; dock kan oliguri eller anuri vara det enda tecknet på akut njurskada i sjukvårdssituationer där biomarkörer inte mäts och i sjukvårdssammanhang där patientens volymstatus övervakas noggrant – till exempel på intensivvårdsavdelning [10].
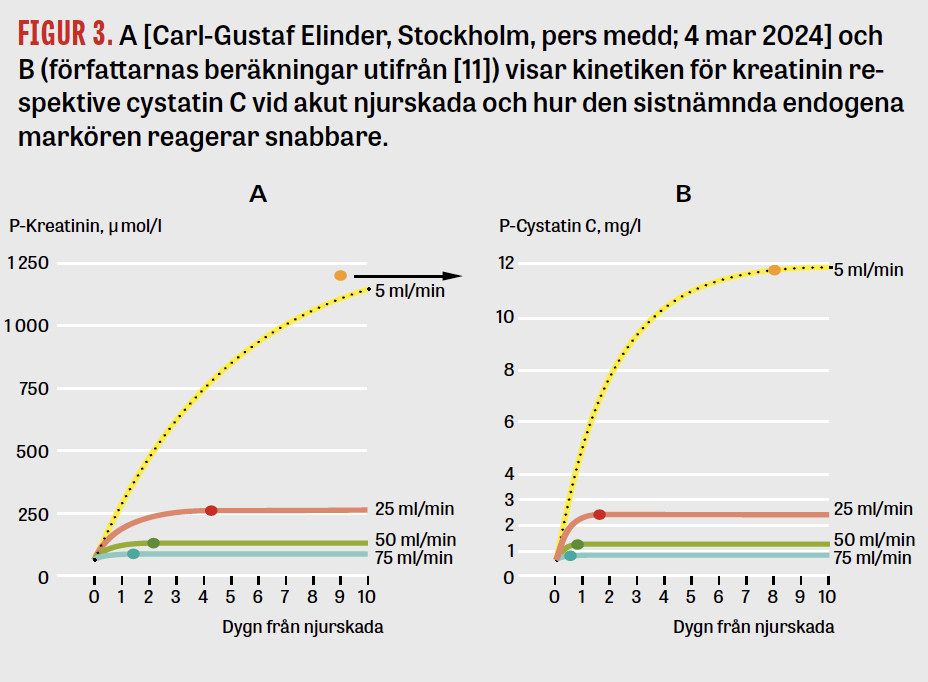
Skattning av GFR (glomerulär filtrationshastighet) med hjälp av en endogen markör görs vanligen baserat på dess jämviktskoncentration i blodplasma (eller serum). Det är mycket viktigt att tänka på att en pågående eller nyligen inträffad njurskada betyder att jämvikt inte föreligger (Figur 3A, B). Jämviktskoncentrationen av en lämplig endogen markör är bildningshastigheten (till exempel μmol/min) dividerad med GFR. Om bildningshastigheten av kreatinin exempelvis är 7 μmol/min och patienten har ett GFR på 100 ml min så är jämviktskoncentrationen 7/0,1 = 70 μmol/l (i själva verket ytterligare något lägre på grund av att en del kreatinin också utsöndras tubulärt).
Tiden det tar att uppnå jämviktskoncentrationen är enligt klassisk farmakokinetik cirka 5½ halveringstider. Halveringstiden (tiden att halvera koncentrationen givet att bildningshastigheten är 0) beror dock inte på bildningshastigheten utan enbart på GFR och distributionsvolymen (VD) och kan approximeras med ekvationen T1/2 = 0,7 × VD/GFR. Om distributionsvolymen exempelvis är 40 l (ungefär lika med kroppsvattnet hos en person som väger 70 kg) och GFR 100 ml/min så är halveringstiden 280 min, och det tar cirka 5½ × 280 = 1 540 min (lite mer än ett dygn) att uppnå jämvikt. Dock vid kraftigt nedsatt GFR, låt säga 10 ml/min, blir halveringstiden hela tio gånger längre än i exemplet och det tar åtskilliga dygn innan jämvikt har uppnåtts. För cystatin C går det 3 gånger snabbare att uppnå jämvikt eftersom distributionsvolymen är cirka 3 gånger lägre [11]. Sammantaget är kreatinin en relativt okänslig parameter för diagnostisering av tidig akut njurskada jämfört med oliguri/anuri och cystatin C.
Svårighetsgraden av akut njurskada klassificeras med KDIGO-riktlinjerna i tre stadier baserat antingen på ökningen i serumkreatinin eller på varaktighet och – vid adekvat hydrering – omfattning av oliguri [12-14] (Tabell 1). Det är viktigt att förstå att dessa kriterier inte ersätter klinisk bedömning. Utvidgade test inklusive mätning av komplementära biomarkörer som cystatin C [15] eller andra blod- eller urinprov samt njurultraljud kan krävas för att fastställa orsakerna till akut njurskada.
En diagnostisk checklista som inkluderar klinisk kontext, alternativa diagnoser och trender i eventuella förändringar i serumkreatinin, urea, cystatin C och diures kan vara till hjälp [17]. Patienter som är äldre än 65 år och de som lider av diabetes mellitus, kronisk njursjukdom, hjärtsvikt eller anemi samt de som har varit utsatta för predisponerande faktorer (såsom sepsis, omfattande kirurgi eller nefrotoxiner) har en kraftigt ökad risk för att utveckla akut njurskada.
Hos vissa patienter indikerar höga nivåer av urinbiomarkörer, såsom NGAL (neutrophil gelatinaseassociated lipocalin), TIMP-2 (tissue inhibitor of metalloproteinases 2), IGFBP7 (insulin-like growth factor-associated protein 7) och kitinas 3-liknande protein 1 njurskada i frånvaro av andra tecken på akut njurskada [18-20]. En biomarkördetekterad episod av akut njurskada följs vanligen av ökad koncentration av kreatinin i serum hos en patient med en underliggande njursjukdom, medan sådana episoder hos en frisk individ ofta förblir subkliniska, det vill säga utan en samtidig påvisbar ökning av serumkreatinin.
Ruby-studien testade kandidatmarkörers förmåga att predicera kronisk njurskada, och CCL14 (C-C motif chemokine ligand 14) i urin visade sig vara prediktiv för kronisk njurskada hos patienter med svår akut njurskada [21].
I tillägg till nya biomarkörer för att förbättra diagnostiken av akut njurskada finns ultraljud, som kan upptäcka hydronefros och postrenalt hinder. Renalt resistansindex (RRI) är ett doppler-deriverat verktyg för att undersöka förändringar i njurperfusion [22, 23]. Metoden har potential, då den är icke-invasiv och tillgänglig »bedside«. I många studier inom perioperativ medicin och intensivvård har RRI visats kunna förutse akut njurskada tidigt vid chock samt akut njurskadeprogression efter stor kirurgi och dessutom vara lätt att ta till sig för både vana och ovana användare av ultraljud [24].
Handläggning av akut njurskada
Patienter med nyupptäckt kreatininstegring (eller nedsatt estimerad GFR, eGFR) ska genomgå basal utredning, vars syfte är att identifiera orsaken till njurfunktionsnedsättningen. Det brukar underlätta att dela in tänkbara orsaker i prerenala, intrarenala och postrenala (Tabell 2 nästa uppslag). Akut njursvikt har i de allra flesta fall pre- eller postrenal orsak och kan avhjälpas genom att åtgärda orsaken (intravenös vätska, urinkateter etc). Intrarenala orsaker resulterar i princip alltid i någon grad av mikro- eller makroalbuminuri, vilken lätt kan kvantifieras med urin-albumin/kreatininkvot. En helt normal urin-albumin/kreatininkvot talar emot intrarenal orsak. Vidare bör omedelbart livshotande symtom, till exempel hyperkalemi, grav metabol acidos eller hotande lungödem, undersökas. Om sådana föreligger bör patienten skyndsamt skickas till en akutmottagning. En kaliumnivå över 5,0 mmol/l som stiger okontrollerat bör anses urakut. Den enskilt vanligaste orsaken till akut njurskada hos patienter som söker i öppen vård är postrenalt utflödeshinder, vilket i många fall är relativt lätt att åtgärda.
Hos en kritiskt sjuk patient som uppvisar akut njurskada förekommer njursvikten sällan ensam, utan uppträder i stället tillsammans med (och ofta som ett resultat av) annan akut organsvikt. Akut njurskada försämrar prognosen avsevärt, och därför bör njurarna skyddas så långt det går. Ofta måste generell vård, det vill säga åtgärder som potentiellt belastar njurarna, till exempel koronarangiografi med kontrast, gå före skydd av njurarna. Minskning av generell mortalitet måste ges förtur, och skyddande av njurfunktionen kommer i andra hand.
Risk för kronisk och terminal njursvikt har studerats i Sverige, där kronisk njursvikt var mycket vanligare hos akut njurskadeöverlevare på Iva än hos dem som inte hade haft akut njurskada på Iva: 6 procent än 0,44 procent. AKI-patienter hade även klart högre risk för terminal njurskada jämfört med icke-AKI-patienter: 2 procent jämfört med 0,08 procent, respektive 3,9 procent jämfört med 0,3 procent vid 1-års- och 5-årsuppföljning [5, 6].
Prevention av akut njurskada
Primär prevention av akut njurskada, det vill säga åtgärder som syftar till att förhindra minskningen av GFR, är en utmaning eftersom diagnosen akut njurskada är beroende av påverkan på njurfunktion, minskning av GFR och ansamling av serumkreatinin. Själva njurskadan kan således redan ha uppstått och manifesterats när diagnosen ställs.
Därför kan vi konstatera att det viktigaste när det gäller prevention är kunskap om generella riskfaktorer, så att vi kan känna igen riskpatienter [25]. Oavsett patofysiologisk genes till akut njurskada finns gemensamma nämnare. Dessa inkluderar ålder och komorbiditeter som tidigare njur- eller leverpåverkan, hjärtsvikt och diabetes. Delvis modifierbara faktorer inkluderar hypovolemi, hypotension, sepsis och exponering för nefrotoxiska läkemedel (exempelvis aminoglykosider, amfotericin, immunhämmande läkemedel, NSAID och ACE-hämmare) samt det essentiella: att säkerställa att inte postrenalt utflödeshinder föreligger.
Det anses att optimering av hemodynamik och korrigering av eventuell volymbrist har en gynnsam effekt på njurfunktionen, hjälper till att minimera ytterligare försämring av njurskadan och potentiellt underlättar återhämtning från akut njurskada med minimering av eventuell kvarvarande funktionsnedsättning [26]. Konservativ vätskeadministrering (positiv vätskebalans under 7 dagar med i genomsnitt endast 136 ml) jämfört med liberal metod (positiv vätskebalans under 7 dagar med 6 992 ml) möjliggjorde dock snabbare avvänjning från mekanisk ventilation med en minskning av antalet intensivvårdsdygn och ingen påvisad negativ effekt på njurfunktionen [27].
Till skillnad från ARDS-nätverkets Iva-studier fann Relief-studien, som jämförde 1 490 bukkirurgipatienter med restriktiv vätskebehandling (3,7 liter) och 1 493 med liberal vätskebehandling (6,1 liter), att restriktiv behandling inte var gynnsam. Ingen skillnad i överlevnad noterades, men akut njurskada var signifikant vanligare vid restriktiv vätskebehandling (8,6 procent) än vid liberal vätskebehandling (5,0 procent) [28]. Dock måste konstateras att liberal vätskebehandling inte är ett absolut begrepp utan kan variera från patient till patient.
Beträffande vätskeval bör stärkelsebaserade syntetiska kolloida lösningar (hydroxietylstärkelse, HES) undvikas. I en Cochrane-analys av >11 000 patienter fann man att HES ökar risken för akut njurskada och behovet av njurersättningsterapi [29]. I en metaanalys sågs inga vinster med att ge albumin jämfört med kristalloider med avseende på renalt utfall (detta gäller inte patienter med hypoalbuminemi) [30]. När det gäller kristalloider har flera randomiserade studier jämfört balanserade lösningar med natriumklorid, och resultaten varierar. I Split-studien randomiserades 2 278 patienter till Plasmalyte (en buffrad lösning) eller natriumklorid ,och man såg inga skillnader i risk för akut njurskada [31]. I Smart-studien randomiserades 15 802 Iva-patienter till natriumklorid eller buffrad lösning, och där rapporterades signifikant sänkt risk för allvarliga njurhändelser (major adverse kidney events, MAKE) – behov av njurersättningsterapi, persisterande kreatininvärde >=200 procent av patientens baslinje och/eller död – hos dem som fick buffrad kristalloid vätska [32]. En studie av patienter på en akutmottagning, Salt-ED, randomiserade 13 347 patienter till natriumklorid eller buffrad lösning; även där var risken för allvarlig njurhändelse lägre hos dem som fick buffrad vätska [33]. Sammantaget tyder data på att buffrade lösningar är att föredra hos patienter som löper risk för akut njurskada, såvida de inte har hypovolemi och samtidig hypokloremi (till exempel efter långvariga kräkningar).
Beträffande röntgenkontrast bör man känna till de bägge förkortningarna CIN (kontrastinducerad nefropati) och CA-AKI (kontrastassocierad akut njurskada), som tyvärr ofta blandas ihop. Än viktigare att känna till är att den största metaanalysen av fenomenet – med 25 950 patienter – inte kunde påvisa ökad risk för akut njurskada hos dem som fått kontrast jämfört med dem som inte hade fått kontrast [34]. Enligt en artikel i American Journal of Roentgenology råder enighet bland radiologer och nefrologer om att moderna intravenösa kontrastmedel är säkra och inte medför ökad risk för akut njurskada eller relaterade negativa utfall hos de flesta patienter med normal till måttligt nedsatt njurfunktion (eGFR >30 ml/min/1,73 m²) [35]. Övergripande kan det konstateras att akut njurskada ibland kan förhindras genom att behålla normal vätskebalans, blodvolym och blodtryck hos patienter med trauma, brännskador eller massiv blödning och patienter som genomgår omfattande kirurgi [36-38].
När ska kontinuerlig dialys startas?
Det har funnits en lång debatt om när dialysbehandling ska påbörjas hos en patient med akut njurskada. Hyperkalemi eller diuretikaresistent lungödem är absoluta indikationer, medan basöverskott lägre än –10 mmol/l är en relativ indikation. Kombinerade svåra elektrolyt- och syra–basrubbningar kan vara svåra att behandla isolerat och kan utgöra en relativ dialysindikation.
Att använda loopdiuretika innan njurersättningsterapi påbörjas är vanligt, och ett så kallat furosemid-stresstest är ett standardiserat sätt att pröva om den kritiskt sjuka patienten verkligen är diuretikaresistent [39]. Testet innebär ofta att doser från 0,8 upp till 1,5 mg/kg ges intravenöst beroende på om patienterna tidigare ordinerats diuretika eller inte [39].
Beslutet att påbörja njurersättningsterapi bör alltid vara baserat på en sammanfattad bedömning. Ingen av de randomiserade multicenterstudierna AKIKI (n = 620) [40], Ideal-ICU (n = 488) [41] eller STARRT-AKI (n = 3019) [42] kunde visa att tidig start gav mortalitetsvinst. I samtliga dessa studier jämfördes ett tidigt tidsfönster (6, 12, 12 timmar) med hur länge blodparametrar hölls stabila (kalium, urea, grad av metabol acidos) samt vätskelast. Noterbart är att samtliga tre studier undersökte intermittent hemodialys och kontinuerlig njurersättningsterapi. Den enda randomiserade studien, ELAIN (n = 231), som studerade tajmning enbart med kontinuerlig njurersättningsterapi, visade ökad överlevnad i gruppen som randomiserades till tidig start [43]. Den franska AKIKI2-studien (n = 278) [44], där patienter randomiserades till sen eller ännu senare start, visade signifikant ökad mortalitet (65 procent ökad risk för död vid 60 dagars uppföljning) i den sistnämnda gruppen. Det är således riskfyllt att vänta för länge.
Vilken form av njurersättningsterapi för kritiskt sjuka?
Kontinuerlig dialys (continuous renal replacement therapy, CRRT) innebär långsammare vätskeborttag, bättre hemodynamisk tolerans och stabilare elektrolytkontroll än intermittent hemodialys (IHD). Hos kritiskt sjuka instabila patienter är kontinuerlig dialys traditionellt förstahandsalternativet i Sverige. I den enda randomiserade studien som publicerats, där CRRT och IHD jämfördes, sågs bättre njuråterhämtning hos CRRT-patienter [45]. Förutom denna lyser randomiserade studier med sin frånvaro, och samtliga nedanstående resultat måste tolkas med försiktighet, då det rör sig om observationella studier.
Två sekundära analyser visar fynd som kontrasterar mot varandra: i en mindre fransk studie (n = 543) sågs ingen mortalitetsskillnad när kontinuerlig och intermittent modalitet jämfördes [46]. Vid analys av CRRT jämfört med IHD (n = 2196) i den internationella STARRT-AKI-studien var CRRT associerat med signifikant lägre risk för permanent dialysberoende och död [47], men skillnaden drevs huvudsakligen av lägre risk för permanent dialysberoende vid kontinuerlig njurersättningsterapi. I en randomiserad studie av dialysdos, ATN-studien (se nedan), fann man i sekundära analyser att de patienter som fått IHD 6 gånger/vecka, jämfört med 3 gånger/vecka, hade högre risk att inte återhämta njurfunktionen [48]. Liknande fynd gjordes i en svensk kontext och i en stor systematisk metaanalys [49, 50].
Njurersättningsterapi med högre dialysdos respektive normaldos har jämförts i två stora multicenterstudier, ATN-studien [51] (563 patienter i högintensitetsgruppen mot 561 i lågintensitetsgruppen; både intermittent och kontinuerlig behandling kom i fråga med utfallsmåttet 60 dagarsmortalitet) och Renalstudien [52] (721 patienter med högdos mot 743 med låg-/normaldos, där enbart kontinuerlig behandling användes med utfallsmåttet 90-dagarsmortalitet), och ingendera kunde påvisa mortalitetsvinst.
Antikoagulans vid kontinuerlig dialys?
Systemisk antikoagulation med ofraktionerat heparin eller lågmolekylära hepariner innebär alltid en viss blödningsrisk hos patienten. Ofraktionerat heparin kan dosjusteras med aktiverad partiell tromboplastintid (APTT) 1,5–2 gånger över det normala i postfilter-blodprov från dialyskretsen, medan lågmolekylära hepariner är svårare att dosera, men anti-Xa-test kan användas. Heparininducerad trombocytopeni är en annan risk med hepariner.
Regional antikoagulation enbart i dialyskretsen kan uppnås genom att tillföra citrat till blodet i dialyskretsen före filtret. Detta kelerar joniserat kalcium till biologiskt inaktiva kalcium–citratkomplex och sänker joniserat kalcium till 0,25–0,50 mmol/l i filtret, vilket upphäver blodets levringsförmåga. Kalcium–citratkomplexen dialyseras bort över filtermembranet, och därefter substitueras matchande mängd kalcium till blodet innan det går tillbaka till patienten så att systemiskt joniserat kalcium bibehålles på fysiologisk nivå (0,90–1,20 mmol/l) systemiskt i patienten [53]. Regional citratantikoagulans är populärt och rekommenderas av KDIGO [54].
När bör kontinuerlig dialys avslutas?
En ambitiös systematisk översikt har sammanställt data från 11 studier [55]. Man fann att kronisk njursjukdom, lång CRRT-duration och låg urinproduktion vid CRRT-avslut var associerade till misslyckad avvänjning, medan större egen urinproduktion var sammankopplad med högre chans för lyckad avvänjning från CRRT.
Konklusion
Akut njurskada är ett heterogent multifaktoriellt syndrom. Trots att nya biomarkörer existerar så används fortfarande förändringar i kreatinin eller diures – bägge mått på njurfunktion – för att gradera njurskada. Njuren har ett flertal övriga funktioner, såsom reglering av vätskebalans, elektrolytbalans och hemodynamik. Dessutom är njuren endokrinologiskt aktiv och utsöndrar bland annat renin och erytropoetin. Alla funktioner i njuren kan skadas. Akut njurskada är signifikant associerad med ökad morbiditet och mortalitet.
Akut njurskada uppstår ofta sekundärt till andra sjukdomar eller organsvikter. De flesta fall av akut njursvikt har pre- och postrenala orsaker som oftast kan härledas från anamnes och status. Förhöjd urin-albumin/kreatininkvot, särskilt markant förhöjda värden >> 100 mg/mmol, talar för intrarenal orsak och bör handläggas i samråd med nefrolog.
Svåra elektrolytrubbningar, särskilt hyperkalemi, allvarlig metabol acidos samt grav övervätskning, kräver skyndsam handläggning och i behandlingsrefraktära eller livshotande fall njurersättande behandling i form av dialys. Om inget akut livshotande tillstånd kan identifieras bör njursvikten reverseras, och om detta inte lyckas bör man remittera patienten till en nefrologmottagning.
Akut njurskada hos kritiskt sjuka patienter är ofta kopplad till annan svår multiorgansvikt. Akut njurskada bör monitoreras noggrant och njurarna skyddas i görligaste mån, och om njurfunktionen försämras bör njurersättningsterapi påbörjas.
Potentiella bindningar eller jävsförhållanden: Max Bell och Marcus Broman har erhållit forskningsstipendier från Vantive. Carl Öberg har erhållit forskningsanslag från Fresenius Medical Care och Vantive och har arbetat som konsult åt Gambro Dialysatoren GmbH och Bioscience Valuation GmbH. Vidare har Carl Öberg patent och patentansökningar tillsammans med Gambro Lundia AB (Vantive), har fått talarstipendium från Boehringer Ingelheim och sitter i redaktionerna för Peritoneal Dialysis International och Nature Scientific Reports.
(uppdaterad 2025-06-16)








![Figur 4. Den senaste generationens system för kontinuerlig njurersättningsterapi som används i Sverige: a) Prismax (Baxter), b) Omni (Braun), c) Multifiltrate PRO (Fresenius) och d) Nx-Stage (NxStage). Man kan köra hemodiafiltration och terapeutisk plasmaferes (TPE) på de flesta maskiner. Det finns rön som tyder på att TPE kan vara ett alternativ vid sepsis [56, 57]. Aktiv forskning pågår även med filter som kan adsorbera endotoxiner och filtrera fragment av eller till och med hela virus och bakterier. Dessutom kan dessa behandlingar användas vid intoxikationer och vid svår leversvikt.](https://lakartidningen.se/wp-content/uploads/2025/05/W_Figur-4.jpg)















