ECMO används för svårt sjuka patienter med reversibel hjärt– och/eller lungsvikt, när all annan intensivvård sviktar.
ECMO används allt mer och på nya indikationer. Hittills har fler än 60 000 fall registrerats i världen. Vid ECMO Center Karolinska har fler än 900 patienter vårdats sedan starten 1987.
Korttidsöverlevnaden är 55–75 procent, men lite är hittills känt om långtidsprognos.
I vår studie undersöktes 217 patienter som vårdades år 1995–2005, med en genomsnittlig uppföljningstid på 7,9 år.
Av de patienter som överlevt de första 90 dagarna efter ECMO-behandling levde 91 procent 5 år senare.
Vi konkluderar att ECMO-behandlade patienter har en god långtidsprognos i alla åldersgrupper.
ECMO betyder extrakorporeal membranoxygenering, det vill säga syresättning av blodet utanför kroppen genom en konstgjord lunga, och är ett slags hjärt–lungmaskin för långtidsanvändning. Metoden har använts i Sverige sedan slutet av 1980-talet. På Karolinska universitetssjukhuset i Solna finns den i Sverige enda specialiserade intensivvårdsavdelningen med för ändamålet specialutbildad personal. Tidigare erfarenheter från ECMO Center Karolinska finns beskrivna i Läkartidningen 2004 [1].
När en patient – nyfödd, barn eller vuxen – har en livshotande andnings- och/eller cirkulationssvikt, kan ECMO vara en livräddande behandling. Patienter som är aktuella för ECMO bedöms före behandling ha en risk att avlida på omkring 80 procent trots all annan tillgänglig intensivvård [2]. ECMO-behandlingen köper tid för patienterna medan kroppen tillåts återhämta sig med hjälp av andra medicinska och kirurgiska åtgärder. ECMO är en extremt invasiv och resurskrävande metod, varför en rad urvalskriterier för behandling finns. Endast mycket svårt sjuka patienter där konventionell terapi sviktar, men med ett tillstånd som bedöms kunna vara behandlingsbart, kan bli aktuella. Vid ECMO Center Karolinska vårdas framför allt patienter med grav respiratorisk svikt vid till exempel svår sepsis och pneumonier. Bland neonatala patienter dominerar diagnoserna medfött diafragmabråck och mekoniumaspiration.
I korthet går metoden ut på att patientens venösa blod dräneras via en grov kanyl positionerad i en stor ven eller i höger förmak. Därefter leds blodet med hjälp av ett pumpsystem genom ett syresatt membran, den så kallade oxygenatorn (Figur 1). Denna fungerar som patientens lunga eftersom den via gasernas partialtryck över membranet tillför syre och transporterar bort koldioxid. Det syresatta blodet värms upp och förs åter in i patientens kretslopp genom en kateter belägen i en stor ven eller i höger förmak, varefter patientens hjärta pumpar blodet vidare ut i kroppen – så kallad venovenös ECMO. Vid behov kan blodet föras tillbaka på den arteriella sidan, så kallad venoarteriell ECMO, för att avlasta hjärtat, till exempel i samband med hjärtkirurgi eller livshotande hjärtsvikt. Heparin ges kontinuerligt för att förhindra koagulation.
En av fördelarna med ECMO vid ventilationsproblem är att respiratorn kan vara inställd på så kallade viloinställningar, det vill säga låga tidalvolymer och luftvägstryck, för att minska risken för ventilatorinducerad lungskada och därmed ge lungan optimala läkningsbetingelser [3]. Som mått på patienters sjuklighet används för neonatala patienter ett så kallat oxygeneringsindex där värden >40 är förbundet med hög mortalitetsrisk, se Fakta 1. För barn och vuxna används i stället vanligen P/F-kvot (paO2/FiO2 [mm Hg]), där <100 talar för allvarlig ARDS (akut svår lunginsufficiens).
ECMO-metoden används allt mer, och det finns ett stigande nationellt och internationellt intresse, inte minst eftersom metoden uppvisade goda överlevnadssiffror i samband med H1N1-pandemin [4]. Nya indikationer har tillkommit det senaste decenniet, till exempel ECMO som brygga till lungtransplantation [5], och ECMO i situationer med akut återupplivning, så kallad hjärt–lungräddnings-ECMO (ECPR) [6]. Det internationella ELSO (Extracorporeal Life Support Organization)-registret registrerar kontinuerligt ECMO-användning och överlevnad efter ECMO. På tio år har antalet ECMO-centra i världen mer än fördubblats, och hittills har fler än 60 000 fall registrerats. 55–75 procent av patienterna vårdade för respiratorisk åkomma överlever beroende på ålderskategori. Överlevnaden är förstås till stor del även beroende av diagnos, sjuklighet och om ECMO används vid respiratorisk eller kardiell svikt. Siffrorna skiljer sig därför mycket, från 30–40 procent vid hjärt–lungräddning och kardiogen chock till 98 procent vid mekoniumaspiration hos nyfödda [7].
Avseende långtidsöverlevnaden är kunskapen mer begränsad, och de studier som finns har framför allt beskrivit överlevnad för enskilda diagnoser såsom medfött diafragmabråck, efter hjärtkirurgi samt på barn och nyfödda [8-11]. Dessutom har uppföljningstider varit korta och grupperna små. Flera orsaker ligger till grund för detta, bland annat brist på nationella personregister. Nyligen publicerades en brittisk studie som gick igenom 741 ECMO-vårdade barns långtidsöverlevnad med en medianuppföljningstid på 7,1 år, där man definierade långtidsöverlevnad som >90 dagar efter ECMO-behandling (det är mycket vanligt att ECMO-vårdade patienter förflyttas till andra intensivvårdsavdelningar efter utskrivning, och de har ofta en hög dödlighet första tiden). För gruppen som överlevde till denna gräns var 5-årsöverlevnaden 98 procent för mekoniumaspirationsgruppen, 74 procent för medfött diafragmabråck, 80 procent för medfödda hjärtfel (som dock hade en hög dödlighet första 90 dagarna efter behandling) och 87–97 procent för pediatriska patienter med respiratorisk svikt [12].
Med den kostsamma och allt vanligare ECMO-behandlingen är det naturligt att ställa krav på fler uppföljningsstudier bland överlevande patienter. Av den anledningen pågår flera studier vid ECMO Center Karolinska, bland annat en uppföljning mot Dödsorsaksregistret av samtliga ECMO-behandlade vid vårt centrum, och kognitiva uppföljningar av såväl barn som vuxna.
Syftet med föreliggande studie var att undersöka långtidsöverlevnaden bland patienter som vårdats med ECMO på grund av respiratorisk svikt. 1995 vårdades den första vuxna patienten på ECMO Center Karolinska, och för att få minst 5 års uppföljningstid valdes 2005 som bortre gräns när studien genomfördes 2011.
Metod
Vår studiebas var samtliga patienter vårdade vid ECMO Center Karolinska 1995–2005. Patienter som avlidit under behandling eller före utskrivning från Karolinska universitetssjukhuset, patienter med okänt personnummer, utländska patienter samt patienter som genomgått hjärt–lungräddnings-ECMO exkluderades. Resterande grupp kontrollerades mot Svenska dödsorsaksregistret varpå eventuellt datum för utlandsflytt, dödsdatum och dödsorsak registrerades. Resultaten sammanställdes i programmet Excel efter avidentifiering med löpnummerordning. Överlevnadsberäkningar gjordes med Kaplan–Meier-metoden och visualiserades med statistikprogrammet STATA. Resterande beräkningar gjordes med hjälp av Excels inbyggda verktyg. För att kunna jämföra våra resultat med den ovan nämnda brittiska studien [12] presenteras separata grupper med patienter som överlevt 90 dagar efter ECMO-vård.
Studien har etiskt godkännande av regionala etikprövningsnämnden i Stockholm.
Resultat
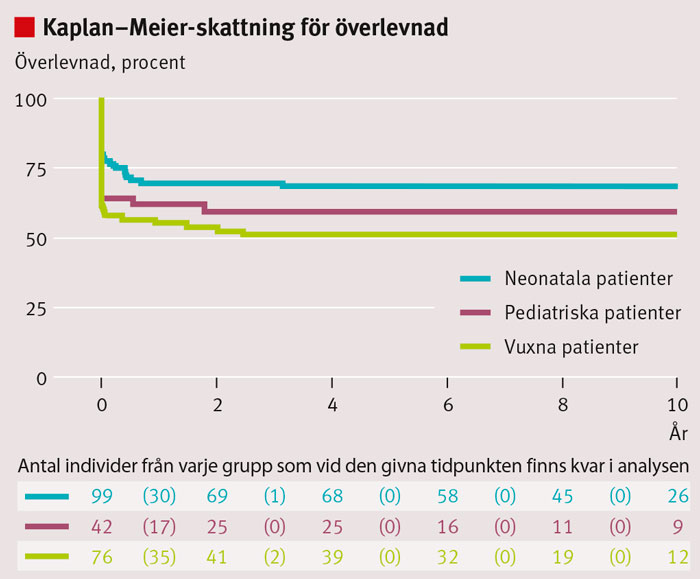
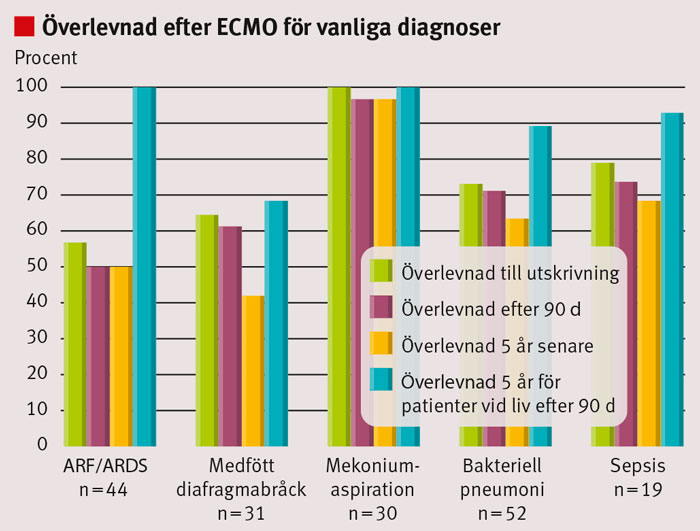
Totalt 253 patienter behandlades under åren 1995–2005. En patient hade okänt personnummer, 26 patienter var utländska och 9 tillhörde kategorin hjärt–lungräddnings-ECMO. Av resterande 217 patienter avled 51 (24 procent) under behandling och 12 (6 procent) före utskrivning från Karolinska universitetssjukhuset. Resterande 154 patienter följdes i minst 5 år, med en medianuppföljningstid på 7,9 år. Tre patienter bortföll i uppföljningen 5, 7 respektive 9 år efter ECMO-vård, samtliga på grund av utlandsflytt. 47 patienter följdes i mer än 10 år, och längsta uppföljningstid var 15,6 år. Det registrerades 10 dödsfall i neonatalgruppen, 3 i den pediatriska gruppen och 9 vuxna efter utskrivning från Karolinska universitetssjukhuset. Av dessa dödsfall inträffade 41 procent (9/22) inom 90 dagar och 77 procent (17/22) inom första året efter avslutad ECMO-vård. Kliniska karakteristika hos de 154 inkluderade och 22 avlidna efter utskrivning kan ses i Tabell I, indelat efter ålderskategori. Överlevnad kan ses i Tabell II och Figur 2. Figur 3 visar överlevnad efter ECMO-vård indelat efter diagnos.
Samtliga dödsfall bland neonatala och pediatriska patienter orsakades av respektive grundsjukdomar som de ECMO-vårdades för. Av de 9 avlidna vuxna avled 4 av sin grundsjukdom kort efter ECMO-vård, 1 patient av sin grundsjukdom ett år efter ECMO-vård och 1 patient som vårdades för intoxikation avled ett år senare i samband med en ny (avsiktlig) intoxikation. Resterande patienter avled 6 månader till 2,5 år efter ECMO-vård av lungfibros (1), hjärtinfarkt (1) respektive akut pankreatit (1).
Diskussion
En skillnad mot den brittiska studie som publicerades 2013 [12], bortsett från storleken på materialet, var att vår studie även inkluderade vuxna patienter. Från början användes ECMO nästan uteslutande på neonatala och pediatriska patienter, men sedan 1995 vårdas även vuxna patienter på ECMO Center Karolinska, och vuxengruppen har det senaste decenniet blivit den vanligaste ålderskategorin. Patienterna som genomgått hjärt–lungräddnings-ECMO exkluderades på grund av sin särdeles dåliga prognos, i alla fall på kort sikt. I efterhand kan vi se att samtliga av dessa patienter (9/9) faktiskt levde 5 år senare, men materialet är för litet för att några slutsatser ska kunna dras. Hjärt–lungräddnings-ECMO finns beskriven på annat håll [6].
Av kliniska data framgår att patienterna i vår aktuella studie var mycket sjuka. Den omedelbara överlevnaden (76 procent) vid ECMO-vård vid vårt centrum var god, och i ett internationellt perspektiv är överlevnadssiffrorna mycket höga. Vi tror att detta till stor del beror på den särskilda dygnet-runtkompetensen som finns hos all ECMO-personal, samt att det är en renodlad ECMO-intensivvårdsavdelning, vilket är mer undantag än regel internationellt. Överlevnaden är förstås beroende av vilka patienter som selekteras för ECMO-vård – på ECMO Center Karolinska följs ELSO:s rekommendationer [13]. Det är dock inte ovanligt att orsaken till lungsvikt blir klar först under ECMO-behandlingen, vilket ger en ofta intrikat selektionsprocess och prognosbedömning.
Våra resultat tyder på att långtidsöverlevnaden är god om patienterna överlever den första kritiska tiden före utskrivning till hemmet. Anmärkningsvärt är att tre fjärdedelar av de senare dödsfallen inträffade inom det första året medan inget dödsfall inträffade efter mer än 3 år och 2 månader, vilket framgår av den utplanande Kaplan–Meier-kurvan (Figur 2). Liksom förväntat skiljer sig överlevnaden stort mellan olika ålders- och diagnosgrupper, både på kort och lång sikt. Överlevnad 5 år efter ECMO-vård, givet överlevnad de första 90 dagarna efter dekanylering, var utomordentligt god för patienter med akut lungsvikt, akut svår lunginsufficiens eller mekoniumaspiration, och omkring 90 procent för patienter med pneumoni och sepsis. Medfött diafragmabråck medför en sämre långtidsprognos – en överlevnad omkring 70 procent var därför inte förvånande, och kan jämföras med resultat från andra studier [9, 12].
Av dödsorsakerna att döma avled de flesta av sina grundsjukdomar, och några vuxna avled av för samhället välkända orsaker såsom hjärtinfarkt och pankreatit. Vi såg inga tecken till oförklarlig ackumulering av dödsfall på sikt, vilket – givet ECMO:s invasiva natur och kraftiga fysiologiska påverkan på patienten – varit en farhåga, särskilt som allt fler patienter ECMO-vårdas världen över. Viktigt att påpeka är också att dödsorsaker nuförtiden sällan baseras på obduktionsfynd, utan på en klart osäkrare klinisk bedömning.
En begränsning med dessa studier är deras kvantitativa natur; att de inte ger någon bild av hur patienterna mår, utan endast presenterar absoluta mått på om de överlever eller inte. Flera studier har till exempel påvisat besvär i skolåldern hos tidigare ECMO-behandlade barn [14]. Mer forskning bör därför koncentreras omkring kognitiv uppföljning. Vid ECMO Center Karolinska pågår flera projekt inom området.
Sammanfattningsvis har ECMO blivit en väletablerad behandlingsmetod för selekterade svårt sjuka patienter såväl i Sverige som internationellt. Flera nya indikationer har tillkommit de senaste åren, och ECMO diskuteras flitigt på intensivvårdskonferenser världen över. Överlevnaden efter ECMO-vård skiljer sig stort mellan olika patientgrupper, men är generellt sett god på både kort och lång sikt, oavsett ålderskategori. Vår studie vidimerar således erfarenheten från andra studier – om patienterna överlever de första 90 dagarna så är överlevnadsprognosen mycket god, vilket även tycks vara fallet för vuxna patienter. Mer forskning behövs för att bättre kartlägga prognostiska faktorer, kognitiv funktion och livskvalitet efter ECMO-vård.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Oxygeneringsindex
OI = FiO2 × MAP/paO2
OI Oxygeneringsindex
FiO2 Fraktion av oxygen i inandningsgas
MAP Medeltrycket i luftvägarna
paO2 Partialtrycket för oxygen i artärblod uttryckt i mm Hg