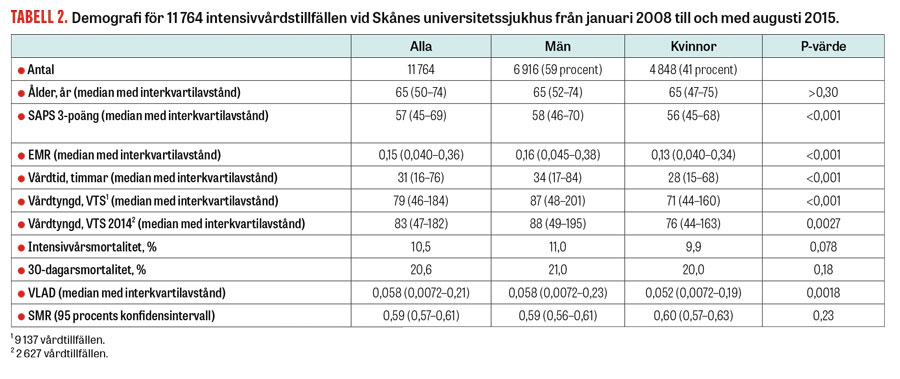
Totalt 11 764 intensivvårdstillfällen vid Skånes universitetssjukhus 2008–2015 analyserades avseende morbiditet och mortalitet för män respektive kvinnor.
Som vid tidigare studier noterades att fler män hade intensivvårdats och att männen var sjukare vid inläggning.
Män hade lägre riskjusterad mortalitet än kvinnor. Detta var framför allt tydligt för diagnoserna hjärtstopp och septisk chock men även för malignitet.
Det förelåg ingen skillnad i vårdtid och vårdtyngd (efter justering för förväntad mortalitet) mellan könen.
Målet för hälso- och sjukvården är enligt hälso- och sjukvårdslagen god hälsa och vård på lika villkor för hela befolkningen, där de med de största behoven av hälso- och sjukvård ges företräde [1]. Möjlighet till offentligt finansierad vård ska inte påverkas av geografiska förhållanden, ålder, kön, utbildning etc [2, 3].
Vårdgivare ska utgå från varje patients faktiska behov och inte påverkas av felaktiga föreställningar, t ex om män och kvinnor, vilket innebär att vårdgivare bör ha kunskap om, och ta hänsyn till, biologiska könsskillnader såväl som könsspecifika behov om sådana finns [4].
Likabehandling inom vården behöver således inte vara rättvis – ibland måste vården göra skillnad för att vara jämställd [4, 5]. Skillnader i vilken vård män och kvinnor får kan dock inte per automatik rättfärdigas med att män och kvinnor har könsspecifika behov; det som avgör om skillnaden är befogad är huruvida den är medicinskt motiverad [3].
Ojämlikheter och ojämställdhet inom vården har rapporterats [3-6]. Tidigare studier har visat högre sjukhusmortalitet för intensivvårdade kvinnor med svår sepsis/septisk chock än för män [7] och, helt nyligen, att män som intensivvårdas för hjärtstopp har lägre riskjusterad mortalitet än kvinnor [8] och att män förbrukar mer vårdresurser på svenska intensivvårdsavdelningar än kvinnor [5, 9]. Det är dock hittills inte visat att det föreligger några generella könsskillnader i intensivvårdsutfall [5, 9].
Ett vanligt sätt att titta på vårdutfall är att beräkna riskjusterad mortalitet, vilket kan göras med bl a den standardiserade mortalitetskvoten (SMR). Vid ankomst till intensivvårdsavdelningen beräknas patienternas förväntade mortalitet (EMR), och denna ställs sedan i relation till det faktiska vårdutfallet på gruppnivå för att beräkna SMR (Fakta 1). SMR begränsas av att den bara går att använda på gruppnivå. Ett mått som till skillnad från SMR har betydelse även på individnivå är »variable life-adjusted display« (VLAD) (Fakta 1) [10-12].
Principen för VLAD är att varje patient får ett VLAD-värde som beräknas genom att man från patientens förväntade mortalitet, EMR, (Fakta 1) subtraherar utfallet (som är 0 vid överlevnad och 1 för död och beräknas efter t ex 30 dagar). Exempel: En patient med EMR = 0,8 som lever efter 30 dagar får VLAD = 0,8. Om patienten hade dött inom 30 dagar blir VLAD = –0,2. Således får patienter som avlider negativa VLAD-värden, och ju närmare 0 värdet är, desto sjukare var patienten som dog. Positiva VLAD-värden ses hos patienter som har överlevt, och ju närmare 0 värdet är, desto lägre sjukdomsgrad hade patienten vid inläggningen på intensivvårdsavdelning.
Syfte
Huvudsyftet för den föreliggande studien var att jämföra intensivvårdsutfall med riskjusterade mortalitetsmått och fördelning av intensivvårdsresurser för män respektive kvinnor, dels generellt, dels för olika diagnosgrupper.
Därtill syftade studien till att hitta en bättre metod för att finna skillnader i riskjusterad mortalitet än den gängse använda SMR-baserade metoden.
Metod
Studiekohorten utgjordes av samtliga 11 764 intensivvårdstillfällen hos vuxna patienter (>17 år), som vårdats på någon av de allmänna intensivvårdsavdelningarna vid Skånes universitetssjukhus i Lund och Malmö mellan 1 januari 2008 och 31 augusti 2015. Samtliga uppgifter hämtades ur sjukhusets datalager för inrapportering till Svenska intensivvårdsregistret, SIR.
SAPS 3-poäng (Fakta 1) fanns tillgängliga i datalagret, och EMR beräknades med SIR:s senaste rekalibrering, som infördes 2016. Från Skatteverkets folkbokföring hämtades 30-dagarsmortalitet. Vi jämförde det gängse använda riskjusterade mortalitetsmåttet SMR med VLAD.
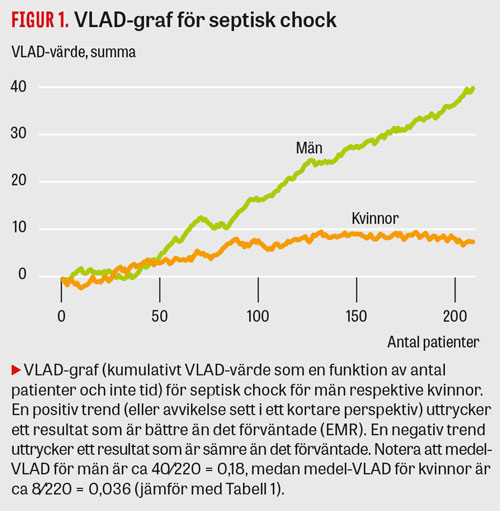
Vanligtvis brukar VLAD presenteras grafiskt genom kumulativa VLAD-värden för konsekutiva patienter (Figur 1). Detta är ett enkelt sätt att visualisera hur bra eller dåligt det går för olika patientgrupper. En positiv trend (eller avvikelse sett i ett kortare perspektiv) uttrycker ett resultat som är bättre än det förväntade (EMR). En negativ trend skulle uttrycka ett resultat som är sämre än det förväntade. VLAD ses därför ofta som en enbart grafisk metod som inte lämpar sig för statistisk analys. Men eftersom medellutningen på VLAD-kurvan (under förutsättning att det kumulativa VLAD-värdet plottas mot antal patienter och inte tid) utgör medelvärdet av de individuella VLAD-värdena, går det att med hjälp av enkla statistiska metoder jämföra riskjusterad mortalitet mellan grupper. Vi har inte sett denna användning av VLAD i tidigare studier.
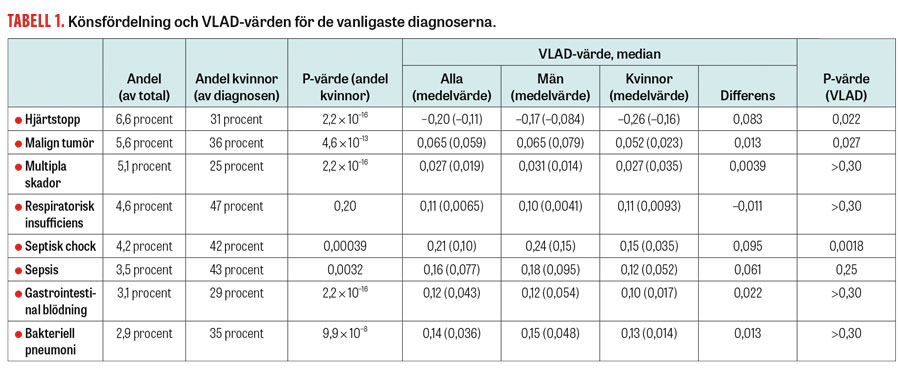
Vi undersökte om det finns någon skillnad i SMR och VLAD-värden mellan män och kvinnor samt könsskillnader avseende VLAD-värden för de åtta vanligaste primära IVA-diagnoserna i vårt material (Tabell 1).
För att beräkna skillnad i vårdtyngd mellan män och kvinnor använde vi oss av mätmetoderna Vårdtyngd Sverige (VTS) och Vårdtyngd Sverige 2014 (VTS 2014) [13]. Eftersom den senare mätmetoden har ersatt den förra, gjorde vi separata analyser för vardera mått.
För att belägga statistiska skillnader mellan två grupper för icke-normalfördelade data användes Mann–Whitneys U-test (Wilcoxons rangsummetest). χ2-test, med Yates korrektion, användes för att beräkna signifikans på skillnader i andelar mellan grupper. Hosmer–Lemeshows test användes för att testa kalibrering av SAPS 3.
Konfidensintervall för SMR och differenser för SMR beräknades med hjälp av »bootstrap«-metodik med percentilmetoden och 1 000 replikat [14].
För all hypotesprövning ansågs P < 0,05 vara signifikant.
Studien har etiskt godkännande från den regionala etikprövningsnämnden i Lund (diarienummer 2016/464).
Resultat
Vi fann ingen skillnad i ålder, intensivvårdsmortalitet eller 30-dagarsmortalitet mellan kvinnor och män (Tabell 2).
Män hade i genomsnitt högre förväntad mortalitet, längre genomsnittlig vårdtid och högre medelvårdtyngd än kvinnor (Tabell 2).
Det förelåg ingen skillnad i riskjusterad mortalitet mätt med SMR mellan män och kvinnor, däremot hade män högre VLAD-värden än kvinnor (Tabell 2), vilket innebär att fler män överlever 30 dagar vid samma sjukdomsgrad mätt med EMR. Hos dem som levde längre än 30 dagar, dvs de som hade positivt VLAD-värde, fanns också en skillnad i VLAD-värden till mäns fördel (median för män 0,111, kvinnor 0,090, P < 0,001). I gruppen som hade negativa VLAD-värden, dvs patienter som dog inom 30 dagar, fanns ingen könsskillnad (median för män –0,555, kvinnor –0,576, P = 0,65).
Bland de vanligaste diagnoserna fanns skillnad i VLAD-värden mellan män och kvinnor hos patienter med septisk chock, hjärtstillestånd och malign tumör (Tabell 1 och Figur 1). Vid dessa tre diagnoser hade män högre VLAD-värden än kvinnor. Vid övriga diagnoser hittade vi ingen skillnad mellan könen.
Analys av alla intensivvårdsinläggningar som inte tillhör diagnosgrupperna septisk chock, hjärtstillestånd och malign tumör visar att män fortfarande har högre VLAD-värden (differens 0,0076, P = 0,037).
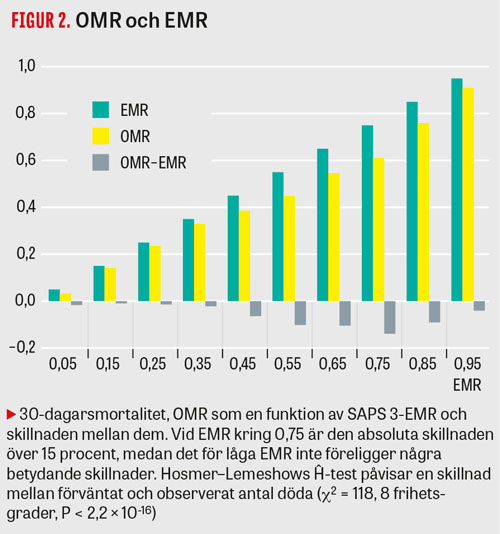
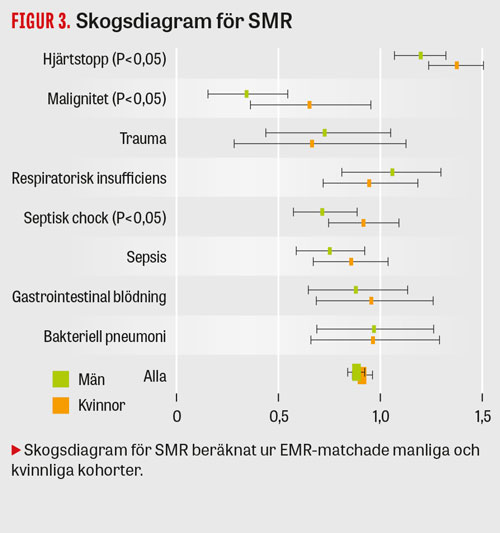
Förhållandet och differensen mellan observerad mortalitet (OMR) och förväntad mortalitet (EMR), det s k kalibreringsfelet, varierar med EMR (Figur 2). För att utesluta att kalibreringsfelet skulle orsaka könsskillnader i VLAD-värden (eftersom kvinnor har lägre EMR) skapade vi EMR-matchade kohorter av män och kvinnor, dvs lika stora kohorter av män och kvinnor där varje man har en kvinnlig motsvarighet med samma EMR, med en bootstrap-metod, för att sedan analysera VLAD. Eftersom EMR är lika i dessa matchade grupper är det helt ekvivalent att testa för skillnader i VLAD, SMR och OMR, och den enda anledningen till att vi väljer att presentera SMR är att detta begrepp är det mest intuitiva.
Vi fann inga könsskillnader avseende SMR då vi inkluderade alla diagnoser (medeldifferens män–kvinnor: –0,027; P = 0,20; 95 procents konfidensintervall [95KI] för män 0,84–0,92, för kvinnor 0,86–0,96), medan det vid septisk chock (medeldifferens män–kvinnor: –0,20; P = 0,038; 95KI män 0,57–0,89, kvinnor 0,75–1,09) och hjärtstopp (medeldifferens män–kvinnor: –0,18; P = 0,019; 95KI män 1,07–1,32, kvinnor 1,24–1,51) förelåg en klar manlig fördel (Figur 3). Även vid malignitet (medeldifferens män–kvinnor: –0,31; P = 0,029; 95KI män 0,15–0,55, kvinnor 0,36–0,95) förelåg en manlig fördel. För övriga diagnoser sågs ingen skillnad.
När vårdtid och vårdtyngd korrigerats för den förväntade mortaliteten genom att dividera med förväntad mortalitet (vårdtid⁄EMR respektive total vårdtyngd⁄EMR) fanns det ingen könsskillnad för vare sig vårdtid (P = 0,36) eller vårdtyngd (P = 0,24 för VTS och P = 0,98 för VTS 2014).
Diskussion
Ett av huvudfynden i denna studie av vården på två stora allmänintensivvårdsavdelningar vid Skånes universitetssjukhus är att män har bättre utfall i form av riskjusterad mortalitet av intensivvård än kvinnor, speciellt vid septisk chock och hjärtstopp, trots att de intensivvårdas oftare och är sjukare än kvinnor [7, 8].
Det finns tidigare resultat som pekar i denna riktning för dessa diagnoser, men vår studie är den första som visar att det föreligger en generell fördel för män. En kohort på nästan 12 000 intensivvårdstillfällen är i internationella sammanhang mycket stor. I vår studie har vi kunnat visa generella fördelar för män men också kunnat finna kliniskt betydelsefulla könsskillnader för olika diagnosgrupper.
Det är känt att kvaliteten på diagnossättningen är dålig. Exempelvis göms det i »slaskdiagnosen« respiratorisk insufficiens många fall av sepsis med respiratorisk svikt. Detta till trots är våra data mycket goda, och problemen med diagnossättning kan inte orsaka de övergripande skillnader vi fann eller skillnaderna för hjärtstopp, som är en uppenbar diagnos.
I en stor nationell svensk studie med 127 254 vårdtillfällen [9] kunde man inte visa någon riskjusterad överlevnadsfördel för kvinnor, trots att kvinnor i premenopausal ålder förutspåddes ha biologiska fördelar vid svår sjukdom/skada när man använde multivariat analys. I en annan studie sågs en överlevnadsfördel hos manliga hjärtstoppspatienter [8], vilket är i linje med våra fynd. En överlevnadsfördel för manliga patienter med sepsis efter korrigering för vissa morbiditetsfaktorer har också visats [7], vilket stödjer våra resultat.
Dock har ingen tidigare kunnat påvisa att män har generellt bättre utfall avseende korttidsmortalitet efter intensivvård.
Anledningen till att man tidigare inte kunnat visa dessa fördelar är vårt andra huvudbudskap i denna artikel: Genom att notera att lutningen i VLAD-grafer (kumulativt VLAD-värde som en funktion av antal patienter och inte av tid) är medel-VLAD, kan vi använda oss av mycket enkla statistiska metoder utan parametriska antaganden för att finna skillnader mellan grupper som inte upptäcks med gängse metod baserad på SMR.
Ett tredje fynd är att vården verkar vara rättvis, dvs tid och åtgärder fördelades efter sjuklighet och inte kön. Då männen är sjukare vårdas de också i större omfattning, men vi fann att varken vårdtiden eller vårdtyngden korrigerad för sjuklighet (vårdtid⁄EMR och total vårdtyngd⁄EMR) skilde sig åt. Vården må vara rättvis men kanske inte jämlik, eftersom utfallen i vissa grupper skiljer sig åt betydligt.
Våra fynd indikerar att SAPS 3, som är en logistisk regressionsmodell, kanske inte är optimal för att beräkna EMR och att en optimal (avseende prediktion av OMR) metod kanske bör inkludera kön som en prediktiv variabel. När SAPS 3-modellen konstruerades (utifrån 19 577 patienter) ingick kön initialt som en förklarande variabel, men den visade sig inte vara signifikant (i en logistisk regressionsmodell) och ingår därför inte som prediktor i SAPS 3 [15]. Det bör noteras att SAPS 3 predikterar sjukhusmortalitet, medan vi använder oss av 30-dagarsmortalitet.
Vi fann att förhållandet och differensen mellan observerad mortalitet (OMR) och förväntad mortalitet (EMR) varierar med EMR (Figur 2), vilket påvisar en svaghet i kalibreringen av SAPS 3. Denna variation räcker dock inte för att förklara våra fynd, eftersom vi visat att SMR, men även VLAD och OMR, skiljer sig åt för EMR-matchade kohorter av män och kvinnor.
Man kan också spekulera i huruvida någon av de inkluderade variablerna innehåller könsspecifik information. Exempelvis kan man tänka sig att män blir mer takykarda än kvinnor vid motsvarande sjukdomsgrad. Vi planerar att utforska detta i en uppföljande studie.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Caroline Mård har bidragit med datauttag ur Svenska intensivvårdsregistret, Landstinget i Värmland.
Fakta 1. Några grundbegrepp
SAPS 3-modellen(Simplified acute physiology score 3 [15]). SAPS 3-intagningspoäng är summan av tre delsummor.
Delsumma 1 beskriver patienten före intagning för intensivvård. I denna ingår ålder, samsjuklighet, plats före intagning på IVA, tid på sjukhus och vasoaktiv terapi före intensivvård.
Delsumma 2 omfattar skäl till intagning, förekomst av infektion, kirurgiskt status och, i förekommande fall, operationstyp.
Delsumma 3 beskriver grad av fysiologisk störning under ett 2-timmarsintervall i anslutning till inledningen av intensivvården (ankomst ± 1 timme).
Förväntad mortalitet (EMR). EMR är den skattade risken (ett tal mellan 0 och 1) för att en patient ska avlida och kan prognostiseras med t ex SAPS 3 via
EMR=1/(1 + exp – [7,207888*ln(total SAPS 3-poäng + 10,41049) – 32,1056]).
Observerad mortalitet (OMR). OMR är den andel (ett tal mellan 0 och 1) patienter som avlider inom 30 dagar efter ankomst till intensivvårdsavdelning.
Standardiserad mortalitetskvot (SMR). SMR är ett mått på riskjusterad mortalitet och beräknas som
SMR = OMR⁄EMR
dvs kvoten mellan observerad mortalitet inom 30 dagar efter ankomst till intensivvårdsavdelningen och förväntad mortalitet.
Variable life adjusted display (VLAD) [10-12]. VLAD är ett alternativt sätt att beräkna riskjusterad mortalitet. VLAD definieras som
EMR – (0/1 om patienten lever/är död)
inom 30 dagar efter ankomst till IVA.