Patienter som behandlas med direktverkande antikoagulantia (NOAK), dvs apixaban, rivaroxaban eller dabigatran, och som drabbas av gastrointestinal blödning ska utredas skyndsamt.
Kliniska eller laboratoriemässiga tecken på blödning från mag–tarmkanalen hos NOAK-behandlade patienter bör föranleda endoskopisk utredning.
Hemoglobinvärdet är, tillsammans med S-kreatininvärdet, fortsatt det viktigaste blodprovet i uppföljningen av NOAK-behandling. Anamnes med kontrollfrågor avseende gastrointestinal blödning ska ingå i uppföljningen.
Kontroll även av F-Hb kan övervägas, men en sådan regim bör utvärderas i större prospektiva undersökningar före generell implementering.
Direktverkande antikoagulantia (NOAK) förskrivs i allt större utsträckning [1]. Inom Stockholms läns landsting fick 430 personer apixaban på recept under 2013. Under 2015 hade antalet ökat ca 15-faldigt. Motsvarande siffror för rivaroxaban var 2 338 respektive 6 669 personer, dvs en knappt 3-faldig ökning, och för dabigatran sågs en knappt 50-procentig ökning (från 2 740 personer 2013 till 4 064 personer 2015).
För warfarin, som fortfarande dominerar inom antikoagulantiabehandling, var antalet behandlade personer väsentligen stabilt mellan 2013 och 2015 (35 388 respektive 33 703 personer) [Kristina Aggefors, GUPS (Gemensam uppföljningsplattform) Stockholms läns landsting, pers medd; 2016].
Det finns sålunda en betydande ökning i förskrivningen av orala antikoagulantia inom Stockholms läns landsting, vilket tidigare redovisats i Läkartidningen [1]. NOAK utgör en ökande andel av förskrivna orala antikoagulantia och verkar därmed vara på väg att, åtminstone delvis, ersätta warfarin. Utvecklingen beror troligen på gynnsamma resultat i de stora jämförande kliniska prövningarna samt faktorer som bekvämlighet för patienten och marknadsföring.
NOAK har vid tromboemboliska tillstånd befunnits utgöra ett lika bra eller bättre behandlingsalternativ jämfört med warfarin, särskilt i studier på patienter med förmaksflimmer [2] men även vid venös tromboembolism [3].
Ger större risk för gastrointestinal blödning än warfarin
NOAK är ett samlingsnamn på direktverkande orala antikoagulantia med skilda farmakologiska egenskaper. Dabigatran är en selektiv trombinhämmare. Medlet intas som en prekursor, dabigatranetexilat, vilken emellertid snabbt och effektivt metaboliseras till dabigatran av esteraser i tarmvägg, plasma och lever [4]. Rivaroxaban och apixaban är selektiva faktor Xa-hämmare utan direkta effekter på trombin [5, 6]. Säkerheten med dessa nya medel har bedömts vara god och behandlingen behäftad med minskad risk för intrakraniella blödningar jämfört med warfarin [7-9]. Emellertid synes risken för gastrointestinala blödningar vara en komplikation av betydelse och värd att belysas närmare [10].
Warfarin, som under många år varit förstahandsval som oralt antikoagulantium, anges i litteraturen medföra kliniskt signifikant gastrointestinal blödning hos knappt 5 procent av behandlade patienter [11]. Blödningar från övre gastrointestinalkanalen under warfarinterapi anges bero på främst esofagit, ventrikelerosioner eller peptiska ulcus, medan nedre gastrointestinala blödningar främst beror på divertikelblödningar, blödningar från adenom/maligna tumörer eller angiodysplasier [12].
I flera större kliniska prövningar med NOAK har ökad förekomst av gastrointestinala blödningar noterats jämfört med warfarin. Hos patienter med förmaksflimmer sågs en ca 25-procentig riskökning för gastrointestinala blödningar [13]. I studier av förmaksflimmer ökade risken för gastrointestinal blödning med dabigatranbehandling i dosen 150 mg × 2 [7] och för patienter behandlade med rivaroxaban [8], men inte för patienter behandlade med apixaban [9].
Misstanke om ökad frekvens gastrointestinala tumörer
Hjärtkliniken och medicinkliniken vid Danderyds sjukhus liksom Stockholm Heart Center startade tidigt med behandling med NOAK till patienter med indikation för oralt antikoagulantium. Detta skedde inom ramen för strukturerad uppföljning. En klinisk misstanke uppkom om ökad frekvens diagnostiserade gastrointestinala tumörer i denna patientgrupp, varför ett mindre prospektivt kvalitetsprojekt startades vid endoskopienheten på Danderyds sjukhus.
Ändamålet var att beskriva den endoskopiska verksamheten och undersöka om NOAK genom sin direktverkande antikoagulerande effekt inducerar overt mag–tarmblödning från lesioner som per se är lättblödande, t ex tumörer, angiodysplasier eller olika typer av ulcerationer.
Metod
Projektet genomfördes på Danderyds sjukhus endoskopicentrum augusti 2014 till maj 2015. Enheten hade under 2014 en produktion på totalt ca 7 500 endoskopier. I projektet identifierades NOAK-behandlade patienter som remitterats för endoskopisk undersökning, gastroskopi och/eller koloskopi på grund av klinisk misstanke om gastrointestinal blödning. I en första utvärdering under en 8-månadersperiod ville vi beskriva blödningens genes, vilket presenteras i föreliggande artikel.
Patienter remitterade för endoskopi med pågående behandling med dabigatran, rivaroxaban eller apixaban och minst ett av följande kriterium inkluderades:
- verifierat positivt F-Hb-test eller anamnes på synligt blod från tarmen
- sjunkande Hb om minst 20 g/l eller behov av blodtransfusion under NOAK-behandling; inga tidsramar sattes för Hb-reduktionen
- påvisad blödning vid tidigare endoskopisk undersökning.
Patienter, såväl elektiva som akuta, inkluderades i samband med endoskopisk undersökning (gastroskopi, koloskopi eller tunntarmsskopi), oavsett om blödningskälla hittats eller inte och oavsett behandlingsindikation. Utöver endoskopiskt utfall registrerades NOAK-behandlingens indikation och duration, liksom tid från registrering av remiss till endoskopisk undersökning. Dessutom beräknades njurfunktion (eGFR), och enklare koagulationsstatus registrerades (APT-tid, PK-INR och trombocyttal).
Resultat
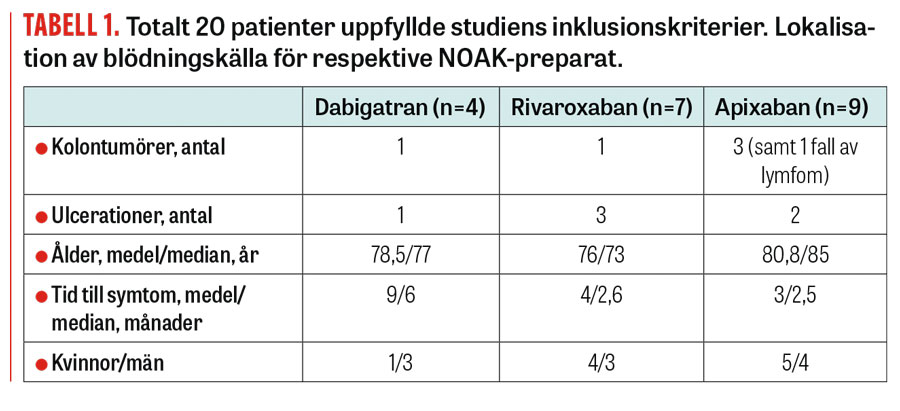
Totalt 20 patienter som uppfyllde inklusionskriterierna identifierades under den studerade 8-månadersperioden (Tabell 1). Dessa patienter inkluderades konsekutivt och oavsett utfall av endoskopi. I Fakta 1 presenteras tre fallbeskrivningar. Indikationen för NOAK-behandling var venös tromboembolism (n = 4) eller förebyggande av tromboemboli vid icke-valvulärt förmaksflimmer (n = 16).
Vi fann 5 patienter med bekräftat maligna tumörer i tjocktarmen (1 i rektum, 2 i sigmoideum och 2 i cekum). 1 tumör klassificerades som premalignt adenom, och 4 som manifesta adenokarcinom, varav 1 redan fjärrmetastaserat vid upptäckten. Dessutom hade 1 patient ett malignt B-cellslymfom i ventrikeln, 3 hade divertikelblödningar och 1 hade s k solitärt ulcus i rektum. Vi fann också 5 patienter med ventrikel- eller duodenalulcus. Hos övriga 5 patienter sågs, trots inklusionkriterier som utformats för att selektera fram gastrointestinal blödning, ingen säker blödningskälla (Figur 4) vid den endoskopiska undersökningen som gjordes i samband med inklusion.
Lokalisation av blödningskälla för respektive preparat presenteras i Tabell 1.
Samtliga 20 patienter hade en behandlingstid med NOAK understigande 24 månader, och 14 patienter hade en behandlingsduration mindre än 5 månader. Tid från start av NOAK-behandling till blödningssymtom varierade från 2 dagar till 17 månader. Patienter med maligna tumörer i tjocktarmen hade behandlats med NOAK i medeltid 5 månader (median 3 månader) efter att ha bytt från ASA, warfarin eller lågmolekylärt heparin. Under behandling med dessa antitrombotika hade de inte haft några symtom på gastrointestinal blödning. Av patienterna med maligna tumörer i tjocktarmen hade endast 1 patient anemi; övriga hade positivt F-Hb men normala blodvärden.
Diskussion
Av de 20 patienter som inkluderades i studien på basis av gastrointestinal blödning under NOAK-behandling visade sig 6 patienter ha maligna tumörer, varav 5 var belägna i tjocktarmen. Dessa tumörer gav symtom i form av blödning relativt kort tid (dagar–månader) efter det att man bytt från annat oralt antitrombotiskt medel (ASA i 2 fall och warfarin i 1 fall) till NOAK.
I vår genomgång var apixaban det mest förekommande NOAK-preparatet hos patienter med diagnostiserade tumörer. En patient med förmaksflimmer gavs reducerad dos apixaban (2,5 mg × 2) med motiveringen att patienten tidigare haft hjärnblödning. I litteraturen anges emellertid apixaban vara det NOAK-preparat som är minst behäftat med gastrointestinala blödningar [14].
Våra fynd förklaras möjligen av förskrivningssiffrorna inom Stockholms läns landsting (se artikelns inledning). Apixaban rekommenderas inom Stockholms läns landsting som förstahandsmedel vid förmaksflimmer och är därför det NOAK-preparat som ökat mest i förskrivning under de senaste åren.
Kanske lokalt blödningsframkallande i tarmmukosan
Läkare som behandlar patienter med NOAK ska vara medvetna om risken för gastrointestinal blödning, att denna kan vara låggradig och långsamt sivande och initialt utan tydliga kliniska tecken. Mekanismerna bakom varför NOAK skulle medföra större blödningsrisk än warfarin är okända.
Möjligen kan fynden förklaras av dels medlens systemiskt antikoagulerande effekt, dels att aktivt icke-absorberat antikoagulerande läkemedel finns i signifikant mängd i tarmen och därigenom kan verka lokalt blödningsframkallande på vulnerabla områden i tarmmukosan, t ex erosioner, angiektasier eller tumörer [14].
Våra fynd är förenliga med denna teori och kan medföra att maligna tumörer upptäcks i tidigt skede om behandlande läkare är observant. I vår studie hade flertalet tumörer sannolikt funnits en längre tid, men i och med byte till NOAK kunde man i alla fall utom ett diagnostisera tumörerna i tid före metastasering och även operera kurativt.
Den patient som hade metastaserad cancersjukdom vid upptäckten av tjocktarmstumör hade behandlats i ca 4 månader med apixaban. Cancersjukdomen hade sannolikt funnits betydligt längre tid. Patienten med B-cellslymfom avled i sviterna av ischemisk stroke då NOAK satts ut på grund av att man befarade allvarlig blödning från tumören.
Patienter med oklar genes till gastrointestinal blödning har i vår genomgång inte följts vidare efter den aktuella undersökningen, men vid negativ endoskopi rekommenderades i förekommande fall fortsatt utredning.
Tecken på mag–tarmblödning måste uppmärksammas
I ett tidigare insamlat material från endoskopienheten vid Danderyds sjukhus var förekomsten av tumörer i tjocktarmen hos »vanliga« remissfall 1,8 procent och hos screeningpatienter, där positivt F-Hb-prov förelåg, ca 6 procent.
I vårt begränsade studiematerial fann vi att 5 av 20 patienter hade förstadier till eller manifest kolorektal cancer. Våra inklusionskriterier var utformade med syftet att undersöka patienter med stark misstanke om eller synlig gastrointestinal blödning under pågående NOAK-behandling. Patientpopulationen som undersöktes hade anamnes på venös tromboembolism, ett tillstånd associerat med cancer, eller förmaksflimmer vars förekomst liksom mag–tarmcancer ökar med åldern (medelåldern i vår studie var 78 år).
Våra fynd understryker att behandlande läkare bör vara mycket uppmärksam på tecken på gastrointestinal blödning i de patientgrupper som behandlas med NOAK på dessa indikationer. Vid kontroller bör man efterfråga tecken på gastrointestinal blödning, och hemoglobinvärdet (blodstatus) bör analyseras.
Våra data understryker också vikten av att oaktat typ av NOAK-preparat endoskopiskt utreda patienter med klinisk misstanke om gastrointestinal blödning, i synnerhet patienter som rapporterar synligt blod från ändtarmen, där positivt F-Hb-test finns och/eller där signifikant anemi uppkommit. Dessa patienter bör skyndsamt genomgå endoskopiundersökning.
F-Hb-test i »provbatteriet« vid uppföljning
Våra undersökningsfynd stämmer med vad som rapporterats i litteraturen. Vid en genomgång av de stora NOAK-studierna sågs en ökning av diagnostiserade gastrointestinala maligniteter [15]. Man spekulerade att NOAK, som finns som aktivt läkemedel i tarmlumen, ökar risken för blödning från tumörer, och att man bör överväga F-Hb-test inom 1 månad från insättning av medlet och därefter F-Hb-test årligen [15].
Det finns därmed visst belägg för att behandling med NOAK kan utgöra en »faciliterande faktor« vid screening av tumörer från mag–tarmkanalen. Vidare bör det noteras att gruppen med indikation för NOAK i huvudsak är i riskåldern för gastrointestinal cancer, vilket också antyds i vår undersökning. Detta gäller oavsett indikation, även då behandlingstiden är strikt tidsbegränsad, t ex patienter som behandlas med NOAK på grund av »provocerad« lungembolism eller djup ventrombos.
Hemoglobinvärdet (blodstatus) är sannolikt det viktigaste laboratorieprovet vid NOAK-behandling, medan mätning av njurfunktionen är viktig särskilt hos patienter med mer betydande njurfunktionsnedsättning, och särskilt vid dabigatranbehandling eftersom detta medel till övervägande del elimineras renalt. F-Hb-prov skulle kunna läggas till »provbatteriet« som ska tas vid uppföljning av patienter med NOAK-behandling, vilket också föreslagits av andra [15].
Här behövs dock mer strukturerad utvärdering, men denna strategi (F-Hb) skulle kunna öka möjligheten till tidig detektion av asymtomatiska tumörer i gastrointestinalkanalen, särskilt hos patienter som i övrigt är i riskzonen för tumörsjukdom. I vår lilla studie sågs också att patienterna inte hunnit utveckla anemi trots påvisad blödning från tarmen, vilket stöder användandet av F-Hb.
Studien påtalar vikten av strukturerad uppföljning
Vår studie har flera begränsningar. Studiepopulationen är liten, och vi kan inte beräkna någon prevalens för endoskopiskt diagnostiserade tumörer på grund av gastrointestinal blödning under NOAK-behandling. Jämförande data för warfarinbehandlade patienter saknas.
Studien påtalar dock vikten av strukturerad uppföljning av NOAK-behandlade patienter. När misstanke om gastrointestinal blödning uppkommer bör behandlande läkare noggrant utreda med anamnes och utökad provtagning och även överväga endoskopisk undersökning. Overt gastrointestinal blödning bör förstås utredas skyndsamt.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Patientfall som illustrerar karakteristiska kliniska förlopp.
Fall 1
En 69-årig kvinna med hypertoni och paroxysmalt förmaksflimmer sedan många år fick behandling med apixaban 5 mg 1 × 2 i stället för acetylsalicylsyra (ASA) 75 mg × 1, vilket hon medicinerat med i nästan 10 års tid. Blodprov (Hb, S-kreatinin, PK-INR och APTT) vid start av behandlingen med apixaban visade normala fynd.
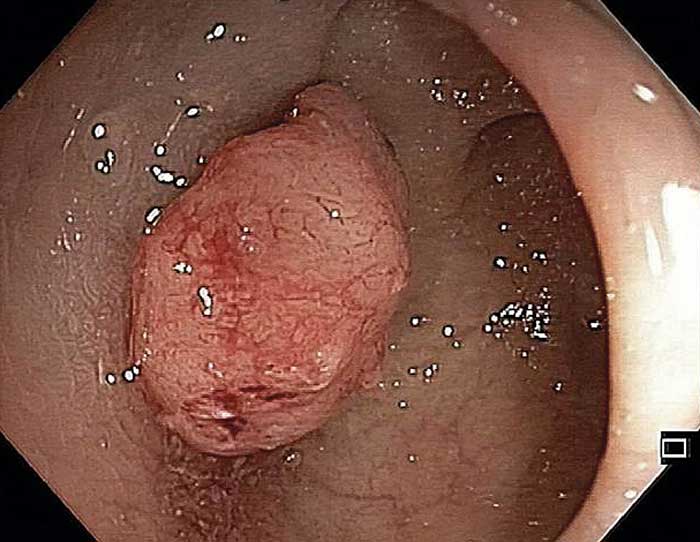
2 månader efter start av apixabanbehandlingen noterade patienten både mörk avföring och färskt blod i avföringen. Hon kontaktade då sin läkare som remitterade henne för koloskopi, vilken utfördes 1 månad senare. Man fann en misstänkt större polypös förändring i cekum (Figur 1). Koloskopin i övrigt var utan anmärkning. Riktade biopsier visade adenokarcinom. Vidare utredning visade ingen spridning.
Patienten opererades med radikal högersidig hemikolektomi. Apixaban återinsattes postoperativt utan komplikationer.
Fall 2
En 85-årig kvinna med hypertoni och förmaksflimmer drabbades av en intracerebral blödning där orsaken bedömdes vara kombinationen av hypertoni och warfarinbehandling. Efter hjärnblödningen behandlades patienter med ASA under ca 3 år, varefter ASA utsattes till förmån för apixaban 2,5 mg 1 × 2. Den lägre dosen apixaban gavs på grund av tidigare blödning i kombination med hög ålder.
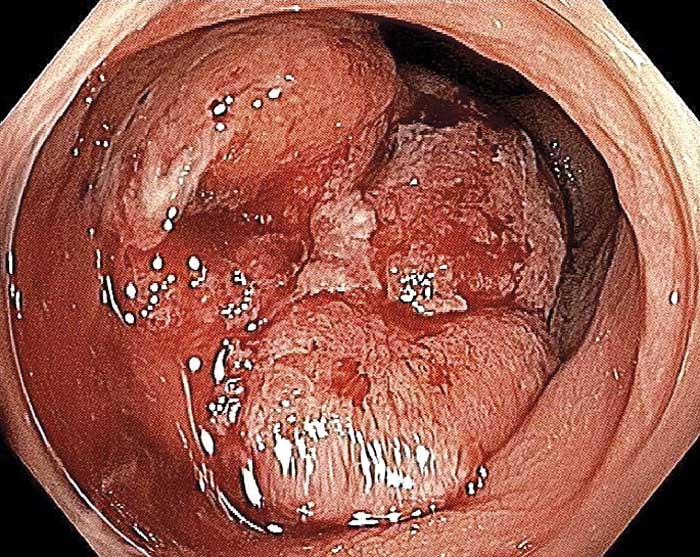
Efter 2 månaders apixabanbehandling observerade patienten färskt blod från ändtarmen i samband med toalettbesök. Sigmoideoskopi på annan endoskopienhet visade misstänkt polypös förändring ca 15 cm upp i rektum. Vid total koloskopi på endoskopienheten vid Danderyds sjukhus fann man en klart malignitetssuspekt tumör 12–15 cm upp i rektum (Figur 2). PAD från riktade biopsier bekräftade diagnosen adenokarcinom. I frånvaro av metastaser opererades patienten radikalt med hög rektumresektion och avlastande loop-ileostomi.
Patienten har efter operationen varit välmående, och behandlingen med apixaban återinsattes.
Det ska observeras att reducerad dosering av apixaban (2,5 mg × 2) på indikationen förmaksflimmer enligt Fass ska ges om två av följande tre kriterier uppfylls: ålder >80 år, kroppsvikt <60 kg, S-kreatinin >133 μmol/l (eller kreatininclearance 15–29 ml/min).
Fall 3
En 77-årig kvinna med kroniskt förmaksflimmer och warfarinbehandling samt lindrig njurinsufficiens, hypertoni och hypotyreos fick i stället behandling med rivaroxaban 15 mg
1 g × 1.
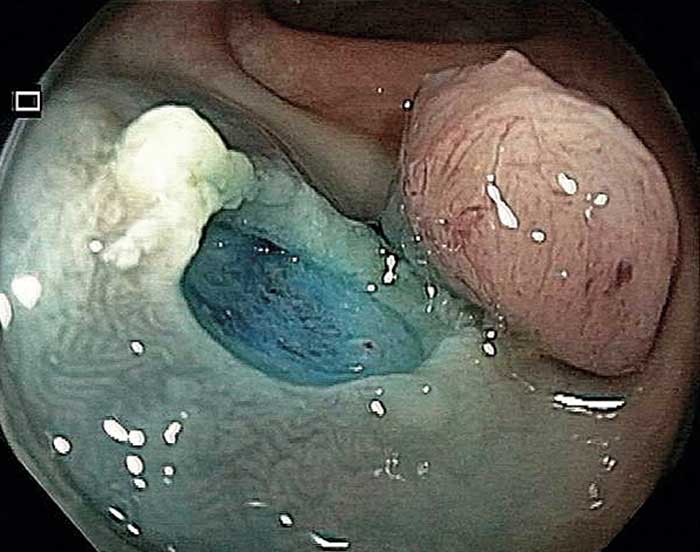
Efter ca 2 månaders behandling noterade patienten vid upprepade tillfällen färskt blod i avföringen. Efter ytterligare några månader sökte hon läkare och remitterades för koloskopi med undersökning 10 dagar senare. Undersökningen visade i rektosigmoidala övergången en lättblödande bredbasig polyp med adenomutseende (Figur 3). Förändringen avlägsnades en bloc medelst endoskopisk mukosaresektion (Figur 3). PAD visade tubulovillöst adenom med höggradig dysplasi och fri resektionsrand.
Rivaroxaban återinsattes några dagar efter ingreppet.