Omräkning av barns (≥2 år) kreatininvärden till motsvarande värden vid 18 års ålder och applicerade i Lund–Malmö-formeln för vuxna ledde till avsevärt förbättrad skattning av GFR bland barn vid uppmätt GFR <75, bibehållen noggrannhet ≥75 ml/min/1,73m2 och likvärdig med pediatriska formler.
Lund–Malmö-formeln kan användas under hela livet ≥2 år utan plötsliga artificiella förändringar i skattad GFR vid övergång från pediatrisk till vuxen vård.
Formeln är enklare att implementera i automatiska laboratoriesvar än pediatriska formler eftersom dessa kräver längduppgift.
Åldersjusteringen av barns kreatininvärden innebär att väletablerade referensintervall för kreatinin hos vuxna även kan användas för barn.
Glomerulär filtrationshastighet (GFR) är allmänt accepterad som det bästa måttet på njurfunktion och används för diagnostik av kronisk njursjukdom och vid dosering av vissa läkemedel [1]. GFR kan inte mätas direkt i njuren men kan bestämmas indirekt genom att mäta clearance av exogent tillförda filtrationsmarkörer (measured GFR, mGFR). Man kan också använda formler baserade på endogena biomarkörer såsom plasmakreatinin (P-kreatinin) för att skatta GFR (estimerad GFR, eGFR). I SBU-rapporten »Skattning av njurfunktion« från 2013 [1] konkluderades dock att noggrannheten hos kreatininbaserade barnformler var otillräckligt kartlagd. Schwartz klassiska kreatininformel för barn, eGFR = k × längd / P-kreatinin [2, 3], lämpar sig inte heller för automatiserade svar av eGFR då längduppgift ofta saknas i samband med kreatininanalysen på laboratoriet. Ytterligare ett problem är de plötsliga artificiella förändringar av eGFR som ofta ses vid övergång från barnformler till formler för vuxna när patienten når 18 års ålder [4].
I ett europeiskt samarbete, European Kidney Function Consortium (EKFC), har tillförlitligheten av olika kreatininbaserade eGFR-formler för barn nyligen utvärderats mot clearancemetoder med externa markörer för mGFR som referenstest i ett unikt stort patientmaterial [5]. Bäst prestanda hade Schwartz–Lyon-formeln [6] med acceptabel noggrannhet i alla mGFR-intervall ≥30 ml/min/1,73 m2. Den reviderade Lund–Malmö-formeln (LMR) [7], primärt avsedd för vuxna, hade i samma utvärdering god noggrannhet vid mGFR ≥75 men inte <75 ml/min/1,73 m2, en föreslagen GFR-gräns för diagnosen kronisk njursjukdom hos barn [8].
Till skillnad från pediatriska formler som Schwartz–Lyon innehåller inte LMR längd, vilket gör den lättare att implementera i automatiserade laboratoriesvar. Den är också baserad på en svensk population, vilket innebär att den är bättre anpassad till svenska patienter än exempelvis amerikanska formler. I dagsläget använder 80 procent av svenska laboratorier LMR för rapportering av eGFR på vuxna (enligt Equalis hanteringsföreskrift för poolat serum, mars 2020). Vi har därför utvecklat en metod att förbättra formelns prestanda för barn som bygger på att kreatininvärdena åldersjusteras för att ta hänsyn till att P-kreatinin kontinuerligt ökar med stigande ålder under barndomen [9, 10]. Härigenom kunde prestandan hos LMR avsevärt förbättras vid mGFR <75 ml/min/1,73 m2 i valideringen bland 4 005 barn i den pediatriska EKFC-kohorten [11].
I denna artikel särredovisar vi resultaten för de svenska barnen i EKFC-kohorten.
Metod
Tillväxtkurvor för plasmakreatinin
För att ta fram en metod för att åldersjustera P-kreatinin utnyttjade vi en referenskohort med enzymatiska kreatininprov analyserade på 2–40 år gamla individer från 1) Kortrijk, Belgien 2005–2007 (n = 9 634), 2) Liege, Belgien 2019 (n = 9 123) och 3) Uppsala 2015–2019 (n = 64 410) [11]. Baserat på linjär regression etablerade vi tillväxtkurvor som beskriver ökningen av P-kreatinin med stigande ålder. Kurvorna kan användas för att räkna om barns kreatininvärden till motsvarande nivå för en vuxen individ vid en viss ålder, så kallat åldersjusterat P-kreatinin (Kr*). Vi valde att göra omräkningen till 18 års ålder för LMR, hädanefter benämnd LMR18 (Fakta 1). Det faktiska medianvärdet för P-kreatinin (2,5; 97,5 percentiler) bland 18-åringar i referenskohorten från Uppsala var 61 (42, 87) mol/l för kvinnor (n = 1 063) och 76 (54, 108) mol/l för män (n = 829).
Validering
Valideringen av LMR18 i den pediatriska EKFC-kohorten [11] omfattade 1 718 svenska barn 2–17 år gamla (n = 434 Skånes universitetssjukhus, Lund, n = 1 284 Karolinska universitetssjukhuset, Huddinge) som genomgått johexolclearance som referensmetod för mGFR och samtidig kreatininmätning. För barn som undersökts vid flera tillfällen inkluderades endast första mättillfället. Analysmetoderna för P-kreatinin och johexolclearance sammanfattas i Fakta 2.
I den aktuella kohorten (40 procent flickor och 7,1 procent var organtransplanterade) sågs följande medianvärden (2,5, 97,5 percentiler): ålder 12,0 (2,3, 17,7) år, vikt 41 (12, 86) kg, längd 149 (87, 185) cm, P-kreatinin 51 (20, 148) mol/l, anpassat P-kreatinin vid 18 års ålder 69 (36, 211) mol/l och johexolclearance 100 (27, 173) ml/min/1,73 m2.
Jämförelser gjordes med LMR baserade på uppmätta kreatininvärden och två internationella pediatriska kreatininformler (CKiD och Schwartz–Lyon, Fakta 3).
Alla procedurer följde de etiska principerna fastställda i Helsingforsdeklarationen. Alla extraherade data var anonyma. Etiskt tillstånd erhölls från den regionala etikprövningsnämnden i Lund (dnr 2018/220).
Statistisk analys
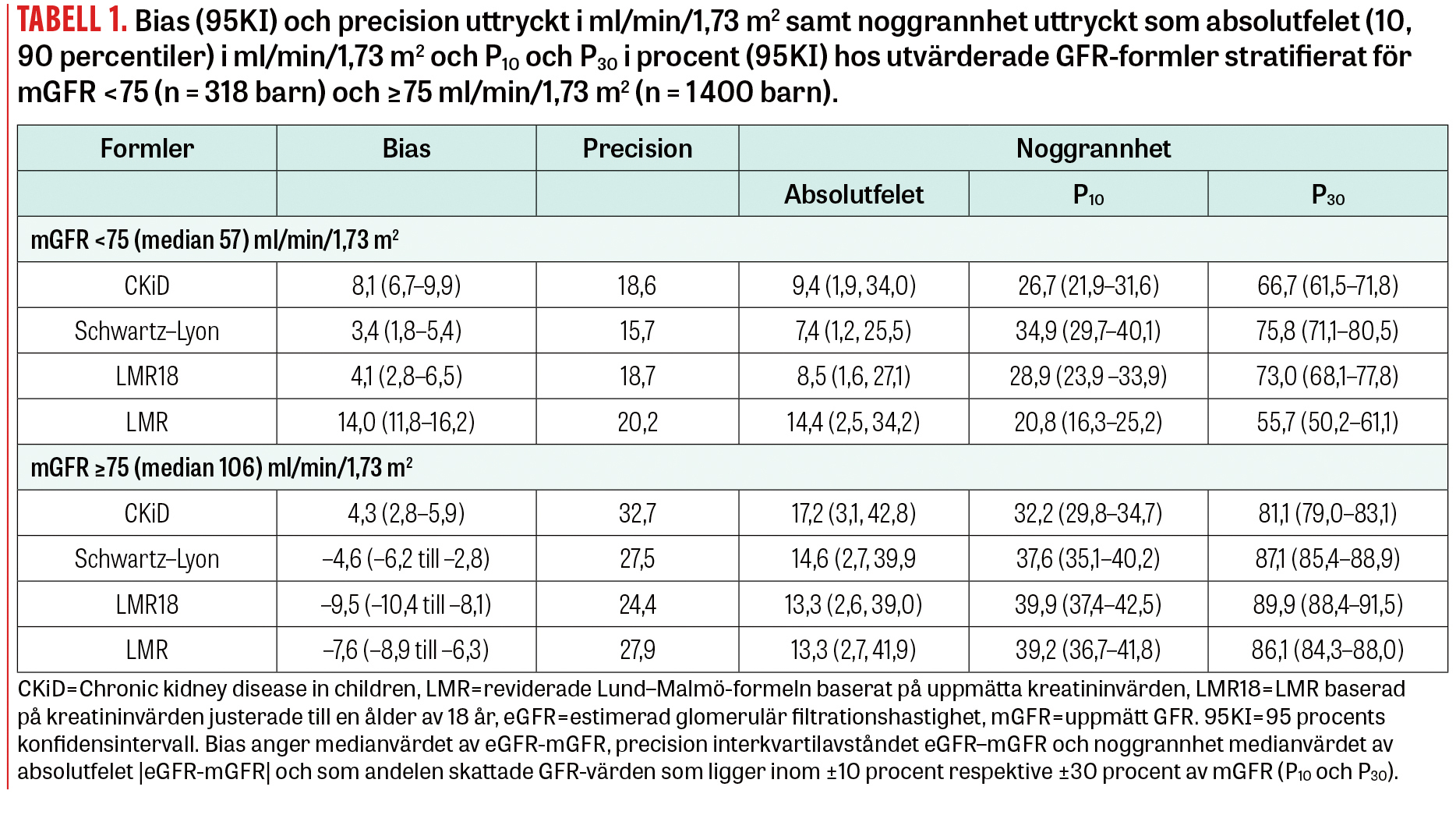
Valideringen av formlerna omfattar bias, precision och noggrannhet (accuracy) [12]. Bias uttrycks som medianvärdet av eGFR–mGFR, precision som interkvartilavstånd (IQR) för skillnaden eGFR–mGFR och noggrannhet som medianvärdet av absolutfelet |eGFR–mGFR| samt andelen skattade GFR-värden som ligger inom ±10 procent (P10) och ±30 procent (P30) av mGFR. National Kidney Foundation angav 2002 som minimikrav att P30 bör vara minst 75 procent, med riktmärke att helst nå över 90 procent [13, 14]. Skillnader i P30 utvärderas statistiskt baserat på 95 procents konfidensintervall (95KI) för parade proportionstal.
Huvudresultaten presenteras stratifierade för mGFR under och över 75 ml/min/1,73 m2, eftersom denna gräns föreslagits som tröskelvärde för diagnosen kronisk njursjukdom hos barn och unga vuxna [8].
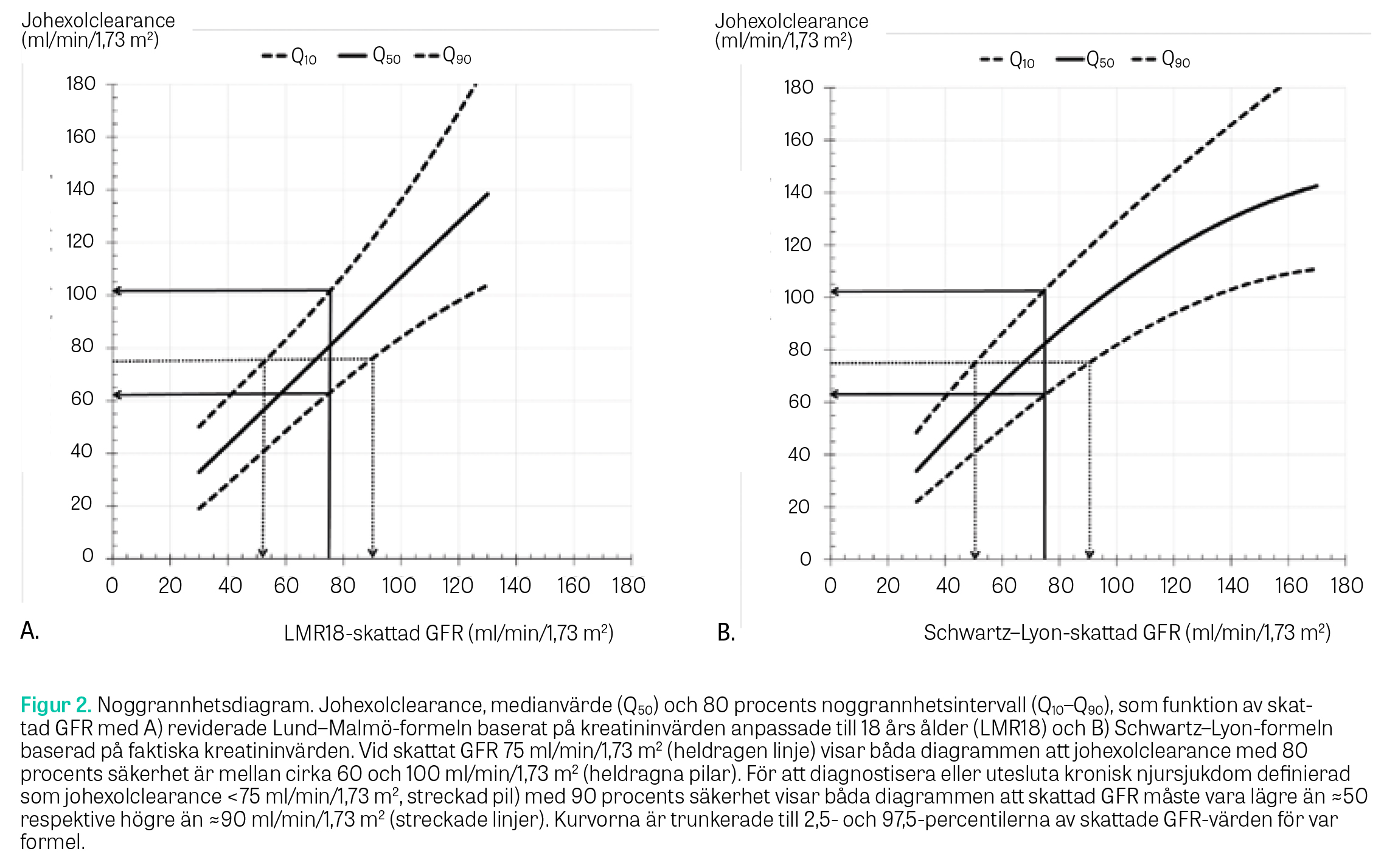
P30-noggrannhet i relation till mGFR illustreras grafiskt för LMR18 och Schwartz–Lyon baserat på logistisk regressionsanalys och fraktionspolynom (linjär, kvadrat och logaritm). Kvantilregression används tillsammans med fraktionspolynom för att med hjälp av så kallat noggrannhetsdiagram [15] beskriva hur felets storlek varierar med eGFR. Kvantilen Q50 representerar bias (medianvärde) och Q10–Q90 ger ett noggrannhetsintervall, dvs skattningsfelet med 80 procents säkerhet.
Resultat
P30-noggrannheten förbättrades från 56 procent för LMR baserat på faktiska kreatininvärden till 73 procent vid användning av åldersjusterat P-kreatinin i LMR18 vid mGFR <75 ml/min/1,73 m2 (n = 318; Tabell 1). Motsvarande förbättring var från 55 procent till 74 procent efter exklusion av organtransplanterade (n = 73 av 318). Förbättringen var framför allt ett resultat av reducerad bias men också av något förbättrad precision. Noggrannheten för LMR18 var 6,3 procentenheter högre än för CKiD (95KI 1,2–11,4). Högst P30-noggrannhet vid mGFR <75 ml/min/1,73 m2 hade Schwartz-Lyon, 2,8 procentenheter högre än för LMR18 (95KI 1,1 lägre till 6,8 högre).
Hos barn med mGFR ≥75 ml/min/1,73 m2 (n = 1 400) resulterade LMR18 i en något ökad negativ bias men förbättrad precision, vilket sammantaget gav P30 = 90 procent (Tabell 1), en ökning med 3,8 procentenheter (95KI 2,3–5,2) jämfört med LMR baserad på faktiska kreatininvärden. Noggrannheten för LMR18 var 8,3 procentenheter högre än för CKiD (95KI 5,9–10,8) och 2,8 procentenheter högre än för Schwartz–Lyon (95KI 1,1–4,5). De förbättringar som noterades för LMR18 omfattade både flickor och pojkar i motsvarande grad både under och över 75 ml/min/1,73 m2 [11].
Bland barn med mGFR <75 ml/min/1,73 m2 förbättrades P30 för LMR18 jämfört med LMR i åldersgrupperna 2,0–7,9, 8,0–12,9 och 13,0–17,9 år från 47 procent till 69 procent, 46 procent till 77 procent respektive 66 procent till 73 procent. I gruppen med mGFR ≥75 ml/min/1,73 m2 varierade P30 mellan 83 procent och 94 procent, med förbättring endast i den yngsta åldersgruppen, från 72 procent till 83 procent.
P30-noggranheten för LMR18 och Schwartz–Lyon i relation till mGFR presenteras i Figur 1. P30 varierade mellan 80 procent och 95 procent för LMR18 i mGFR-intervallet 60–160 ml/min/1,73 m2 jämfört med 80–89 procent för Schwartz–Lyon i samma intervall. Felets storlek uttryckt i ml/min/1,73 m2 och med 80 procents säkerhet vid olika eGFR-nivåer för LMR18 och Schwartz–Lyon kan utläsas i Figur 2. Samma figur kan också användas för att med 90 procents säkerhet diagnostisera eller utesluta kronisk njursjukdom utifrån ett valt tröskelvärde för uppmätt GFR.
Diskussion
Vår undersökning visar hur man kan åldersjustera P-kreatinin, det vill säga räkna om barns kreatininvärden till vuxennivåer, för att kunna använda en GFR-formel avsedd för vuxna även för barn. I undersökningen använde vi vuxenformeln LMR och räknade om barns kreatininvärden till 18 års ålder. Detta gav likartad noggrannhet vid skattning av GFR som när pediatriska kreatininformler användes. Strategin har fyra fördelar:
- vuxenformeln kan användas utan att några koefficienter i formeln behöver ändras,
- samma formel kan användas under hela livet utan plötsliga artificiella förändringar i eGFR när man övergår från pediatrisk till vuxenvård,
- avsaknad av längd i formeln, till skillnad från de pediatriska formlerna, gör det enklare att etablera automatiska laboratoriesvar med eGFR även för barn, och
- omräkningen av P-kreatinin innebär att väletablerade referensintervall för vuxna också kan användas för barn.
Det senare är av stor betydelse, då referensintervall kan saknas i vissa åldersintervall med risk för att avvikande värden missas då stjärnmarkeringar i laboratorielistan baseras på avvikelse i förhållande till referensintervallet. Saknas referensintervall får man ingen stjärnmarkering.
I den europeiska undersökningen användes stora, icke-överlappande kohorter för att etablera tillväxtkurvor för P-kreatinin (83 157 kreatininanalyser) och för denna validering av GFR-formlerna på 1 718 svenska barn. De överordnade valideringsresultaten för de svenska kohorterna kan därför presenteras med relativt snäva konfidensintervall där den statistiska osäkerheten för P30-noggrannheten var som mest ±5 procent. Osäkerheten var emellertid större i undergrupper uppdelade utifrån ålder och mGFR. En avgörande begränsning var att vi inte hade möjlighet att studera olika etniska grupper, vilket gör att LMR18 liksom de pediatriska formlerna inte utan särskilda överväganden kan användas för etniska minoriteter i Sverige som kan ha andra tillväxtmönster för muskelmassa under barndomen och tidigt vuxenliv. Ytterligare en begränsning som gäller alla valideringsstudier är att även referensmetoderna, clearance av olika externa markörer, är oprecisa med P30 varierande mellan 82 procent och 95 procent i relation till standardmetoden renal clearance av inulin [16].
Noggrannhetsdiagram (Figur 2) kan användas som vägledning till när man kan lita på skattad GFR och när invasiva clearancemätningar kan vara indicerade. Som exempel kan nämnas att LMR18 hade den högsta noggrannheten bland de analyserade formlerna runt det föreslagna tröskelvärdet 75 ml/min/1,73 m2 för diagnosen kronisk njursjukdom hos barn [8], det vill säga inom det GFR-område där det är viktigt att överväga remiss till barnnefrologi. Trots detta är eGFR-intervallet, inom vilket inte kronisk njursjukdom med 90 procents säkerhet kan bekräftas eller uteslutas, relativt brett uttryckt i ml/min/1,73 m2, från cirka 50 till 90 ml/min/1,73 m2, för både LMR18 och Schwartz–Lyon (Figur 2).
Samtliga kreatininformler i undersökningen hade otillräcklig P30-noggrannhet vid låga mGFR-värden, vilket delvis förklaras av att förhållandevis små skillnader mellan eGFR och mGFR på låga nivåer ger stora procentuella fel. Det genomsnittliga skattningsfelet i absoluta tal (medianabsolutfelet) vid mGFR <75 ml/min/1,73 m2 var dock relativt litet och tämligen likartat för LMR18 och Schwartz–Lyon, 8,5 respektive 7,4 ml/min/1,73 m2. Felet kan för enskilda patienter i vissa fall vara väsentligt högre med båda formlerna, till exempel för barn med låg muskelmassa [5].
Ett alternativ vid misstänkt låg njurfunktion eller abnormt låg muskelmassa är att använda eGFR baserad på P-cystatin C, som i valideringen baserad på hela den pediatriska EKFC-kohorten visade sig mer tillförlitligt vid dylika tillstånd [5]. Genom att använda det aritmetiska medelvärdet av den bästa kreatinin- och cystatin C-formeln som skattning av GFR kunde noggrannheten förbättras ytterligare vid mGFR både under och över 75 ml/min/1,73 m2 i samma studie. Denna ansats ger särskilt hög noggrannhet i situationer då skillnaden mellan eGFRkreatinin och eGFRcystatin är mindre än 20 procent av medelvärdet [17, 18]. Cystatin C-formler och aritmetiska medelvärden kan också implementeras i automatiska laboratoriesvar. När det krävs mer noggrann bedömning av njurfunktionen, exempelvis vid känsliga läkemedelsdoseringar eller utredningar av kronisk njursjukdom, bör emellertid invasiva clearancemätningar utföras. Det ska emellertid påpekas att andelen barn med låg GFR inom pediatrisk nefrologi är tämligen liten: endast 10 procent bland alla som remitterades för clearancemätningar hade mGFR <60 ml/min/1,73 m2 i detta material. Patienter med så låg GFR torde i de allra flesta fall ha upptäckts genom förhöjda P-kreatinin- eller P-cystatin C-värden och därmed redan vara omhändertagna av barnnefrologer.
Ett eventuellt införande av automatiserade laboratoriesvar avseende eGFR hos barn bör ske i samförstånd mellan klinisk kemi och barnläkare med kompetens inom nefrologi på regional nivå. Den viktigaste målgruppen för automatiserade svar torde vara icke-barnspecialister som ofta inte är vana vid att beräkna eGFR själva och kanske inte heller har tillgång till tillförlitliga längduppgifter. Man bör ta fram rekommendationer kring vilka eGFR-nivåer som bör föranleda remiss exempelvis från primärvård till barnspecialist och hur man bör förfara vid vissa läkemedelsdoseringar.
Sammanfattning
Genom omräkning av ett barns kreatininvärde till motsvarande nivå vid 18 års ålder kan LMR-formeln för vuxna även appliceras på barn med likvärdig noggrannhet som för de bästa pediatriska kreatininformlerna. Fördelen med denna åldersjustering av P-kreatinin i LMR18 är att den inte kräver uppgifter om kroppslängd och därför lätt kan implementeras för automatiska laboratoriesvar, som i stor utsträckning redan i dag är standard med LMR för vuxna vid svenska kemiska laboratorier. Dessutom innebär åldersjusteringen av P-kreatinin att väldefinierade referensintervall kan användas även för barn.
Läs även:
Medicinsk kommentar: Njurfunktionen hos barn är svår att mäta enkelt och exakt
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Ulla Berg, Jonas Björk, Anders Grubb, Anders Larsson och Ulf Nyman ingick i arbetsgruppen för SBU-rapport nr 214 »Skattning av njurfunktion. En systematisk litteraturöversikt« (2013).
Fakta 1. Formler för att omvandla ett barns (<18 år) plasmakreatininvärde till motsvarande värde vid 18 års ålder
ln är den naturliga logaritmen, Kr är barnets faktiska kreatininvärde (μmol/l), Ålder (år) är barnets aktuella ålder och Kr* är det åldersjusterade kreatininvärdet vid 18 års ålder [11]:
Pojkar:
ln(Kr*) = ln(Kr) + 0,259 × (18 – Ålder) – 0,543 × ln(18 / Ålder) – 0,00763 × (182 – Ålder2) + 0,0000790 × (183 – Ålder3)
Flickor:
ln(Kr*) = ln(Kr) + 0,177 × (18 – Ålder) – 0,223 × ln(18 / Ålder) – 0,00596 × (182 – Ålder2) + 0,0000686 × (183 – Ålder3)
Exempel
Plasmakreatinin 60 μmol/l hos en 10-årig flicka skulle vid 18 års ålder motsvara 79 μmol/l:
ln(Kr*) = ln(60) + 0,177 × (18 – 10) – 0,223 × ln(18 / 10) – 0,00596 × (182 – 102) + 0,0000686 × (183 – 103) ≈ 4,3757; e4,3757 ≈ 79 μmol/l
Med denna justering kan den reviderade Lund–Malmö-formeln [7] användas för både barn och vuxna då Kr* = det verkliga kreatininvärdet för individer ≥18 år:
LMR18 =eχ–0,0158 × max(Ålder;18) + 0,438 × ln(max(Ålder;18))
Flickor Kr* < 150 μmol/l: χ= 2,50 + 0,0121 × (150 – Kr*)
Flickor Kr* ≥ 150 μmol/l: χ = 2,50 – 0,926 × ln(Kr* / 150)
Pojkar Kr* < 180 μmol/l: χ = 2,56 + 0,00968 × (180 – Kr*)
Pojkar Kr* ≥ 180 μmol/l: χ = 2,56 – 0,926 × ln(Kr* / 180)
där max (Ålder;18) representerar den högsta åldern av individens verkliga ålder och 18 år, det vill säga att i formeln används 18 år för barn och verklig ålder för vuxna.
Fakta 2. Analysmetoder för plasmakreatinin och referenstest
| Karolinska universitetslaboratoriet Huddinge | Skånes universitetssjukhus Lund | |
| Plasmakreatinin, spårbara till IDMS (isotope dilution mass spectrometry) genom referensmaterial 967 (National Institute of Standards and Technology) | Enzymatisk (Roche Diagnostics, Mannheim, Germany) och Jaffe-metod (Beckman-Coulter, Brea, CA, USA) | Enzymatisk (Abbott Laboratories, Abbott Park, IL, USA) |
| Referensmetod | Johexol 4-punkts1) plasmaclearance2) | Johexol 1-punkts1) (≥40 kg) och 2-punkts1) (<40 kg) plasmaclearance3) |
Extern kvalitetssäkring (Equalis AB, Uppsala, Sweden, www.equalis.se/).
1) Tider för blodprovstagning baserad på skattad GFR
2) www.karolinska.se/for-patienter/karolinska-universitetslaboratoriet
3) www.analysportalen-labmedicin.skane.se
Fakta 3. Kreatininformler för barn
Plasmakreatinin (Kr) uttryckt i μmol/l, längd i centimeter, ålder i år och eGFR i ml/min/1,73 m2.
Chronic Kidney Disease in Children (CKiD; »Schwartz bedside«) [3]. Utvecklad baserad på nordamerikanska barn och rekommenderad av KDIGO (Kidney Disease: Improving Gl
Fakta 3. Kreatininformler för barn
Plasmakreatinin (Kr) uttryckt i μmol/l, längd i centimeter, ålder i år och eGFR i ml/min/1,73 m2.
Chronic Kidney Disease in Children (CKiD; »Schwartz bedside«) [3]. Utvecklad baserad på nordamerikanska barn och rekommenderad av KDIGO (Kidney Disease: Improving Global Outcomes) [19].
36,5 × Längd/Kr
Schwartz–Lyon [6]. Modifiering av CKiD baserad på franska och svenska barn.
Pojkar <13 år och flickor oavsett ålder: 32,5 × Längd/Kr
Pojkar ≥13 år: 36,5 × Längd/Kr
obal Outcomes) [19].
36,5 × Längd/Kr
Schwartz–Lyon [6]. Modifiering av CKiD baserad på franska och svenska barn.
Pojkar <13 år och flickor oavsett ålder: 32,5 × Längd/Kr
Pojkar ≥13 år: 36,5 × Längd/Kr