Stereoelektroencefalografi (stereo-EEG eller SEEG) är en säker och effektiv metod för att kartlägga det epileptiska nätverket och hitta anfallsursprunget hos patienter med farmakologiskt svårbehandlad epilepsi.
Metoden förutsätter omfattande planering baserad på flera undersökningsmetoder.
Vi presenterar resultaten av de första 30 patienterna utredda med SEEG vid Sahlgrenska universitetssjukhuset.
En majoritet av patienterna som opererades med resektion efter SEEG blev anfallsfria.
Ingen patient i denna serie drabbades av en allvarlig postoperativ komplikation.
Epilepsikirurgi är en säker och effektiv metod vid epilepsi som inte svarar på behandling med antiepileptika [1-3]. Beslutet om operation baseras på klinisk bedömning av symtom och tecken i samband med anfall (semiologi), video-EEG (VEEG), MR hjärna, neuropsykologisk undersökning och i vissa fall ytterligare icke-invasiva undersökningar. Om resultaten av semiologi, VEEG och MRT överensstämmer kan en epilepsikirurgisk resektion rekommenderas, förutsatt att detta kan göras utan att skada vitala hjärnfunktioner. När fynd från den icke-invasiva utredningen är otillräckliga eller inte överensstämmer, särskilt om man inte kan se förändringar vid MRT, kan invasiv utredning övervägas. Det finns två huvudtyper av invasiv utredning: subdural registrering med remsor eller plattor med elektroder (eventuellt kombinerat med enstaka djupelektroder) respektive stereoelektroencefalografi (stereo-EEG eller SEEG). Vid SEEG placeras flera djupelektroder med hög precision för att kartlägga det tredimensionella epileptiska nätverket. Varje SEEG-elektrod innehåller 6–18 registreringsytor.
SEEG utvecklades under 1960- och 70-talen i Frankrike av Jean Bancaud och Jean Talairach [4]. Jämfört med subdural utredning är fördelen med SEEG att man kan kartlägga djupt liggande hjärnområden, såsom insula, amygdala, hippocampus, cingulum och orbitofrontala kortex. Det har också visat sig att SEEG har en lägre frekvens av allvarliga komplikationer och kräver mindre smärtlindring jämfört med inläggning av subdurala plattor [5, 6]. Vid Sahlgrenska universitetssjukhuset startades SEEG-verksamhet 2013, och metoden har sedan dess nästan helt ersatt annan invasiv utredning inför epilepsikirurgi hos oss.
I denna artikel rapporterar vi erfarenheterna från de 30 första patienterna som utretts med denna metod vid Sahlgrenska universitetssjukhuset.
Patienter och metoder
Beslut om att erbjuda patienter SEEG har fattats vid en multidisciplinär epilepsikirurgirond baserat på resultat från den icke-invasiva utredningen med klinisk undersökning av epilepsispecialiserad neurolog, MR hjärna enligt epilepsikirurgiprotokoll, VEEG och neuropsykologisk utredning. Hos majoriteten av patienterna (21/30) gjordes även positronemissionstomografi med F-18-fluorodeoxiglukos (FDG-PET). Flertalet genomgick också transkraniell magnetstimulering (TMS) och/eller funktionell MRT för lokalisering av språk-/motorområden. I utvalda fall genomfördes undersökning med enfotonstomografi (SPECT) samregistrerad med MRT (så kallad SISCOM), magnetencefalografi (MEG) och, under de senaste åren, 7T (tesla)-MRT. Flera av dessa undersökningar (MEG, SISCOM, 7T-MRT och tidigare FDG-PET) genomfördes med hjälp av nationellt och internationellt samarbete.
Den slutliga indikationen för SEEG var att den icke-invasiva utredningen bekräftat diagnosen terapiresistent fokal epilepsi samtidigt som lokalisationen av anfallsursprunget baserat på icke-invasiv utredning var otillräcklig. Patienter erbjöds SEEG endast om utredningen bedömdes kunna leda till resektiv kirurgi med god effekt. För varje SEEG-utredning gjordes en individuellt anpassad plan för elektrodinläggning med syftet att besvara frågeställningar om anfallsstart, spridningsvägar för anfall, möjliga kopplingar inom det epileptiska nätverket och kartläggning av vitala hjärnområden för exempelvis motorik, språk och minne.
SEEG-inläggning
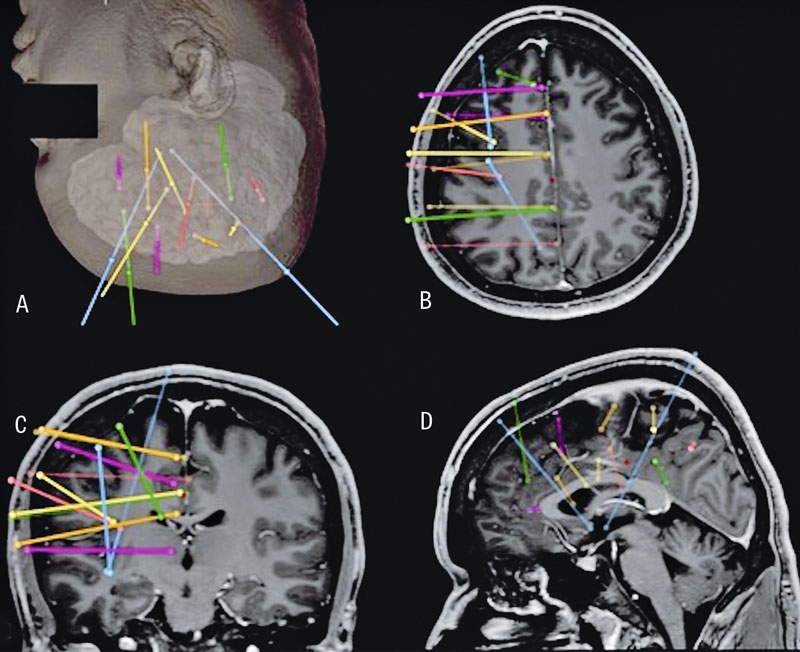
Utöver tidigare bilddiagnostik utfördes inför SEEG-utredningen MR hjärna med kontrast samt DT-angiografi för visualisering av hjärnans kärl. Den preliminära elektrodplaneringen gjordes av en neurofysiolog baserad på de hypoteser om anfallsursprung som man enats om vid epilepsikirurgikonferensen. Den definitiva elektrodplaneringen gjordes av neurokirurg och neurofysiolog gemensamt med planeringsstationen Stealth station S7 (Medtronic). Varje elektrod planerades utifrån önskad målpunkt och ingångspunkt samt aktuell kärlanatomi med en marginal på minst 4 mm till ytliga kärlstrukturer och minst 2 mm till djupare kärl (Figur 1).
Operationerna gjordes, med patienten i generell anestesi, av två neurokirurger specialiserade på epilepsikirurgi. Patientens huvud fixerades i ett huvudstöd (antingen 3- eller 4-punktsstöd) och registrering av patientanatomin till datorns 3D-modell gjordes med antingen ytanatomi, benförankrade skruvar eller 3D-DT (O-arm, Medtronic). Elektrodinläggningen gjordes med hjälp av neuronavigationssystemet
Stealth Station S7 eller S8 med antingen Vertek-arm eller Autoguide minirobot (samtliga Medtronic). Elektroderna som fördes in i hjärnan var av typen DIXI Microdeep SEEG electrodes (Dixi Medical) med en diameter på 0,8 mm. Varje elektrod fördes in genom en skruv med diametern 2,3 mm som fästes i skallbenet (Figur 2).
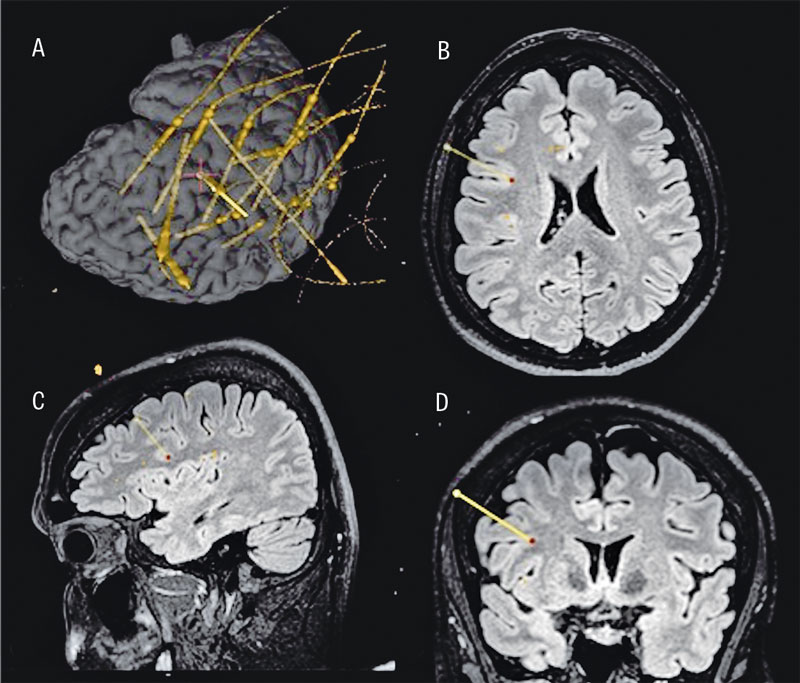
Den slutliga elektrodplaceringen verifierades med intraoperativ DT för 3D-rekonstruktion av elektrodläget innan patienten väcktes (Figur 3).
SEEG-registrering
Efter operationen kopplades SEEG-elektroderna till en monitoreringsstation i ett system där vi kan registrera upp till 256 kanaler med upp till 20 kHz insamlingsfrekvens. Bipolära montage och referensmontage skapades följda av ett montage för varje elektrod samt en översikt över samtliga elektroder, där endast elektroder i grå substans inkluderades. Patientens anfallssymtom registrerades sedan med video-SEEG. Ibland krävdes medicinreduktion för att patienten skulle få anfall. Elektrisk stimulering av SEEG-elektroder gjordes dels för att kartlägga funktionellt viktiga områden i eller kring epilepsinätverket, dels för att se om epilepsianfall kunde utlösas med elektrisk stimulering.
När man fått tillräckligt med elektrofysiologisk information avlägsnades elektroder och skruvar i lokalanestesi eller kort narkos. För att hindra likvorläckage sattes ett stygn där varje elektrod suttit. Patienten kunde sedan skrivas ut inom 1–2 dagar. Resultatet genomgick därefter en omfattande analys av klinisk neurofysiolog och diskuterades på epilepsikirurgisk konferens för beslut om vidare åtgärder.
Resultat
30 patienter opererades 2013–2019: 12 barn (4–18 år; median 13 år) och 18 vuxna (20–45 år; median 30 år). Tre patienter (två vuxna och ett barn) genomgick två operationer, varför det totala antalet operationer var 33.
Patienterna hade haft epilepsi i 1–43 år (median 11 år). Alla patienter hade fokal anfallsstart med varierande anfallssemiologi, 13/30 (43 procent) hade anfall som utvecklades till bilaterala tonisk-kloniska anfall och 3/30 (10 procent) hade haft status epilepticus. Hos 14/30 (47 procent) sågs en möjlig epileptogen lesion. Hos övriga patienter var resultatet av MRT negativt trots upprepade undersökningar och granskningar av neuroradiologer och medlemmar i epilepsikirurgiteamet.
21 patienter (70 procent), varav 6 barn, genomgick FDG-PET. Hos 10 av de 16 patienterna med negativ MRT sågs en hypometabolism vid FDG-PET, som kunde bidra till att lokalisera anfallsursprunget. 5 patienter (17 procent) hade helt normala fynd vid både MRT och PET.
Flera av patienterna hade genomgått tidigare invasiv utredning (7/30; 23 procent) eller epilepsikirurgi (5/30; 17 procent). De flesta implantationerna var unilaterala (85 procent). Samtliga implantationer gjordes i mer än en lob (3–6 lober; median 3) med följande representation av respektive lob: frontallob 97 procent, parietallob 83 procent, temporallob 73 procent, insula 67 procent, centralområdet (Rolandisk area) 40 procent och occipitallob 23 procent. Totalt lades 347 elektroder in (median 12/patient), och elektroderna låg inne 3–17 dagar (median 8 dagar, 7 hos barn och 10 hos vuxna). Tidsåtgången för en SEEG-operation var ca 2–3,5 timmar beroende på antalet inlagda elektroder.
Hos 20/30 patienter (67 procent) gjordes epilepsikirurgisk resektion baserad på SEEG: frontal resektion hos 9 (45 procent), temporal resektion hos 5 (25 procent), parietal resektion hos 4 (20 procent) och occipital resektion hos 2 (10 procent) patienter. Hos 9/20 (45 procent) opererade patienter bedömdes området som planerades för resektion delvis överlappa med eller vara i omedelbar närhet till funktionellt kritisk kortex. Hos 9 patienter visade SEEG att anfallsursprunget var multilobärt och vidare operation bedömdes inte vara aktuell. Hos de opererade patienterna visade PAD fokal kortikal dysplasi (FCD) i samtliga fall (13 med FCD typ II, 5 med typ I, 2 med typ IIIa) [7].
Av de 14 patienter som vid analystidpunkt hade minst 24 månaders uppföljningstid registrerad i Svenska nationella epilepsikirurgiregistret var 8 (58 procent) anfallsfria (Engel klass I). Hos sammantaget 15/20 patienter har resektiv kirurgi lett till anfallsfrihet eller minskning av anfallsfrekvensen (Engel klass I–III).
Inga dödsfall eller komplikationer med bestående neurologiska bortfall förekom i denna kohort. Mindre komplikationer drabbade 7/30 patienter (vissa patienter hade flera i kombination): en asymtomatisk epidural blödning, en lokal sårinfektion som fordrade lokal sårrevision efter utredningen, skruvar som lossnade hos 5 patienter (varav en skruv som penetrerade skallbenet utan konsekvens för patienten), en ökad svullnad postoperativt med övergående dysfasi och en patient med svårbehandlad postoperativ huvudvärk. Hos 3 patienter förekom en icke-habituell lång anfallsepisod (hotande fokalt status epilepticus) i samband med registrering.
Diskussion
Resultaten i denna serie avseende effekt på anfall hos patienter som kan erbjudas operation efter SEEG är jämförbara med större internationella centrum [8-11]. Andelen patienter som fick någon typ av komplikation var något högre än i vissa publicerade serier [5, 8]. Dock fick ingen patient bestående neurologiska bortfall, ingen av komplikationerna ledde till behov av intensivvård eller väsentligt förlängd vårdtid, och endast en patient behövde reopereras efter SEEG för att ta ut en skruv ur skallbenet.
Durationen av epilepsi innan SEEG utfördes var i median 6 år för barn och 14 år för vuxna. Detta kan tala för att man behöver öka tillgången för SEEG. Samtidigt är epilepsi en sjukdom som kan fluktuera mycket i sitt förlopp med varierande anfallsfrekvens i olika delar av utvecklingen och livet. I denna kohort ingår flera vuxna patienter med mycket lång duration av epilepsi, där man efter tidigare invasiv utredning och/eller operation har avstått från vidare epilepsikirurgiutredning. SEEG har för dessa patienter inneburit en ny möjlighet att utreda epilepsin.
Två tredjedelar av patienterna som genomgått SEEG erbjöds resektion, varav knappt 60 procent var anfallsfria vid uppföljning efter två år. Det finns flera möjliga orsaker till att andelen anfallsfria inte var ännu högre: svårbehandlad epilepsi med lång epilepsiduration och hög andel bilateralt tonisk-kloniska anfall, nästan 50 procent patienter med normal MRT och i många fall anfallsursprung nära funktionellt viktig kortex. Det faktum att PAD i samtliga fall visade någon form av kortikal missbildning, lesioner välkända för att orsaka epilepsi, visar att vi med stor sannolikhet hittat rätt anfallsursprung. Att patienten ändå inte blev anfallsfri efter operation kan då bero på att man har opererat bort endast delar av missbildningen, till exempel på grund av att den är mycket stor, multifokal eller ligger nära viktiga hjärnområden.
Även för patienter som inte kan erbjudas epilepsioperation kan SEEG vara av stort värde. Vissa patienter kan erbjudas termokoagulation i områden som visar hög iktal eller interiktal epileptisk aktivitet. Termokoagulation är en palliativ åtgärd som innebär destruktion av en liten kortikal volym i närhet av SEEG-kontakt med hjälp av elektrisk ström levererad till två närbelägna SEEG-kontakter. Om detta inte är möjligt ger utredningen en mer detaljerad bild av patientens epilepsi, och vårdgivare och patient kan känna att man har gjort allt för att utreda epilepsin. Detta kan göra det lättare att avsluta epilepsikirurgiutredningen och fokusera på andra behandlingsmöjligheter.
Konklusion
SEEG är en säker och effektiv metod för att kartlägga det epileptiska nätverket och hitta anfallsursprunget hos patienter med farmakologiskt terapiresistent epilepsi. En majoritet av patienterna som opererades med resektion efter SEEG blev anfallsfria. I denna serie drabbades ingen patient av allvarlig komplikation till följd av SEEG.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Samtliga medarbetare i epilepsikirurgiteamen inom Epilepsicentrum, Sahlgrenska universitetssjukhuset, har bidragit till datainsamling. Epilepsikirurgicentrum i Lund, Stockholm, Uppsala och Århus har samverkat gällande undersökningar. Anders Hedström har bidragit vid införandet av den neurofysiologiska delen av SEEG. Didier Scavarda har bidragit med den kirurgiska metoden för inläggning av SEEG.