Ett material bestående av 93 plasmaprov från individer med misstänkt lungcancer, varav 69 matchade lungcancerprov från både blodprov och biopsimaterial, analyserades med NGS-teknik.
Analys av cirkulerande tumör-DNA från blodprov (»liquid biopsies«) detekterar ca 75 procent av behandlingsvägledande mutationer i senare stadium av lungcancer.
Tidigare diagnos av lungcancer kan bidra till kortare standardiserade vårdförloppstider och tidigare behandlingsstart.
Lungcancer är den vanligaste orsaken till cancerdöd globalt. Tidig diagnos och en individualiserad behandlingsstrategi är avgörande för att förbättra överlevnaden och livskvaliteten för lungcancerpatienter. Alla tumörer orsakas av skador på DNA- och/eller RNA-nivå [1], och under det senaste årtiondet har flera cancergenetiska biomarkörer (mutationer och fusionsgener) identifierats som möjliggör en genetisk subgruppering av lungcancer, som nu även ofta kan matchas till en riktad molekylär precisionsbehandling [2]. De senaste åren har det även tillkommit en revolutionerande utveckling av analysmetoder inom diagnostiken, där man genom ett blodprov kan analysera cirkulerande tumör-DNA (ctDNA) för detektion av biomarkörer [3].
Cirkulerande tumör-DNA är läckage av DNA från tumörceller som finns i blodet hos patienter med cancer. Med nya känsligare molekylärgenetiska metoder som NGS (next generation sequencing) eller digital PCR kan cirkulerande tumör-DNA analyseras för att ge fördjupad information om tumörens genetiska förändringar utan en mer invasiv provtagning [4, 5]. Tekniken kan vara särskilt användbar för att övervaka behandlingsrespons, identifiera resistensutveckling och upptäcka tidiga återfall eller som en del av diagnostiken [3]. Metoden har även fördelen att kunna detektera mutationer från flera eventuellt metastaserade cancerkloner och därmed representera de olika subklonerna av maligniteten. Detta ger en inblick i den intratumorala heterogeniteten, vilket är en avgörande faktor vid utformningen av behandlingsstrategi [6].
För att påvisa den kliniska nyttan av tidig analys av cirkulerande tumör-DNA vid misstanke om lungcancer rapporterar vi en pilotstudie som analyserat blodplasma från 93 individer som sökt sjukvård med misstanke om lungcancer. Studien syftade till att utvärdera förmågan att upptäcka genetiska förändringar som är förknippade med lungcancer i plasmaprov tagna redan vid första läkarbesöket. Blodprov togs i samband med annan venös provtagning vid patientens första sjukvårdsbesök, och plasman separerades för att isolera cirkulerande tumör-DNA, som analyserades med hjälp av NGS-teknik.
Resultatet från plasmaprovet jämfördes med ett matchat vävnadsprov från samma patient med nyligen fastställd morfologisk lungcancerdiagnos. Studieresultatet ger värdefulla insikter om klinisk användbarhet av att använda cirkulerande tumör-DNA för att bidra till tidigare diagnos och behandlingsstrategier för patienter med lungcancer. Detekterbarheten vid analys beror på hur mycket cirkulerande tumör-DNA som släpps ut i blodomloppet, vilket kan variera beroende på i vilket stadium cancern upptäcks; också detta analyseras i studien.
Metod
Samtliga patienter som deltog i studien informerades personligen vid provtagningstillfället och gav ett skriftligt samtycke till medverkan i studien.
Studien inkluderade initialt blodprov från 93 individer (50 kvinnor och 43 män) med misstänkt lungcancer, varav 74 individer senare bekräftades ha lungcancer. Hos 69 av de ursprungliga 93 patienterna med plasmaprov hade ett matchande biopsimaterial från vävnad eller cytologi med morfologiskt cellulärt bekräftad tumör. Hos 3 av patienterna saknades konklusivt biopsimaterial för molekylär analys, varvid cirkulerande tumör-DNA användes. 15 patienter hade andra/okända maligniteter eller hade inte utretts molekylärt, och 6 individer hade inte någon fastställd cancerdiagnos. Se Figur 1 för översikt av patientprovgruppering.
Studien har godkänts av Etikprövningsmyndigheten (dnr 2019-03920) med tillägg av ett enskilt samtycke av samtliga individer som deltog i studien.
Molekylär testning av plasma-ctDNA
Plasma-ctDNA-testningen utfördes med Oncomine Lung cfDNA assay (Thermo Fisher), en NGS-panel bestående av delar av områden (lokus) i 11 cancerassocierade gener. Blodprov samlades i två streckrör och plasma framställdes genom dubbel centrifugering och förvarades i –80°C. Extraktion av ctDNA utfördes med QIAamp MinElute ccf-DNA Midi kit (Qiagen). Sekvenseringsbibliotek preparerades med Ion Ampliseq Library kit 2.0 och sekvenserades på en Ion PGM, och data analyserades med Torrent Suite (Thermo Fisher).
Behandlingsvägledande mutationer för lungcancer på DNA-nivå som analyserades var mutationer i generna EGFR exon 18–21, KRAS p.G12C, BRAF p.V600E eller MET ex14 skipping.
Molekylär testning av tumörbiopsi
Molekylär testning av tumörmaterial (vävnad eller cytologi) utfördes enligt respektive regions kliniska rutiner. Testningen initierades av ansvarig patolog vid morfologi som visade på lungcancerdiagnos, oberoende av plasmaresultat. För 3 prov fanns inte tillräckligt med tumörmaterial, varför den primära molekylära testningen utfördes på ctDNA från plasma (taget vid annat tillfälle).
Resultat
Studien utforskade användningen av cirkulerande tumör-DNA i blodprov för analys av cancergenetiska biomarkörer för att tidigt i utredningen stärka misstanke om lungcancer.
Totalt analyserades 93 plasmaprov, varav 74 bekräftade lungcancer.
Hos 69 patienter med lungcancer analyserades både plasmaprov och det matchande biopsimaterialet. 34 av de 69 matchade patientproven uppvisade samstämmigt inga mutationer i någon av de analyserade generna (normal genotyp). 20 patienter uppvisade samstämmigt cancerassocierade mutationer eller behandlingsstyrande mutationer i båda provmaterialen (20 cancerassocierade mutationer, varav 6 behandlingsstyrande mutationer). Totalt fanns en samstämmighet i 54 av 69 av de matchade paren (78 procent).
I biopsimaterialet identifierades ytterligare 6 cancerassocierade och 7 behandlingsstyrande mutationer som inte kunde återfinnas i plasmaproven. I ett av plasmaproven identifierades en behandlingsvägledande EGFR-mutation som inte kunde bekräftas i biopsiprovet. Totalt identifierades 14 patienter med direkt behandlingsstyrande mutationer i båda materialen. 7 av de 14 mutationerna återfanns i plasmaprovet, vilket gav en detekterbarhet på ca 50 procent för behandlingsvägledande mutationer i ctDNA-analysen för hela materialet (se även nedan om analys av koppling mellan tumörgrader). För cancerassocierade genetiska biomarkörer plus behandlingsassocierade biomarkörer var samstämmigheten 20 av 34 (59 procent) i hela materialet.
I de 3 plasmaprovparen (ctDNA-proven som matchades mot ctDNA-material) hade 2 prov överensstämmande fynd (normal variant respektive mutation i PIK3CA). I 1 fall uppvisade det ena plasmaprovet en behandlingsvägledande mutation i EGFR p.L747_P753delinsS som inte kunde bekräftas i det matchade provet, där analysen i stället uppvisade en annan behandlingsvägledande EGFR-mutation (EGFR p.T854S).
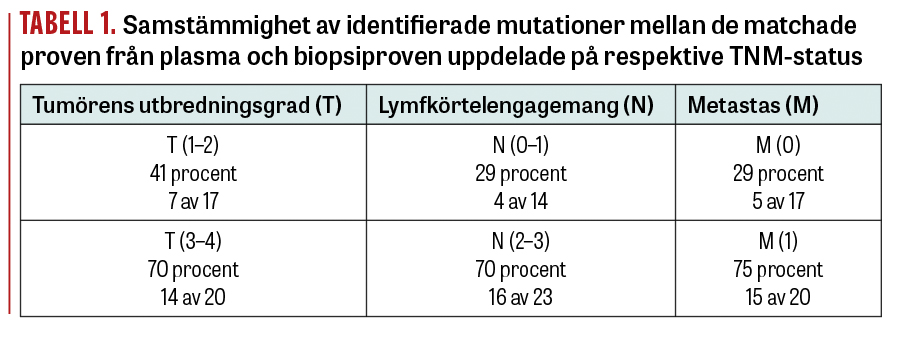
Hos de 34 patienter som uppvisat mutationer i någon av de cancerassocierade eller behandlingsstyrande generna i biopsimaterialet och/eller plasmaprovet gjordes en utvärdering av huruvida tumörens utbredning eller förekomst av tumörer i lymfkörtel eller metastaser (TNM) kunde korrelera till samstämmighet mellan de matchade proven.
Trots att materialet var relativt litet ser vi en tendens till ökad samstämmighet vad gäller möjligheten till detektion av mutationer i plasmaprovet hos de patienter som har a) högre tumörgrad (T = III–IV), b) högre klassat lymfkörtelengagemang (N = 2–3) och c) förekomst av metastaser (M = 1) (Tabell 1).
Diskussion
Analys av cirkulerande tumör-DNA har potential att väsentligt gagna cancerpatienten på flera sätt när det gäller diagnostik, behandlingsövervakning och individualiserad vård. Tekniken finns tillgänglig på flera svenska sjukhuslaboratorier och används redan vid lungcancer, till exempel vid resistensfrågeställningar och/eller då annat adekvat material inte är tillgängligt. Tidig upptäckt av cancerassocierade mutationer kan stärka misstanken om malignitet och påskynda utredning och behandlingsstart för patienten. I vissa fall kan även behandling med målstyrda cancerpreparat sättas in tidigare.
Flera studier har under de senaste åren visat hur analys av cirkulerande tumör-DNA kan bidra till tidigare diagnos och därmed tidigare behandlingsintervention, vilket kan öka chanserna för framgångsrik behandling och överlevnad [7, 8]. En studie från Kanada visade nyligen kortare utredningstider (39 versus 62 dagar) då analys av cirkulerande tumör-DNA utfördes redan vid misstanke om lungcancer [9]. Tekniken har även använts framgångsrikt i studier för att monitorera risk för återfall av lungcancer efter kirurgi [10].
Lungcancerutredningar är komplexa och kräver mycket av flera diagnostiska verksamheter inom sjukvården. Ledtiden för standardiserat vårdförlopp för lungcancer bör enligt det nationella vårdprogrammet ligga på <40–44 dagar vid tumörspecifik behandling och <30 dagar vid enbart symtomlindrande behandling. Under 2022 nåddes vårdförloppsrekommendationen endast för 27 procent av lungcancerpatienterna [11]. Nya arbetssätt, till exempel analys av cirkulerande tumör-DNA från plasma redan vid stark misstanke om cancer, kan förhoppningsvis förkorta utredningstiden för vissa patientgrupper med uppskattningsvis 10–14 dagar (författarnas uppskattning). Traditionell utredning med morfologisk patologi är fortfarande essentiell för en korrekt slutgiltig diagnos, men möjligheten att använda genetiska biomarkörer från ett blodprov i kombination med patientens anamnes bör inte förbises.
Resultatet från analys av cirkulerande tumör-DNA får användas som en »kompassriktning« och inte en exakt »GPS-position«. Vissa genmutationer, till exempel BRAF p.V600E, förekommer vid flera olika maligna tillstånd, till exempel malignt melanom, lungcancer och kolorektalcancer. Analys av cirkulerande tumör-DNA kan ännu inte användas uteslutande diagnostiskt, annat än för att stärka misstanken om malignitet hos patienter med mutationen och därmed påskynda utredningen. I ett av proven uppvisade analysen två olika behandlingsvägledande EGFR-mutationer. Det skulle kunna förklaras av tumörheterogenitet, det vill säga att olika delar av tumören uppvisar olika mutationer. Detektion av cirkulerande tumör-DNA från flera cancerkloner är ytterligare en fördel med ctDNA-analysen.
Detektionsnivån av cirkulerande tumör-DNA med NGS varierar mellan 60 och 80 procent i olika studier [12, 13], men med de senaste årens utveckling med både användning av DNA-stabiliserande rör vid provtagning samt känsligare och bredare molekylärgenetiska tekniker finns rapporter om känslighet upp till 94–97 procent [14, 15]. Vi detekterar en samstämmighet i resultatet av samtliga fynd med det matchade materialet i ca 78 procent av proven (54 av 69). För cancerassocierade mutationer är samstämmigheten 70 procent (14 av 20) och för de behandlingsstyrande mutationerna återfinns ca 50 procent av mutationerna (7 av 14). En tidig detektion av cancerassocierade eller behandlingsstyrande mutationer stärker misstanken om malignitet och kan då fungera som ytterligare ett kriterium för prioriterad utredning och start av målstyrd behandling, vilket på sikt även kan gagna andelen patienter som utreds inom fastställda standardiserade vårdförloppstider för lungcancer.
Vi noterar en tendens till ökad samstämmighet i förekomst av cancerassocierade mutationer i de matchade plasma- och tumörvävnadsproven hos patienter med avancerad sjukdom och högre TNM-stadium (se Tabell 1). Resultatet är i linje med andra studier som visat samband mellan förekomst av mutationer i cirkulerande tumör-DNA i plasma hos patienter med lungcancer och en mer framskriden sjukdom [16].
Sammanfattningsvis visade studien att analys av cirkulerande tumör-DNA har potential som en lovande teknik för den kliniska lungcancerdiagnostiken. Resultaten indikerade att cirkulerande tumör-DNA kan vara användbart för tidig upptäckt av lungcancer och att dess pålitlighet förbättras vid avancerade tumörstadier. Det finns fortfarande utmaningar med analysens känslighet, framför allt vid tidig cancer där graden av cirkulerande tumör-DNA förmodligen är mycket låg. Kostnader för en tidig överdiagnostik med NGS-teknik får heller inte underskattas, men blir förmodligen acceptabel på sikt med effektivare utredningsgång. Ytterligare forskning och validering med större patientkohorter krävs för att verifiera dessa lovande resultat och fullt ut förstå den diagnostiska potentialen med att analysera cirkulerande tumör-DNA inom annan cancerdiagnostik, inte bara vid lungcancer.
Studien har finansierats av forskningsmedel från Cancerstiftelsen i Kalmar län, Florence och Sten Sirmans minnesfond, Eber och Ingrid Kinnemos stiftelse och FORSS (Forskningsrådet Sydöstra Sverige).
Potentiella bindningar eller jävsförhållanden: Anders Vikström har under åren 2021–23 varit rådgivare och/eller föreläst på möten arrangerade av Amgen, Astra Zeneca, Boehringer Ingelheim, BMS, Janssen, Lilly, Merck, MSD, Novartis, Pfizer, Roche, Sanofi och Takeda. Fredrik Enlund har under åren 2021–23 varit rådgivare och/eller föreläst på möten arrangerade av Astra Zeneca, Pierre Fabre, Roche och Takeda.