Mer än var tionde vuxen i Sverige behandlas med statiner.
Muskelsvaghet, -trötthet och -värk är kända biverkningar. I sällsynta fall ses rabdomyolys, som kan leda till akut njursvikt och någon gång dödsfall.
Statiners kemiska egenskaper och serumkoncentration påverkar risken för allvarliga biverkningar. Serumkoncentrationen beror på dos och på patientens förmåga att omsätta läkemedlet.
Akademiska sjukhuset har som första svenska sjukhus infört analys av en genetisk variant (SLCO1B1*5) som kan förutsäga ökad risk för sällsynta, allvarliga muskelbiverkningar vid statinbehandling.
Hämmare av hydroximetylglutaryl-koenzym A-reduktas (HMG-CoA-reduktashämmare), statiner, används för behandling av förhöjda blodfetter och som sekundärprevention vid kardiovaskulära sjukdomar som hjärtinfarkt och ischemisk stroke. De preparat som är tillgängliga i dag är simvastatin, pravastatin, fluvastatin, atorvastatin och rosuvastatin [1]. Cerivastatin är avregistrerat [1]; det drogs in från den svenska marknaden 2001 på grund av rapporterade dödsfall sekundära till rabdomyolys och njursvikt. Under 2009 fick ca 370 000 kvinnor och 438 000 män i Sverige recept ur gruppen kolesterol- och triglyceridsänkande medel (ATC-kod C10A). Enbart läkemedlet simvastatin förskrevs i 72,5 miljoner definierade dygnsdoser (DDD) för kvinnor och i 95,7 miljoner för män [2].
Muskelbiverkningar vanliga
Symtom från musklerna är vanliga vid behandling med statiner [3]. Svårare besvär i form av myopati kännetecknas av muskelvärk, muskelömhet eller muskelsvaghet i kombination med förhöjda nivåer av kreatinkinas (CK) i plasma eller serum. Kreatinkinas, ett intracellulärt enzym som huvudsakligen finns i muskelceller, läcker ut i samband med muskelskada av olika genes. För att kallas myopati krävs vanligtvis en stegring av CK till tio gånger den normala övre referensgränsen, men det finns ingen internationellt vedertagen definition av begreppet statinmyopati [4]. Risken för svåra muskelbiverkningar är dosrelaterad, och upp till 0,5 procent av statinbehandlade patienter drabbas [5]. Risken ökar då statiner ges tillsammans med läkemedel som hämmar deras nedbrytning och vid kombinationsbehandling med andra blodfettsänkande läkemedel, såsom fibrater och nikotinsyra [3].
I sällsynta fall utvecklas rabdomyolys med förhöjda myoglobinnivåer i plasma och urin samt ibland akut njursvikt. Patofysiologin bakom njursvikten är komplex och innefattar sannolikt både utfällning av myoglobin i njurtubuli och vasokonstriktion till följd av minskad cirkulerande plasmavolym på grund av vätskeansamling i skadad muskulatur [6].
Flera faktorer, såsom genetiska varianter, behandling med läkemedel som påverkar statinmetabolismen, hög ålder, sjukdomar (nedsatt lever- och njurfunktion, obehandlad hypotyreos, muskelsjukdom, multiorgansjukdom), kvinnligt kön, större kirurgiskt ingrepp eller trauma, kraftig fysisk aktivitet, infektioner och stort intag av grapefruktjuice, har uppgetts öka risken för statininducerad myopati [3, 4].
Genvarianten SLCO1B1*5 och simvastatinutlöst myopati
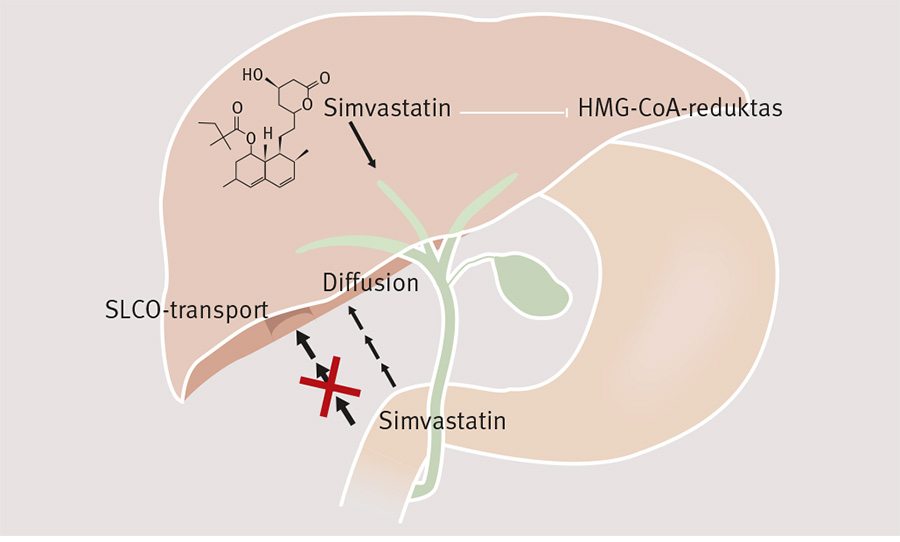
Sambandet mellan svåra muskelbiverkningar och en variant av genen SLCO1B1 (solutecarrier organic anion transporter family, member 1B1; RefSeq: NM_006446) upptäcktes i en studie på simvastatin [7]. Genen, som är lokaliserad på kromosom 12p12, kodar för ett transportprotein som deltar i aktivt upptag av bl a statin och bilirubin i levern. Bland nordeuropéer är ca 30 procent bärare av en variant i exon 6 (rs4149056, även kallad c.521T>C eller *5), som ändrar aminosyrasekvensen (Val174Ala) och påverkar proteinets funktion [8]. Denna genvariant ökar exponeringen för vissa statiner på grund av lägre upptag i levern [9] (Figur 1). Den största effekten ses för simvastatinsyra, den aktiva metaboliten av simvastatin, hos personer som är homozygota för *5 [10, 11]. Bärare av *5 har också ökad risk för svåra muskelbiverkningar av framför allt simvastatin [7]. Risken är särskilt hög hos de 2 procent som är homozygota för varianten *5 [7]. Mer än 60 procent av statinutlösta myopatifall tros bero på denna genvariant [7].
Statiner omsätts på olika sätt, varför mutationens betydelse varierar beroende på vilken statin som används. Fluvastatin, pravastatin, simvastatin, atorvastatin och rosuvastatin har studerats hos friska försökspersoner. Den största effekten av SLCO1B1-genotyp sågs för simvastatinsyra med en 3,2-faldig ökning av AUC (area under kurvan) hos homozygota bärare av rs4149056. SLCO1B1 påverkade i sjunkande ordning AUC för atorvastatin, pravastatin och rosuvastatin men påverkade inte fluvastatin i nämnvärd grad, varför indikation saknas för SLCO1B1-genotypning vid fluvastatinbehandling [12, 13].
Cytokrom P450 (CYP)-enzymer är viktiga för metabolismen av flertalet statiner, med undantag av pravastatin. Detta är särskilt viktigt att tänka på hos patienter som medicinerar med potenta CYP-hämmare. Statinerna utsöndras i varierande grad via gallan eller njurarna. För en utförligare genomgång av specifika statiners metabolism hänvisas till mer specialiserad litteratur och Fass [1].
Rekommendationer, indikationer och analysbeställning
Generella rekommendationer om genotypning av SLCO1B1 inför statinbehandling i Sverige saknas. Föreslagna indikationer för analysen är:
- Farmakogenetisk analys inför planerad högdos statinbehandling (>20 mg simvastatin, atorvastatin eller rosuvastatin eller >40 mg pravastatin).
- Medicinering med interagerande läkemedel.
- Försämrad utsöndring av läkemedlet via lever eller njurar.
- Andra potentiella riskfaktorer för statininducerad myopati, särskilt hos en multisjuk patient.
- Utredning av myopati eller rabdomyolys hos en statinbehandlad patient.
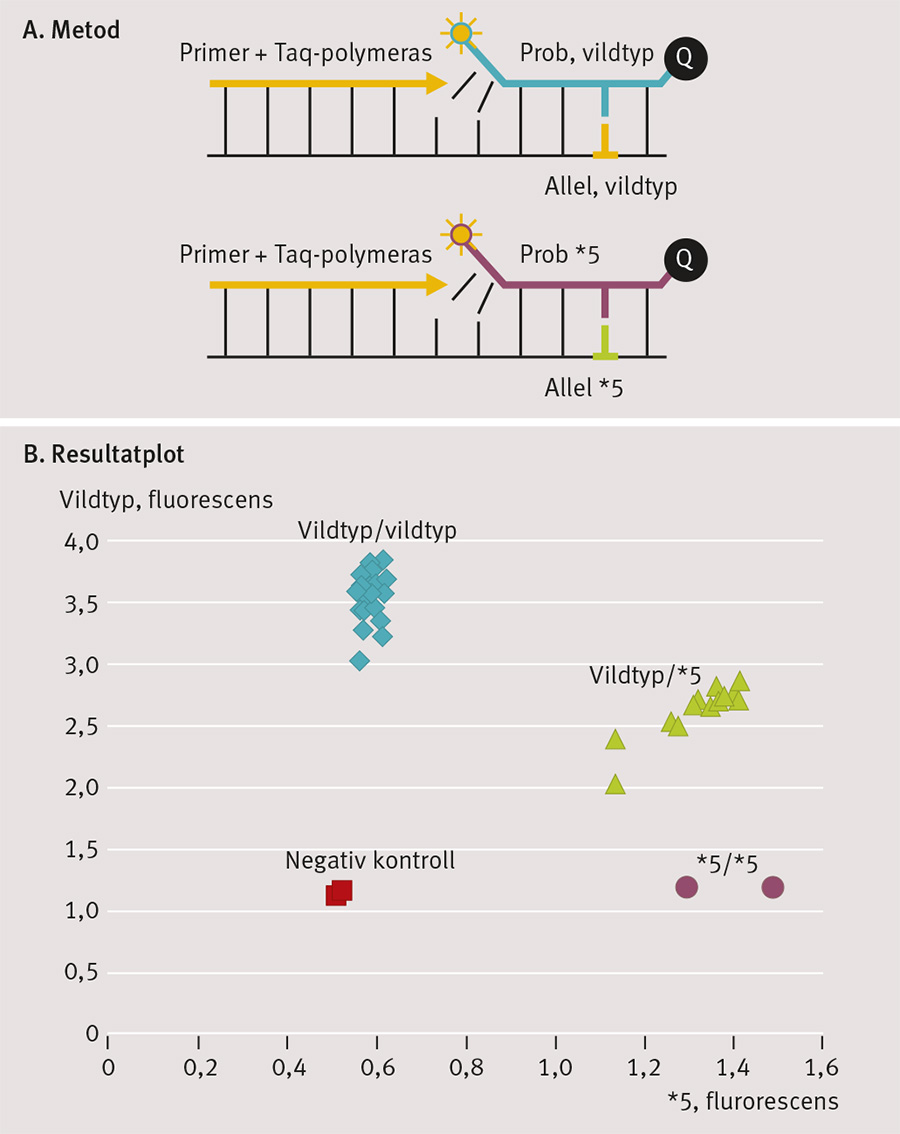
Analysen kan beställas på pappersremiss från Akademiska sjukhuset ‹ http://www.genotypning.se ›. Figur 2 visar analysmetoden.
Beräkning av nyttan av genotypning
Ett fall av statinintolerans kan undvikas om nio personer som ska behandlas med ≥40 mg simvastatin genotypas för
SLCO1B1*5 [8]. För att undvika ett fall av sällsynt, allvarlig muskelbiverkan på grund av SLCO1B1*5 krävs dock att betydligt fler genotypas före insättning av simvastatin. För att undvika ett allvarligt fall skulle man teoretiskt sett behöva genotypa ca 5 700 patienter. Detta antal baseras på att en av 3 400 statinpatienter beräknas få en mycket allvarlig muskelbiverkan [14] och att SLCO1B1 orsakar ca 60 procent av fallen av allvarlig myopati [7].
I dagsläget bedöms det inte vara nödvändigt att SLCO1B1-
genotypa alla patienter som statinbehandlas. Risken för muskelbiverkningar är störst under det första året och vid samtidiga kliniska riskfaktorer [15]. Därför föreslås att enbart patienter med flera riskfaktorer genotypas för SLCO1B1 vid insättning av statiner.
Under år 2009 påbörjades statinbehandling för ca 108 000 personer i Sverige [16]. Om ca 5 procent av dessa, med högst klinisk risk för myopati, skulle genotypas skulle man i teorin kunna förhindra 1 fall av sällsynt, allvarlig muskelbiverkan, 9–10 fall av myopati och ca 600 fall av statinintolerans per år. Pågående studier och framtida utvärderingar kommer att bringa större klarhet i SLCO1B1-genotypningens prediktiva och preventiva värde.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.