Depression är vanligt förekommande vid graviditet.
Risken för fosterskador är liten med de flesta antidepressiva läkemedel.
Fysiologiska förändringar i samband med graviditet påverkar läkemedels farmakokinetik.
Metabolism via CYP har stor betydelse för eliminationen av antidepressiva läkemedel.
CYP-aktiviteten kan förändras vid graviditet.
CYP2D6-aktiviteten ökar kraftigt, vilket ger lägre serumkoncentrationer av vissa läkemedel (exempelvis paroxetin och fluoxetin).
En sänkt serumkoncentration medför risk för klinisk försämring.
Förändrad farmakokinetik, bruk av interagerande läkemedel samt osäkerhet rörande följsamhet till ordination motiverar serummonitorering vid graviditet.
Depression och ångestsyndrom är vanligt förekommande vid graviditet, med en uppskattad prevalens kring 10–15 procent [1]. Obehandlad depression under graviditet har bland annat associerats med ökad risk för prematur födsel [2].
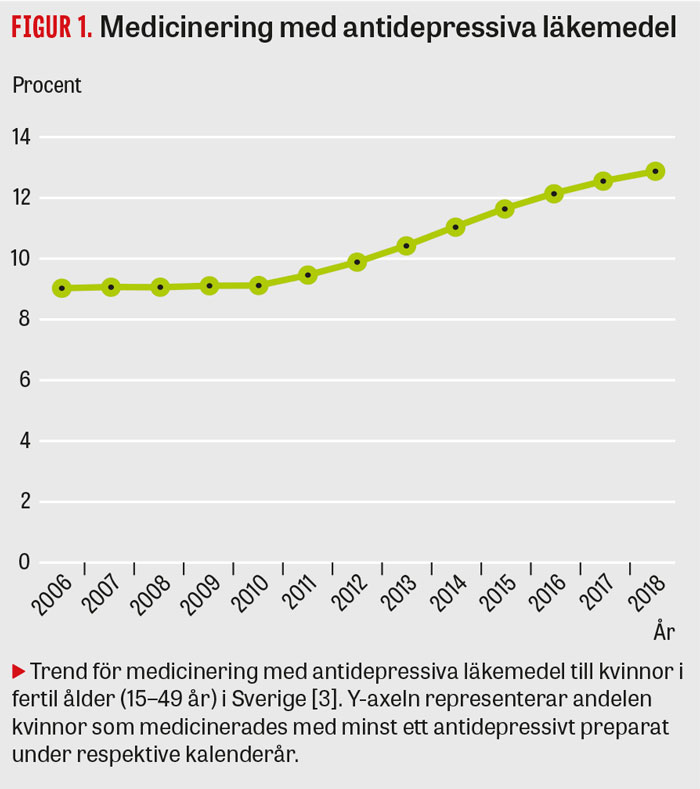
De vanligaste antidepressiva läkemedel som förskrivs till kvinnor i fertil ålder är selektiva serotoninåterupptagshämmare (SSRI), Tabell 1 [3]. Andelen svenska kvinnor i fertil ålder som förskrivs antidepressiva läkemedel har ökat kraftigt det senaste decenniet (Figur 1) [3]. I Sverige använder minst 4 procent av alla kvinnor antidepressiva läkemedel under graviditeten [4]. Det bör poängteras att en del antidepressiva läkemedel har fler indikationer än enbart depression och ångest, exempelvis amitriptylin, som även används vid vissa smärttillstånd [5].
Någon påvisbar riskökning för fosterskador vid användning i tidig graviditet tycks inte finnas för sertralin, citalopram, escitalopram, venlafaxin eller amitriptylin. Vad beträffar mirtazapin är kunskapsunderlaget sämre, men troligtvis är missbildningsrisken försumbar [6]. Däremot finns det data som indikerar en något förhöjd missbildningsfrekvens (främst hjärtmissbildningar) vid användning av paroxetin eller fluoxetin i tidig graviditet (2,8 respektive 2,6 procent jämfört med förväntade 2,1 procent) [7, 8]. Det är för tillfället oklart om vortioxetin, duloxetin eller bupropion ger ökad risk för missbildningar. På Janusinfo.se finns en sammanfattning av kunskapsläget för respektive preparat [8].
Intrauterin exponering för antidepressiva läkemedel påverkar i viss mån även det nyfödda barnet. Risken för övergående respiratoriska och neurologiska symtom hos barnet är något förhöjd om modern använt SSRI under graviditeten [9]. Den absoluta risken för allvarliga neonatala komplikationer, såsom persisterande pulmonell hypertension, är dock låg för såväl läkemedelsexponerade (0,1–0,5 procent) som icke-exponerade barn (0,05–0,3 procent) [7, 9].
Vid farmakologisk behandling av gravida måste man värdera ovanstående risker mot de risker obehandlad sjukdom medför för modern och barnet. Korrekt diagnostik med noggrann bedömning av tillståndets svårighetsgrad är av yttersta vikt för en adekvat risk/nyttoanalys. Vid till exempel lindriga depressiva symtom är nyttan med farmakologisk behandling begränsad, och psykoterapeutiska interventioner rekommenderas i första hand [10]. Vid måttlig till svår depression föreligger indikation för farmakologisk terapi, vilket då bör erbjudas som behandlingsalternativ även för gravida kvinnor [10]. Målsättningen med farmakologisk terapi är densamma för gravida som för icke-gravida, det vill säga remission av de depressiva symtomen. Det är inte önskvärt att minska doseringen av läkemedlet under graviditeten, om detta medför försämrad behandlingseffekt. Då utsätter man fortfarande fostret för risker associerade med läkemedlet, samtidigt som modern riskerar att återinsjukna i en depressiv episod [10].
Farmakokinetik
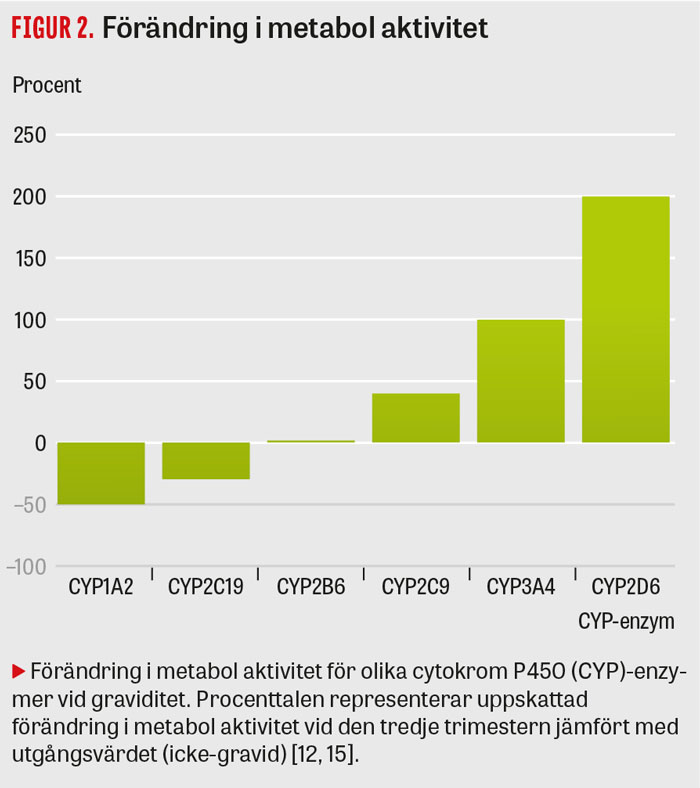
Det sker ett flertal fysiologiska förändringar vid graviditet. Dessa förändringar kan påverka läkemedels farmakokinetik (hur läkemedel omsätts i kroppen) och därmed även deras serumkoncentration och kliniska effekt. Graviditetsillamående, förhöjt pH i magsäcken samt minskad gastrointestinal motilitet kan medföra försämrad absorption. Ökad total kroppsvattenvolym och plasmavolym, kombinerat med minskad koncentration av läkemedelsbindande plasmaproteiner (framför allt albumin), påverkar distributionen av läkemedel. Flertalet läkemedel metaboliseras via cytokrom P450 (CYP)-enzymer och/eller konjugerande enzymer, såsom uridindifosfat-glukuronosyltransferaser (UGT). Dessa enzymers aktivitet kan förändras under graviditeten (Figur 2). Blodflöde och glomerulär filtrationshastighet (GFR) via njurarna ökar med 50–80 procent, vilket ökar eliminationen av läkemedel med huvudsakligen renal elimination, exempelvis litium [11-13].
Metabolism via CYP-enzymer är central för elimination av antidepressiva läkemedel [14]. Denna metabolism kan öka, minska eller förbli konstant under graviditeten, beroende på vilket CYP-enzym som avses (Figur 2). Storleken av dessa förändringar varierar också mellan individer. Den exakta mekanismen för förändrad enzymaktivitet vid graviditet är okänd [15]. Förändrade nivåer av vissa hormoner (progesteron, östrogen och kortisol) hos gravida har föreslagits som förklaring till inducering (ökad aktivitet) av CYP3A4 och CYP2C9 samt inhibition (lägre aktivitet) av CYP2C19 [15]. CYP2D6 induceras kraftigt under graviditeten. Prekliniska studier indikerar att förändrad reglering via transkriptionsfaktorerna SHP (small heterodimer partner) och KLF9 (Krüppel-liknande faktor 9) kan ha betydelse för denna enzyminduktion [16].
Förändrad farmakokinetik under graviditeten påverkar koncentrationen av läkemedel i serum och andra vävnader. Ökad metabolism/elimination ger lägre serumkoncentrationer, vilket för vissa patienter medför – i strid mot spontan intuition – att dosen behöver höjas. Som exempel behöver man ofta höja dosen av litium (ökad renal elimination) och lamotrigin (ökad metabolism via UGT1A4) för att bibehålla terapeutisk effekt i samband med graviditet [11, 17].
Antidepressiva läkemedels farmakokinetik vid graviditet
En sammanfattning av de vanligaste antidepressiva preparatens farmakokinetik vid graviditet kan ses i Tabell 1. De preparat som uppvisar störst förändring i serumkoncentrationer vid graviditet är fluoxetin och paroxetin.
Serummonitorering vid graviditet
Serummonitorering, therapeutic drug monitoring (TDM), används rutinmässigt för läkemedel med snäv och väldefinierad terapeutisk bredd (exempelvis litium) [18]. Något tydligt samband mellan serumkoncentrationer och klinisk respons av nyare antidepressiva läkemedel har inte kunnat fastställas på gruppnivå. Den intraindividuella variabiliteten är dock låg för dessa preparat [19, 20]. Detta har medfört en utveckling från populationsbaserade till individbaserade referenskoncentrationer, ibland benämnt »TDM 2.0« [18]. Kortfattat innebär detta att patienten blir sin egen referens: den serumkoncentration patienten har vid god symtomkontroll (remission) och minimala biverkningar blir målkoncentration, exempelvis vid återinsättning av läkemedlet efter en tids uppehåll [18].
Vid graviditet finns det flera aspekter som motiverar serummonitorering. Farmakokinetiska förändringar medför att koncentrationen av vissa läkemedel (exempelvis fluoxetin och paroxetin) drastiskt förändras, vilket kan leda till klinisk försämring för vissa patienter [21, 22]. I studien av Ververs et al sågs exempelvis ökade depressiva symtom för snabba (normala) metaboliserare (n = 43) i tredje trimestern, då serumkoncentrationer av paroxetin var 50 procent lägre än i tidig graviditet [22]. Andra skäl till serummonitorering under graviditet är bruk av interagerande läkemedel samt osäkerhet rörande följsamhet till ordination [18]. Ett serumprov före graviditeten kan användas som riktvärde för koncentrationsnivåer senare under graviditeten. Vi rekommenderar regelbunden mätning med 1–3 månaders intervall beroende på individuell risk för återinsjuknande. Högst risk föreligger vid tidigare långvariga eller recidiverande depressiva episoder, vilket motiverar kortare intervall mellan serumproven [23].
Framtiden
Kunskapen kring antidepressiva läkemedels farmakokinetik vid graviditet är begränsad. För de flesta preparat finns enbart ett fåtal små studier tillgängliga. När det gäller duloxetin, mirtazapin, amitriptylin och vortioxetin saknas studier helt. Med tanke på att antalet kvinnor i fertil ålder som tar antidepressiva läkemedel ökar, är det naturligt att informationsbehovet kring denna terapi vid graviditet också ökar. Fler farmakokinetiska studier kommer att spela en viktig roll för evidensbaserad optimering av medicinering till gravida i framtiden.
Läs även författarintervjun med Markus Svensson.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.