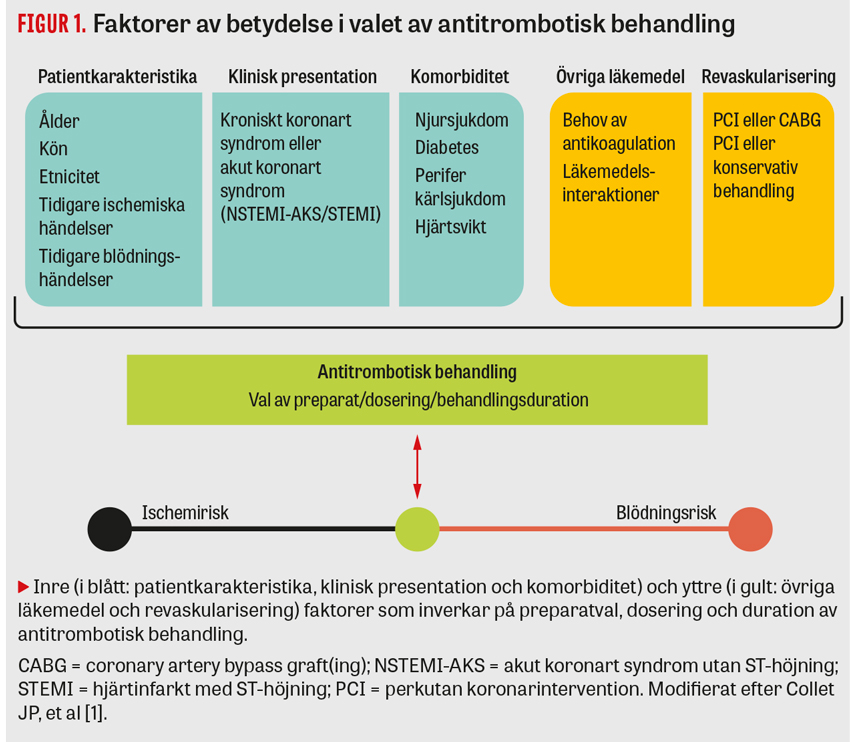
I nya riktlinjer från Europeiska kardiologföreningen gällande akut koronart syndrom utan ST-höjning framhålls vikten av att väga den ischemiska risken mot blödningsrisken vid val av behandlingsstrategi.
Rutinmässig förbehandling med P2Y12-hämmare för patienter som ska genomgå snar kranskärlsröntgen rekommenderas inte.
Kranskärlsröntgen inom 24 timmar förordas vid NSTEMI.
Nya områden rörande hjärtinfarkt utan kranskärlsförträngningar (MINOCA) samt spontan kranskärlsdissektion (SCAD) finns nu med i riktlinjerna, liksom ett avsnitt om kvalitetsindikatorer vid NSTEMI.
I september 2020 utkom nya riktlinjer från Europeiska kardiologföreningen (European Society of Cardiology, ESC) gällande akut koronart syndrom utan ST-höjning [1], vilket omfattar icke-ST-höjningsinfarkt (NSTEMI) samt instabil angina. Vikten av att väga den ischemiska risken mot blödningsrisken vid val av behandlingsstrategi lyfts fram (Figur 1). Riktlinjerna rekommenderar ett flertal olika läkemedel samt behandlingstider vid icke-ST-höjningsinfarkt, vilket möjliggör en mer individualiserad strategi.
Arbetsgruppen för kranskärlssjukdom i Svenska kardiologföreningen sammanfattar i denna artikel de nya riktlinjerna från ESC med syftet att referera de viktigaste nyheterna jämfört med tidigare riktlinjer. Värdering av riktlinjerna och ställningstagande till implementering måste göras baserat på förutsättningar i Sverige. Denna uppgift åligger på nationell nivå Socialstyrelsen och på regionnivå särskilda lokala expertgrupper som utfärdar utrednings- och behandlingsrekommendationer.
Diagnos, biomarkörer och riskstratifiering
Högkänsligt troponintest ska användas vid diagnostisering av akut koronart syndrom utan ST-höjning. Man rekommenderar i dag i huvudsak att ESC:s 0/1-timmes-algoritm ska användas för att snabbt bekräfta eller utesluta kardiell ischemi, men att ESC:s 0/2-timmes-algoritm är ett alternativ, förutsatt att en validerad metod för detta finns att tillgå.
Algoritmerna innebär att ett andra högkänsligt troponintest görs en (alternativt två) timmar efter ursprungsmätningen, förutsatt att debuten av bröstsmärta inträffar minst tre timmar före första troponinmätningen.
Den kliniska bedömningen är även fortsatt av största värde, då inte alla patienter med akut koronart syndrom utan ST-höjning har stegrade troponinnivåer.
Invasiv behandling
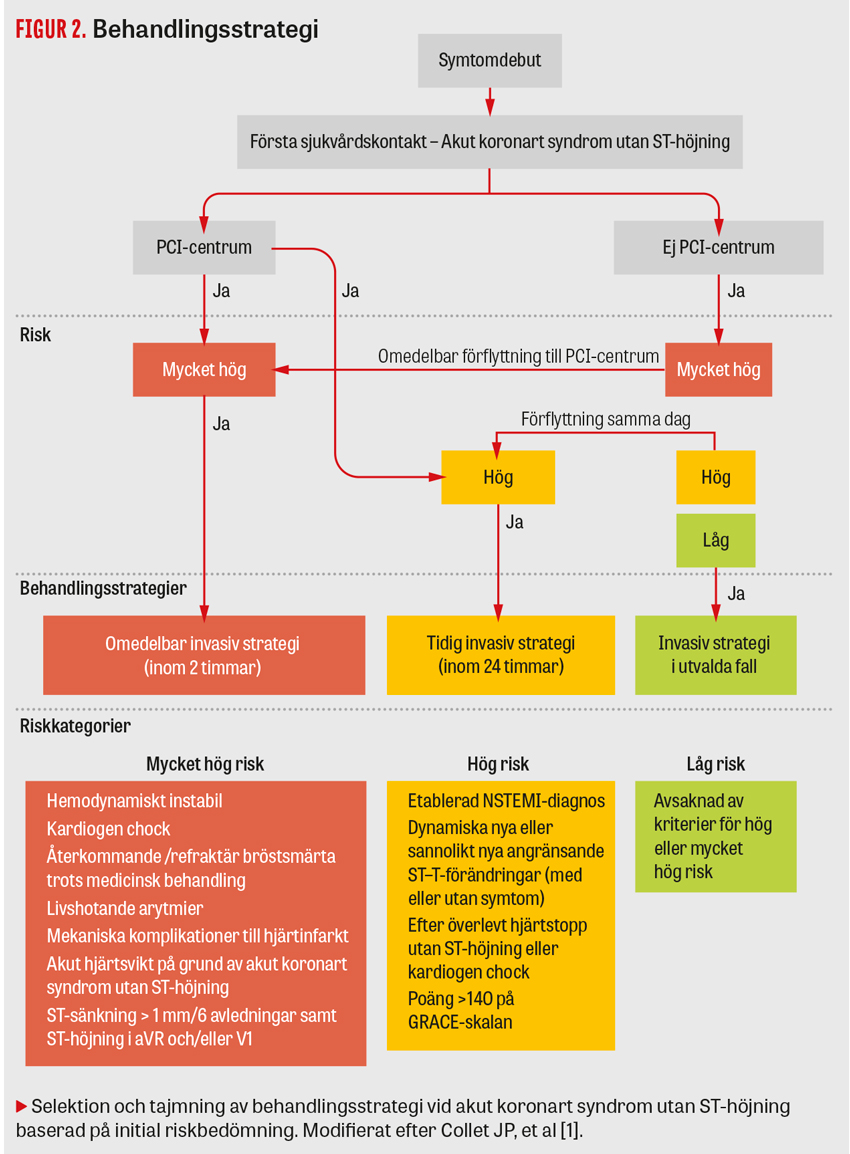
I de nya riktlinjerna har rekommendationen för tidig kranskärlsröntgen, inom 24 timmar från diagnos, förtydligats och gäller nu alla patienter med NSTEMI samt patienter med instabil angina med tecken på instabilitet på EKG eller hög risk vid riskstratifiering. Patienter med mycket hög risk bör flyttas omedelbart till PCI-centrum (Figur 2).
Hos patienter med misstänkt instabil angina med låg risk (ingen troponinstegring, återkommande bröstsmärta eller EKG-förändringar) rekommenderas en initial lämplig icke-invasiv ischemiutredning, till exempel stressekokardiografi, myokardskintigrafi eller DT av kranskärl inför värdering om behov av revaskularisering. Rekommendationen för diagnostiskt arbetsprov har nedgraderats på grund av den betydligt sämre diagnostiska säkerheten.
Efter överlevt hjärtstopp hos hemodynamiskt stabila patienter utan ST-höjningar på EKG bör man överväga att vänta med akut kranskärlsröntgen.
Antitrombotisk behandling
ESC rekommenderar fortsatt att majoriteten av patienter ges dubbel trombocythämmande behandling (DAPT), klopidogrel/tikagrelor/prasugrel och acetylsalisylsyra (ASA), under 12 månader efter NSTEMI. Man rekommenderar inte längre rutinmässig förbehandling med P2Y12-trombocythämmare i tillägg till ASA vid planerad tidig kranskärlsröntgen. Rekommendationen baseras på två randomiserade studier [2, 3] och en svensk observationell studie [4]. Vidare rekommenderas att man bör överväga prasugrel framför tikagrelor för patienter som genomgår PCI (perkutan koronarintervention). Detta baseras på ISAR-REACT 5-studien [3], som jämförde en prasugrelbaserad strategi mot en tikagrelorbaserad strategi hos patienter med STEMI respektive NSTEMI.
Då både ischemiska händelser och blödningskomplikationer är associerade med sämre prognos [5] betonas vikten av att väga den ischemiska risken mot blödningsrisken vid val av behandlingsstrategi (Figur 1). Utifrån individuell riskprofil finns möjlighet att skräddarsy antitrombotisk behandling avseende både intensitet och duration med målsättningen att maximera ischemiskt skydd till minsta kostnad i blödningsrisk. För patienter med hög ischemisk risk och låg blödningsrisk som tolererat 12 månaders dubbel trombocythämmande behandling bör förlängd behandling eller »dual pathway« med lågdos-rivaroxaban plus ASA övervägas. För patienter med måttlig risk kan förlängd behandling övervägas.
För patienter med hög blödningsrisk finns möjlighet att förkorta den dubbla trombocythämmande behandlingen till tre månader följt av monoterapi med P2Y12-hämmare eller de-eskalering till mindre potent P2Y12-hämmare.
Ett flertal riskskalor nämns: CRUSADE-skalan [6] för skattning av blödningsrisk under vårdtiden samt PRECISE-DAPT- [7] och DAPT-skalan [8] för skattning av blödningsrisk respektive ischemisk risk och blödningsrisk vid ett år för att vägleda vid dubbel trombocythämmande behandling. Flera av dessa riskskalor har dock begränsningar avseende generaliserbarhet, och ingen har testats prospektivt i en randomiserad studie, varför den kliniska nyttan ännu är oklar. Som ett alternativ till riskskalor framhålls också kriterier enligt Academic Research Consortium for High Bleeding Risk (ARC-HBR) [9].
För patienter med indikation för oral antikoagulation som strokeförebyggande behandling rekommenderas en kort period (upp till en vecka) trippelterapi, dubbel trombocythämmande behandling tillsammans med orala antikoagulantia (OAK), och därefter övergång till dubbelbehandling med klopidogrel/tikagrelor/prasugrel (företrädelsevis klopidogrel och direktverkande orala antikoagulantia, NOAK). För patienter med hög risk för ischemiska händelser kan potenta trombocythämmare, tikagrelor eller prasugrel, kombineras med NOAK. Efter 12 månader rekommenderas återgång till enbart OAK.
Nya områden i riktlinjerna
Hjärtinfarkt utan kranskärlsförträngningar (myocardial infarction with non-obstructive coronary artery disease, MINOCA) [10] (Fakta 1). MINOCA-patienterna är en heterogen grupp som inkluderar både kardiell och icke kardiell patologi. Patienterna uppfyller de diagnostiska kriterierna för icke-ST-höjningsinfarkt, men man hittar inga obstruktiva stenoser vid koronarangiografi. Dessa patienter är ofta yngre, oftare kvinnor och har som grupp lägre förekomst av kardiovaskulära riskfaktorer såsom diabetes, hypertoni och hyperlipidemi än gängse patient med obstruktiv kranskärlssjukdom.
MINOCA bör utredas med MR, och behandlingen ska inriktas mot den troligaste orsaken: kärlspasm, plackruptur och tromboembolism.
Den bakomliggande orsaken till MINOCA är fortsatt okänd men extensiv forskning inom området pågår.
Spontan kranskärlsdissektion (spontaneous coronary artery dissection, SCAD) [11, 12] (Fakta 1). Förekomsten av spontan kranskärlsdissektion är cirka 4 procent av alla akuta koronara syndrom men är högre hos yngre kvinnor. Den kliniska manifestationen är varierande, men vanligast är obehag i bröstet och troponinstegring. Spontan kranskärlsdissektion delas in i flera grupper angiografiskt som sträcker sig från total kranskärlsocklusion till ingen obstruktion alls.
Optimal behandling är oklar då randomiserade studier saknas. Konservativ behandling är att föredra, förutom vid total ocklusion då PCI alternativt kranskärlskirurgi (CABG) bör göras. Aggressiv antihypertensiv behandling bör övervägas med betablockad som förstahandsval. Patienter som genomgår PCI ska behandlas med dubbel trombocythämning enligt behandlingsregim vid akut koronart syndrom, men huruvida antitrombotisk behandling i övrigt är av nytta är omtvistat.
Kvalitetsindikatorer
ESC rekommenderar nu systematisk mätning och rapportering av kvalitetsindikatorer, vilket Sverige gjort under en längre tid via Swedehearts kvalitetsregister. För omhändertagande av patienter med NSTEMI föreslår ESC att flertalet markörer uppmäts och rapporteras inom följande områden: organisation, invasiv behandling, inneliggande omhändertagande, sekundärprofylaktisk behandling och patienternas välbefinnande.
Läs även Medicinsk kommentar:
Nya ESC-råd om hjärtinfarkt – behov av nationell uppdatering
Potentiella bindningar eller jävsförhållanden: Anna Holm har erhållit föreläsningsarvode från Bayer. Moa Simonsson har erhållit föreläsningsarvode från Astra Zeneca, Bayer och Pfizer.
Författarna representerar arbetsgruppen för kranskärlssjukdom i Svenska kardiologföreningen.
Fakta 1. Diagnoskriterier för hjärtinfarkt utan kranskärlsförträngningar (MINOCA) och spontan kranskärlsdissektion (SCAD)
Diagnoskriterier MINOCA
1. Hjärtinfarkt enligt fjärde universella definitionen [13].
2. Avsaknad av obstruktiv kranskärlssjukdom (definierat som avsaknad av förträngning ≥50 procent i större kranskärlen.
3. Avsaknad av annan specifik orsak till patientens aktuella sjukdomstillstånd, till exempel sepsis, lungemboli, takotsubo-syndrom och myokardit.
Diagnoskriterier SCAD
1. Icke-arteriosklerotisk, icke-traumatisk eller iatrogen separation av kranskärlets vägglager.
2. Skapar ett falskt lumen som kan leda till kranskärlskompression och ischemi.