Bröstcancer hos unga är ovanligt, men är den näst vanligaste dödsorsaken hos unga kvinnor.
Prognosen är sämre än hos medelålders kvinnor med en högre risk för lokalrecidiv, fjärrmetastaserande sjukdom och död i bröstcancer.
Sen diagnos och högre andel ogynnsamma tumörkarakteristika förklarar till en del de åldersrelaterade skillnaderna i prognos, men låg ålder i sig förefaller också vara en oberoende prognostisk faktor vid åtminstone bröstcancer av luminal B-subtyp.
Vid behandling av unga kvinnor med bröstcancer behövs särskild kompetens för att hantera de för åldersgruppen specifika frågeställningarna kring fertilitet, graviditet, sexualitet och hereditet.
Bröstcancer hos unga kvinnor (kvinnor <40 år vid diagnos) är generellt sett förenat med en sämre prognos, med en högre risk för lokalrecidiv, fjärrmetastaserande sjukdom och död i bröstcancer än för kvinnor med bröstcancer i övrigt. Även om de kirurgiska och onkologiska behandlingsalternativen är desamma som för medelålders kvinnor innebär i realiteten den högre andelen tumörer med ogynnsamma karakteristika att unga kvinnor i allmänhet får en mer aggressiv och multimodal behandling med kirurgi, kemoterapi, antikroppsbehandling, strålbehandling eller endokrin terapi; behandlingar vilka var och en kan ge signifikanta bieffekter och påverkan på livskvalitet. Unga kvinnor har många år att leva med biverkningar och komplikationer av behandlingen och med risken för ett återinsjuknande. För åldersgruppen finns också specifika frågeställningar kring fertilitet, sexualitet, graviditet och ärftlighet som gör bilden mer komplex för patienten, anhöriga och behandlande team.
Epidemiologi
Medianåldern vid bröstcancerdiagnos i Sverige är 63 år. Sjukdomen är ovanlig hos yngre kvinnor; år 2014 diagnostiserades 387 kvinnor före 40 års ålder, vilket bara utgör 4 procent av alla diagnostiserade [1]. Av all cancer som drabbar kvinnor under 40 års ålder utgör dock bröstcancer en fjärdedel [1] och är därtill den totalt sett näst vanligaste dödsorsaken för unga kvinnor [2]. För bröstcancer generellt ses en svag incidensökning om 1,6 procent per år under den senaste 20-årsperioden, men för unga kvinnor har incidensen i stort varit stabil, kring 20–23 fall per 100 000 kvinnor [1]. Under samma tidsperiod har mortaliteten i alla åldersgrupper successivt minskat i och med bättre behandling och tidigare diagnos.
Tumörbiologi och prognos
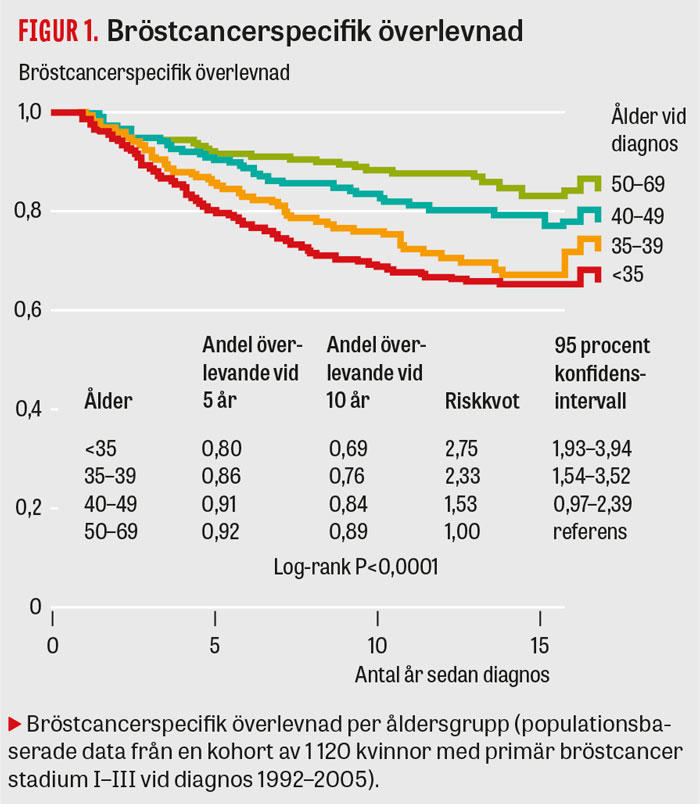
Unga kvinnor med bröstcancer har en sämre prognos än medelålders kvinnor [3-7] (Figur 1) med en högre risk för lokalrecidiv, fjärrmetastaserande sjukdom och död i bröstcancer. Den sämre prognosen kan delvis förklaras av diagnos i ett mer avancerat stadium, med större tumörer och i mer än hälften av fallen lymfkörtelmetastaser [4, 5, 8, 9]. Unga kvinnor har också en högre andel tumörer med ogynnsamma tumörkarakteristika. Dessa är oftare lågdifferentierade, hormonreceptornegativa, högproliferativa och HER2-positiva. Multifokalitet och lymfovaskulär invasion ses mer frekvent [4, 5, 8-12].
Med genexpression har man kunnat indela bröstcancer i olika molekylära subtyper [13], där subtyperna också i hög utsträckning har ett typiskt uttryck av biomarkörer vid immunhistokemisk analys (se Tabell 1). De subtyper som generellt är förknippade med en sämre prognos (trippelnegativ, HER2-positiv och luminal B) är vanligt förekommande hos unga kvinnor [5, 12, 14-16]. Huruvida stadium och tumörbiologi helt kan förklara den sämre prognosen för unga är omstritt, och därmed också om låg ålder i sig är en faktor att ta hänsyn till vid behandlingsbeslut [5, 10, 14-16]. I en nyligen publicerad stor svensk populationsbaserad studie med långtidsuppföljning fann vi att risken för fjärrmetastaserande sjukdom och död i bröstcancer, efter justering för stadium och tumörbiologi, var densamma för de unga kvinnorna som för medelålders kvinnor, men med en kvarstående överrisk för lokalrecidiv. Den prognostiska betydelsen av ålder förefaller dock skilja mellan de molekylära subtyperna.
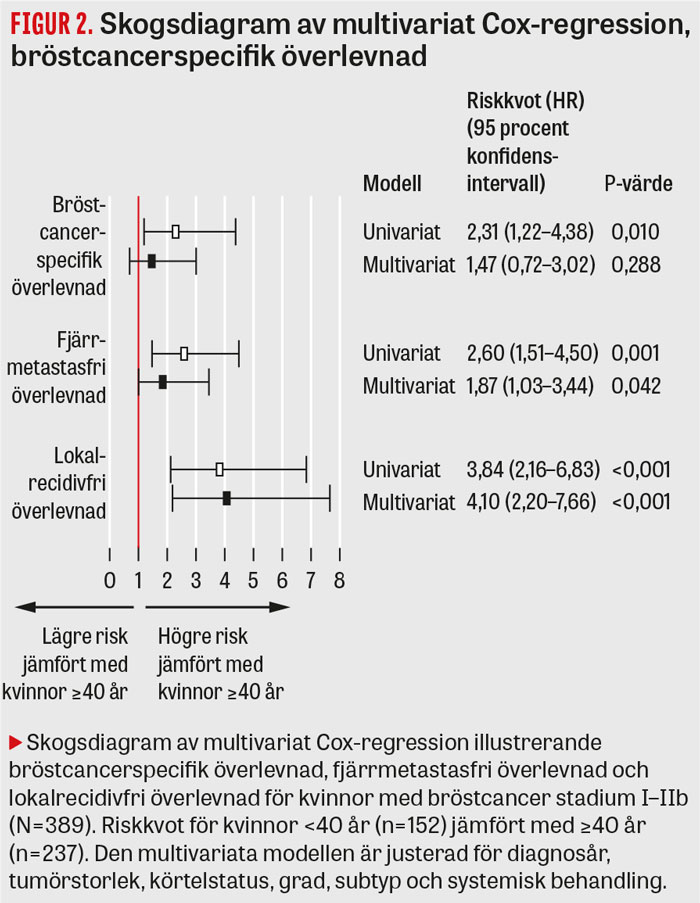
För unga kvinnor med luminala tumörer diagnostiserade i tidigt stadium (I–IIb) finns en mer än dubblerad risk för fjärrmetastaserande sjukdom och en fyra gånger ökad risk för lokalrecidiv jämfört med medelålders kvinnor med samma stadium och tumörbiologi, trots att yngre kvinnor får en mer intensiv behandling än medelålders kvinnor [5] (Figur 2). Skillnader i behandlingseffekt och åldersrelaterade skillnader i följsamhet till behandling kan inte uteslutas, men de prognostiska skillnaderna mellan åldersgrupper har också noterats i obehandlade patientmaterial [14, 17].
Vid studier av åldersrelaterade skillnader inom luminal B-subtypen finner man att yngre har signifikant lägre hormonreceptornivåer och högre Ki67 än äldre kvinnor, vilket skulle kunna förklaras av att yngres tumörer har sitt ursprung från mer primitiva luminala celler [12]. Således finns evidens för att låg ålder per se, åtminstone i subtyp luminal B, bör påverka beslutet om behandling.
Flera studier har visat att åldersskillnaderna i prognos förefaller minska över tid, men att de kvarstår även vid en modern behandling [16, 18]. Amerikanska SEER-data (Surveillance, Epidemiology, and End Results program) visar på successivt förbättrad prognos för unga men framför allt för de unga med luminala tumörer [18].
Diagnostik
Kvinnor under 40 års ålder omfattas inte av den mammografiska hälsokontrollen, varför den absoluta majoriteten av unga kvinnor med bröstcancer kommer till utredning på grund av symtom. I den unga populationen har mammografi en lägre sensitivitet beroende på högre brösttäthet, och bröstultraljud är ett viktigt komplement i diagnostiken [19]. Det finns ingen evidens för att tillägg av MR-undersökning i diagnostiken minskar risken för lokalrecidiv eller fjärrmetastasering [20].
Lokalrecidiv, kontralateral cancer och hereditet
Låg ålder är en oberoende riskfaktor för lokalrecidiv efter bröstbevarande kirurgi, men också för bröstkorgsrecidiv efter mastektomi [21, 22]. Med förbättrad diagnostik och behandling har risken för lokalrecidiv sjunkit över tid [23, 24] och ligger nu väl under 1 procent per år även för de yngsta kvinnorna [25]. Stora metaanalyser har visat att unga kvinnor inte har en bättre överlevnad vid mastektomi än vid bröstbevarande kirurgi [26-28], och bröstbevarande kirurgi bör således vara förstahandsvalet också för unga kvinnor [29].
För kvinnor som diagnostiserats med en bröstcancer brukar risken att få en kontralateral bröstcancer uppskattas till 0,5–0,6 procent per år [30, 31]. För unga kvinnor är risken högre de första 10 åren efter diagnos (0,8 procent per år), men sjunker sedan [31]. Risken är högre vid östrogenreceptornegativ bröstcancer (1 procent per år) än vid östrogenreceptorpositiv (0,4 procent per år), eftersom adjuvant endokrin behandling minskar risken för kontralateral sjukdom [32].
Hos kvinnor med bröstcancer diagnostiserad före 40 års ålder är risken för att ha en bakomliggande mutation i BRCA1/2 cirka 10 procent [33, 34], det vill säga tio gånger högre än bland kvinnor med bröstcancer i allmänhet [35]. Hos unga med trippelnegativa tumörer är risken att vara mutationsbärare än högre, 22 procent vid diagnos före 35 års ålder, och 20 procent i subgruppen unga som helt saknar familjehistoria [36]. Eftersom fynd av bakomliggande mutation kan påverka den behandling som patienten erbjuds, både kirurgiskt och onkologiskt, liksom uppföljningsrutiner, bör alla unga kvinnor som diagnostiseras med bröstcancer erbjudas en snabb onkogenetisk utredning redan tidigt i förloppet [34].
Mutationsbärare med bröstcancer har inte sämre överlevnad än kvinnor med sporadisk bröstcancer och inte heller en högre risk för lokalt återfall. Däremot är risken för kontralateral bröstcancer förhöjd. Unga patienter (<35 år) med bröstcancer med BRCA1/2-mutation har en årlig risk för kontralateral bröstcancer på 3 procent [37].
Psykosociala aspekter
Att drabbas av cancer påverkar livssituationen fysiskt, psykiskt, socialt och existentiellt. Unga kvinnor med bröstcancer har i upprepade studier visat sig ha en sämre hälsorelaterad livskvalitet efter diagnos än medelålders och äldre kvinnor, och nedsättningen varar längre innan den återgår till normal nivå [38, 39]. Livskvaliteten är också sämre än vid andra typer av cancer [40], vilket skulle kunna förklaras av bröstcancerbehandlingen som kan ge försämrad kroppsuppfattning, nedsatt sexuell funktion och klimakteriebesvär. Kvinnor med småbarn och kvinnor med tidigare psykisk ohälsa har mer nedsatt livskvalitet [40]. Utefter sina speciella förutsättningar bör unga kvinnor erbjudas ett gott psykosocialt stöd.
Graviditetsrelaterad bröstcancer
Var fjärde bröstcancer före 35 års ålder och var tionde före 40 års ålder diagnostiseras under graviditet eller inom 1–2 år efter förlossning [41, 42]. Bröstcancer är (efter melanom) den näst vanligaste cancerformen under graviditet och den vanligaste cancerformen under det första året post partum. Incidensen av graviditetsrelaterad bröstcancer ökar, vilket kan förklaras av att barnafödande successivt förläggs till allt högre ålder. Jämfört med andra unga kvinnor med bröstcancer har kvinnor med graviditetsrelaterad bröstcancer tumörer i mer avancerat stadium och med mer ogynnsamma karakteristika. Prognosen är dock densamma som för icke-gravida kvinnor med samma ålder, stadium och tumörbiologi [43].
Bröstdiagnostik i samband med graviditet och amning är svår på grund av hög brösttäthet och kraftig epitelcellsproliferation (och tätheten kvarstår upp till 5 månader efter avslutad amning). Ultraljud är förstahandsundersökning vid knöldiagnostik, men vid malignitetsmisstanke innebär tillägg av mammografi ingen som helst risk för fostret. På grund av den ökade proliferationen och den ökade mängden blod- och lymfkärl kan cytologi vara svårbedömd, och mellannålsbiopsi ger en högre diagnostisk säkerhet.
Behandlingen ska i mesta möjliga mån likna den som unga icke-gravida får, det vill säga vara baserad på ålder och tumörbiologi, men med hänsyn till graviditetsvecka. Avbrytande av graviditet behöver mycket sällan diskuteras och ger inte modern någon överlevnadsvinst. Prematur förlossning, det vill säga före vecka 37, ska undvikas. Bröstbevarande kirurgi görs på samma indikationer som vanligt, och vid portvaktskörtelbiopsi kan isotop användas som vanligt (dock bör man på grund av den förhållandevis höga risken för anafylaxi undvika blåfärg). Vid mastektomi är direktrekonstruktion med expanderimplantat inte rutin, men ej heller kontraindicerad eftersom den endast marginellt ökar operationstid och risk för komplikationer [44]. Kemoterapi kan ges under 2:a och 3:e trimestern utan bestående risk för fostret [45]. Det finns en god evidens för säker behandling med antracyklinbaserade regimer och att barn utsatta för antracyklinbaserad kemoterapi in utero utvecklas normalt [46, 47]. Successivt kommer också allt mer evidens rörande säker användning av taxaner under graviditet [48]. Strålbehandling, endokrin terapi och antikroppsbehandling kan ges först efter förlossning [48].
Fertilitetsbevarande åtgärder
Kemoterapiinducerad menopaus är vanlig (22–61 procent för kvinnor <40 års ålder) och ökar med stigande ålder. Andelen som blir infertila beror också av typ av cytostatika. Patienterna måste tidigt i förloppet informeras om risken för infertilitet och om möjligheter till fertilitetsbevarande åtgärder. Kvinnor <40 års ålder som så önskar bör remitteras till fertilitetsenhet för rådgivning och ställningstagande till åtgärd. Frysning av embryon efter IVF eller frysning av ägg (för kvinnor som saknar partner) fordrar 10–14 dagars hormonstimulering, där stimuleringen vid bröstcancer görs med tamoxifen och aromatashämmare [49]. Där tid inte finns för hormonstimulering kan äggstocksvävnad tas ut via laparaskopi för frysning. Äggstockvävnaden kan efter avslutad cancerbehandling återtransplanteras [50]. De olika metoderna är ännu inte likvärdiga vad gäller »baby take home rate« (sannolikheten att föda minst ett levande barn). Chansen att få barn efter frysning av embryon eller ägg är i dag på ungefär på̊ samma nivå [49].
Graviditet efter bröstcancer
Graviditet efter genomgången bröstcancerbehandling påverkar inte prognosen negativt. I flera stora metaanalyser har graviditet snarast varit förenad med en minskad risk för död i bröstcancer, även om man försökt kompensera för en »healthy mother effect« [51-53]. Det finns ingen fastlagd »lämplig« tidpunkt för graviditet, utan här måste en individuell bedömning göras på basen av tumörbiologi, typ av behandling och behandlingsduration kontra patientens ålder [54].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Läs också författarintervjun med Irma Fredriksson