Bröstbevarande kirurgi med postoperativ radioterapi är lika säker som mastektomi vid primär bröstcancerbehandling.
Bröstbevarande kirurgi är tillämplig i minst 70 procent av fallen med nydiagnostiserad bröstcancer.
Neoadjuvant behandling och onkoplastikmetoder kan öka andelen där bröstbevarande kirurgi är möjlig.
Biopsi av portvaktskörteln (sentinel node) är en säker metod för att stadieindela axillen.
Biopsi av portvaktskörteln räcker som enda ingrepp i axillen vid negativ biopsi och vid förekomst av mikrometastaser.
Evidensen för att överge axillutrymning vid makrometastaser i axillen är ännu otillräcklig.
Biopsi av portvaktskörteln innebär lägre risk för armbesvär jämfört med axillutrymning.
Kirurgi har under mer än ett sekel varit etablerad förstahandsbehandling vid bröstcancer, men beskrivningar av kirurgiska bröstingrepp finns ända från de forntida egyptiernas tid. Det var dock först med introduktionen av aseptik och anestesi som kirurgin kunde utvecklas. William Halsted anses vara bröstkirurgins fader, och han beskrev resultaten av mastektomi vid Johns Hopkins sjukhus mellan 1889 och 1894 [1]. Denna radikala kirurgi, som innebar borttagande av hela bröstet med underliggande muskulatur och lymfkörtlar högt upp i axillen, var dominerande under hela första hälften av 1900-talet. Inte förrän David Patey 1948 beskrev en modifierad metod där den stora bröstmuskeln bevarades skedde en förändring av rutinerna [2]. Så småningom introducerades bröstbevarande ingrepp, och dessa vann gehör i Sverige från början av 1980-talet. Bröstbevarande ingrepp med efterföljande radioterapi mot kvarvarande bröstvävnad är i dag rutiningrepp för majoriteten av bröstcancerpatienter i Sverige. Fortfarande finns indikation för mastektomi vid multifokal invasiv bröstcancer eller utbredd cancer in situ. Överlevnaden vid bröstbevarande kirurgi har i stora randomiserade studier med långtidsuppföljning visat sig likvärdig med den efter mastektomi [3–5]. Radioterapi ges i princip alltid vid bröstbevarande kirurgi – att avstå innebär en ökad risk för lokala återfall i bröstet och på lång sikt sämre överlevnad. Man har beräknat att genom att förhindra fyra återfall kan ett dödsfall förebyggas [6].
Någon övre storleksgräns för när bröstbevarande kirurgi är möjlig finns egentligen inte men de flesta studier har endast inkluderat tumörer under 4 cm. Tack vare att den kirurgiska tekniken har förfinats kan allt fler större tumörer bli föremål för bröstbevarande ingrepp. Man kan med hjälp av plastikkirurgiska metoder göra omfattande förflyttningar av parenkym och därmed täcka stora substansdefekter (se artikel om onkoplastikkirurgi i detta temanummer). Man kan också med så kallad neoadjuvant behandling, där kemoterapi ges före kirurgi, krympa tumören och på så sätt möjliggöra bröstbevarande ingrepp på tumörer som primärt ansetts för stora. Man såg i tidiga studier en något ökad andel lokala recidiv efter bröstbevarande ingrepp som gjorts efter neoadjuvant behandling. Men med effektivare behandling, som ger fler kompletta remissioner, är resultaten likvärdiga och överlevnaden har inte påverkats [7, 8].
Kirurgisk marginal har varit föremål för omfattande debatt. Svårighet att säkert fastställa marginalen i tre dimensioner på tvådimensionella histologiska snitt har bidragit till oklarheten. I dag har en ganska pragmatisk lösning anammats som innebär att om patologen inte hittar tumörceller i den färgmarkerade resektionsranden (tumor on ink) betraktas operationen som radikal [9]. En större marginal minskar inte recidivrisken. Det är dock viktigt att det inte finns tumörceller i resektionsranden då varken tilläggsbehandling med strålning (radiation boost) eller kemoterapi påverkar risken för lokala återfall om operationen inte är radikal [9].
Med nuvarande indikationer kan över 70 procent av alla patienter med nydiagnostiserad bröstcancer erbjudas bröstbevarande kirurgi. Det finns dock till synes omotiverat stora skillnader mellan olika sjukhus i Sverige (29–93 procent för unifokala tumörer under 3 cm) [10]. En del av skillnaderna betingas av att vissa sjukhus endast opererar selekterade patienter, men även bland sjukhus med till synes likartat patientunderlag finns stora skillnader.
Axillkirurgins utveckling
Axillkirurgi ingår som en viktig del i den primära kirurgiska behandlingen av bröstcancer. I slutet av 1800-talet, då förbättrade anestesiologiska metoder möjliggjorde större operationer, var syftet med axillkirurgin i huvudsak terapeutiskt. Tumörerna var ofta stora med massiv lymfkörtelspridning redan vid diagnos, och kirurgin syftade till att avlägsna all cancer. Det innebar att man opererade bort hela bröstet och underliggande muskulatur samt avlägsnade alla lymfkörtlar i axillen, den så kallade Halsteds radikala mastektomi [1]. Även vid Pateys modifierade mastektomi utrymdes axillen i sin helhet [2]. I början av 1980-talet utvecklades den bröstbevarande kirurgin, men fortfarande dominerade axillutrymning.
Axillutrymning kan orsaka en rad biverkningar som lymfödem, smärta, försämrad rörelse i axelleden och känselnedsättning [11] – symtom som i sin tur kan leda till försämrad livskvalitet och påverka möjligheten att utföra vanliga sysslor i hemmet och på arbetet negativt [12]. Lymfödemet kan komma många år efter operationen, och i dag finns oftast ingen botande behandling. Målet för behandlingen är att minska lymfödemets volym och patientens känsla av tyngd och spänning i vävnaden. Incidensen av lymfödem efter axillkirurgi varierar i litteraturen. Äldre studier visar att upp mot 50 procent av alla kvinnor som genomgått axillutrymning upplever en armsvullnad 20 år efter operation [13]. Senare multicenterstudier från Sverige visar att ca 15–20 procent av alla kvinnor som genomgått axillutrymning utvecklar lymfödem, där kvinnor med lymfkörtelmetastaser som även erhållit strålbehandling mot axillen har högst incidens [14, 15]. Mot bakgrund av den höga biverkningsfrekvensen efter axillkirurgi introducerades provtagning där 4 till 5 körtlar mer eller mindre på måfå avlägsnades från nedre delen av axillen. Randomiserade studier visade jämförbar överlevnad men fler lokalrecidiv jämfört med axillutrymning [16, 17]. Denna »enklare« teknik medförde att regionala recidiv, fjärrmetastaser och bröstcancerdöd ökade hos körtelnegativa patienter när få lymfkörtlar undersökts [18, 19]. Samtidigt ökar biverkningarna av kirurgi ju fler lymfkörtlar som tas bort. Det gällde att hitta en balans mellan att få god information om lymfkörtelstatus för att kunna ge rätt efterbehandling och att minimera biverkningarna. Mot denna bakgrund utvecklades tekniken för biopsi av portvaktskörteln (sentinel node-biopsi, SNB).
Biopsi av portvaktskörteln
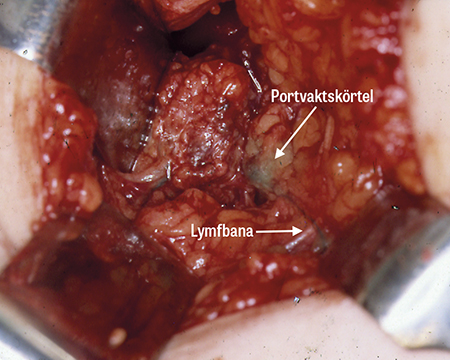
Portvaktskörteln är den första lymfkörteln dit lymfan från ett tumörområde dräneras. En spridning av cancerceller sker oftast först till denna körtel. Är den fri från tumörceller är i allmänhet även övriga lymfkörtlar i armhålan det. Identifikation av portvaktskörteln sker med en kombination av isotop (99Tc-nanokolloid) och blå färg (Patent blue, Guerbet) som injiceras intill tumören. Exakt hur injektionen görs varierar mellan intratumoralt, peritumoralt, subkutant, intrakutant och subareolärt. Samtliga tekniker har sina förespråkare och alla fungerar. Vid ytlig injektion sker spridningen i lymfbanorna snabbare, medan djup injektion påvisar fler körtlar belägna utanför axillen [20, 21]. Dessa kan påvisas med hjälp av preoperativ skintigrafi. Detta utförs dock inte i klinisk rutin då nödvändigheten av att hitta körtlar utanför axillen har ifrågasatts. Det är sällsynt att dessa är metastatiska utan att det finns metastaser även i axillen, och kirurgiskt borttagande av parasternala körtlar har vid långtidsuppföljning inte visats påverka överlevnad [22]. En metaanalys har visat positiv effekt på sjukdomsfri och total överlevnad av strålbehandling mot parasternala körtlar [23]. Med en handhållen gammaprob kan portvaktskörteln påvisas i axillen, och visuellt ser man den oftast som klart blåfärgad. I majoriteten av fallen finns mer än en portvaktskörtel (i genomsnitt 2) beroende på parallella lymfbanor. Portvaktskörteln tas ut och skickas för histologisk undersökning. Tidigare utfördes snabbundersökning med fryssnitt under operation för att fortsätta operationen med axillutrymning i samma seans om portvaktskörteln var metastatisk. Allt mer har dock behovet av axillutrymning börjat ifrågasättas vid positiv biopsi av portvaktskörteln, vilket har gjort att behovet av fryssnitt också minskat. På många kliniker i Sverige avstår man i dag från fryssnitt.
Nyligen har en ny metod som bygger på superparamagnetisk järnoxid (SPIO) introducerats. Substansen injiceras på samma sätt som isotop och blå färg. Detektorn sänder ut magnetiska signaler som reflekteras mot järnpartiklarna och kan mätas. Fördelen är att man slipper hantering av radioaktivt material och endast behöver injicera en substans, men det krävs att man använder plastinstrument under dissektionen i axillen eftersom metalliska instrument ger störningar av den magnetiska signalen.
Med erfarenhet identifieras en portvaktskörtel i 97 till 98 procent av fallen, både vid användande av isotop och färg och med SPIO [24].
Metodens tillförlitlighet
Biopsi av portvaktskörteln är en metod behäftad med viss osäkerhet. Falskt negativ biopsi, det vill säga att portvaktskörteln är frisk medan någon annan körtel innehåller metastaser, förekom i tidiga studier i 5 till 7 procent av fallen. Dessa siffror är i dag sannolikt lägre med erfarna utförare [25]. Biopsi av portvaktskörteln kan användas vid all invasiv bröstcancer utom vid T4-tumörer (hudgenombrott) eller vid palpabla verifierade körtelmetastaser. Vid neoadjuvant behandling, där kemoterapi ges före kirurgi, bör biopsi av portvaktskörteln utföras vid kliniskt negativ axill före start av medicinsk behandling. En svensk, ännu inte publicerad studie har visat på 7 procent falskt negativa fynd [opubl data; 2016].
Användning av biopsi av portvaktskörteln efter genomgången neoadjuvant behandling har varit föremål för en livlig debatt. En tysk studie [26] och en nyligen publicerad metaanalys visade att detektionsgraden var lägre och andelen falskt negativa fynd högre [27]. En amerikansk studie fann högre andel falskt negativa fynd (> 10 procent) än den säkerhetsnivå som satts för studien [28]. Å andra sidan har en italiensk studie med 5 års uppföljning av patienter som konverterat från positiv till negativ lymkörtel efter neoadjuvant behandling visat utmärkta överlevnadssiffror [29].
Patienter med icke-invasiv bröstcancer bör inte genomgå biopsi av portvaktskörteln, utom om det rör sig om en utbredd tumör av grad 3 där mastektomi planeras. Orsaken till detta är att även biopsi av portvaktskörteln är förenad med viss morbiditet. Dock talar moderna studier för att risken att utveckla lymfödem efter biopsin är mycket liten [14, 15].
Handläggning av axillen efter biopsi
Portvaktskörteln undersöks noggrant av patologen och eventuell metastasering beskrivs enligt följande:
- pN0 – inga metastatiska celler observerade,
- pN0(i+) – isolerade tumörceller,
- pN1(mi) – mikrometastas 0,2–2 mm,
- pN1 – makrometastas >2 mm.
Övertygande data talar för att ingen axillutrymning behövs om inga eller endast isolerade tumörceller observeras [30, 31]. Övrig efterbehandling baseras på tumörens egenskaper enligt vårdprogram. Senare studier har visat att prognosen för patienter med mikrometastaser liknar den för dem med makrometastaser [32] och är indikation för adjuvant kemoterapi.
Data pekar på att axillutrymning inte påverkar överlevnaden [33], varför rekommendationen i dag är att endast göra biopsi av portvaktskörteln vid förekomst av mikrometastaser. Vid begränsat fynd av makrometastaser har en amerikansk randomiserad studie visat mycket goda resultat även när axillen inte utrymts [34]. Denna studie har dock kritiserats för att man inte lyckades nå målet för inklusion, för att inkluderade patienter var starkt selekterade och för att styrkan var alltför låg. I dag genomförs en internationell randomiserad studie (SENOMAC), som leds från Sverige, där patienter med 1–2 metastaser i portvaktskörteln lottas till axillutrymning eller ingen axillutrymning. Studien ska inkludera 3 700 patienter under 6–7 års tid och svara på frågan om enbart biopsi av portvaktskörteln räcker som kirurgisk behandling även vid makrometastaser i axillen. För patienter med fler än 2 makrometastaser är det fortfarande alternativet axillutrymning som gäller.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2021-08-25)






















