Psoriasis är en inflammatorisk hudsjukdom med betydande samsjuklighet, t ex psoriasisartrit och metabola syndromet (hypertoni, hyperlipidemi, obesitas och diabetes ). Trots avsevärd påverkan på livskvalitet visar aktuell forskning att psoriasis är underdiagnostiserad och underbehandlad.
Beslut gällande psoriasisbehandling inom primärvården bör baseras på bedömning av sjukdomens svårighetsgrad, förekomst av samsjuklighet, behov att remittera patienten till hudläkare och, där det är möjligt, identifiering och eliminering av faktorer som försämrar sjukdomen.
Genom förändring av livsstil (hälsosam kost, fysisk aktivitet, rökstopp och avhållsamhet från alkohol) kan vi verka preventivt mot psoriasis och dess samsjuklighet men också potentiera effekten av medicinska behandlingar.
Behandling av psoriasis har varierat genom tiderna, och tidigare har psoriasis betraktats huvudsakligen som en kosmetisk hudsjukdom. Beslut om behandling har därför ofta överlämnats till patienten. Bristande kunskap om sjukdomens natur, patogenes och den systemiska inflammation som inte bara drabbar huden har ofta medfört underbehandling.
Traditionell behandling av psoriasis har mestadels varit empirisk, t ex svavel, tjära, arsenik, salicylsyra, röntgen, antralin, UV-ljus, psoralener, topikala och systemiska kortikosteroider och senare metotrexat, retinoider, ciklosporin och kalcipotriol. Även om dessa behandlingar ofta erbjudit god hjälp åt många patienter, har behandlingseffekt och antipsoriatisk aktivitet varit bristfällig.
Det senaste decenniet har erbjudit en dramatisk utveckling av nya biologiska läkemedel som genom att hämma specifika cellulära interaktioner och cytokiner erbjuder potent och mer sjukdomsspecifik behandling. Denna utveckling har gått hand i hand med ökad molekylär kunskap om psoriasissjukdomen.
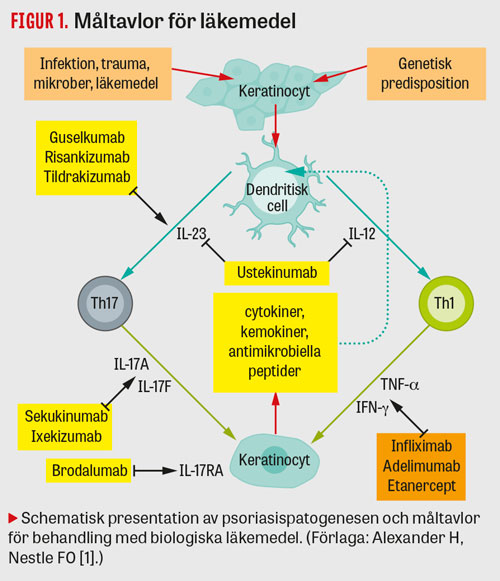
För att förstå effekt och potential av nya (mestadels biologiska) läkemedel måste man förstå den inflammatoriska kaskaden vid psoriasis, där interleukin (IL)-23/
IL-17-axeln i dag anses avgörande. Den förhärskande modellen är att triggerfaktorer (såsom infektion, trauma etc) i kombination med genetisk predisposition aktiverar dendritiska celler som producerar nyckelcytokiner såsom Il-12 och IL-23, vilka i sin tur aktiverar T-hjälparlymfocyter (Th17, Th1, Th22). Th17-celler producerar IL-17A och IL-17F, medan Th1-celler producerar TNF (tumörnekrosfaktor)-α och IFN (interferon)-γ. Dessa cytokiner har proinflammatorisk effekt i huden och leder till hyperproliferation av keratinocyter [1] (Figur 1).
Även om detta är en förenklad modell och mycket återstår att upptäcka visar den imponerande effekten av läkemedel som blockerar just dessa signalvägar att modellen är relevant vid psoriasis.
Ingen bot, men många effektiva behandlingar
I dag finns ett flertal läkemedel för behandling av psoriasis. Detta gäller framför allt systemisk behandling, medan valmöjligheten vid lokalbehandling är begränsad. Avgörande för val av behandling är sjukdomens form och svårighetsgrad, samsjuklighet, patientens preferens (inklusive kostnad och bekvämlighet) och effekten av redan prövad behandling.
Flertalet patienter söker initialt bedömning inom primärvården, och primärvårdsläkare kan ställa diagnos och inleda behandling [2]. Detta gäller med ett viktigt undantag (se artikel om psoriasis hos barn i detta tema): vid misstanke om psoriasis hos barn bör dermatolog alltid konsulteras, eftersom diagnosen kan vara knepig. Det tål att betonas att de flesta patienter med psoriasis har lindrig sjukdom; uppskattningsvis är endast 20–30 procent i behov av systemisk behandling.
Trots att det i dag inte finns någon bot finns det många effektiva behandlingar. Psoriasis är oftast en kronisk sjukdom med stor påverkan på många aspekter av patientens liv, och sjukdomen kräver ofta långvarig behandling [3]. Recidiv av psoriasis efter behandlingsuppehåll är vanligt, vilket understryker vikten av kontinuerlig behandling och uppföljning av patienter. Därför är fungerande kommunikation mellan patient och läkare nyckeln till lyckad och framgångsrik behandling.
Psoriasis är underdiagnostiserad och underbehandlad
Psoriasis är en inflammatorisk sjukdom som anses underdiagnostiserad och underbehandlad (särskilt psoriasisartrit) trots att sjukdomen har betydlig påverkan på livskvaliteten [4]. Detta understryker betydelsen av bättre förståelse av sjukdomen och bättre användning av tillgängliga behandlingsmöjligheter för att försäkra optimal behandling.
En studie i USA omfattande 1 667 patienter med måttlig till svår psoriasis visade att nästan 40 procent inte fått behandling i tid, endast 25 procent av dem med svår psoriasis fick systemisk behandling och/eller i kombination med ljusbehandling och 35 procent fick enbart lokal behandling [4].
Aktuell litteratur talar för att snabb behandling av en inflammatorisk process leder till bättre funktion och eventuell bättre långsiktig prognos [5, 6].
Bedömning av svårighetsgraden
För bedömning av svårighetsgraden av psoriasis används inom specialistvården olika skattningsinstrument såsom
- PASI (Psoriasis area and severity index) [7]
- BSA (Body surface area) [8]
- PGA (Physician global assessment)
- DLQI (Dermatology life quality index) [9].
PASI är det mest använda verktyget som baseras på en bedömning av lesionernas utbredning och svårighetsgrad (skala 0–72). PASI 75, PASI 90 och PASI 50 används för att beskriva procentuell förbättring av psoriasis efter insatt behandling, t ex innebär PASI 75 en förbättring på 75 procent.
Historiskt sett har PASI 75 varit ett riktvärde för acceptabel behandlingseffekt inom kliniska prövningar, och detta har sedan anpassats som målvärde vid utarbetande av behandlingsriktlinjer [10]. För att bedöma behandlingseffekt i klinisk praxis är detta ett opraktiskt mått, och ett lågt absolut PASI (<3) är sannolikt ett bättre mått på framgångsrik behandling [11].
PGA baseras på en bedömning av rodnad, fjällning och induration på en skala 0–4, där 0 innebär ingen sjukdom och 4 svår psoriasis.
BSA anger hur många procent av hudytan som är täckt med psoriasis (patientens handflata med fingrar motsvarar drygt 1 procent).
DLQI skattar hur mycket hudbesvären har påverkat patientens liv (skala 0–30), där <5 indikerar liten påverkan medan >20 visar extremt stor sjukdomspåverkan på patientens livskvalitet.
Med hjälp av dessa instrument brukar psoriasis definieras som
- lindrig: PASI <3, PGA <2, BSA <3, DLQI ≤5
- måttlig: PASI 4–10, PGA = 3, BSA 3–10, DLQI 6–10
- svår: PASI >10, PGA = 4, BSA >10, DLQI >10.
Väldefinierade behandlingsmål bör sättas
För att optimera vården av psoriasis är det viktigt med ett väldefinierat behandlingsmål. De viktigaste målen med behandlingen är att uppnå optimal sjukdomskontroll och förbättring (PASI <3) och därmed positivt påverka andra samtidiga sjukdomar (t ex minska risken för kardiovaskulära händelser [12-15]), få bättre livskvalitet (DLQI <5), förbättra patientnöjdheten och integrera patienters och läkares perspektiv på sjukdomen och behandlingen. Därför är det viktigt att sätta upp mål och plan gemensamt med patienten; både medicinska mål och livsstilsmål ska inkluderas. Behandlingsmålen bör inte vara statiska utan ska utvecklas med sjukdomen och behandlingar.
Patientens perspektiv på PASI – värde av helt läkt hud
Enligt tidigare behandlingsrekommendationer har man ansett att behandlingen var effektiv om man uppnått en förbättring av PASI med minst 75 procent (PASI 75) [10]. I takt med utvecklingen av mer effektiva läkemedel under de senaste åren pågår en debatt om huruvida total eller nästan total utläkning bör eftersträvas [16]. Detta har tidigare inte varit möjligt, varför kliniska prövningar inte varit utformade för att mäta detta [17].
Finns det ett medicinskt pris för total utläkning? Man måste komma ihåg att biologiska läkemedel i princip innebär en påverkan på immunsystemet och att det finns potentiella risker, framför allt vad gäller risk för infektioner. Det är en balansgång, och varje patient måste bedömas individuellt. Samtidigt sker en noggrann uppföljning av dessa läkemedel, och aktuella data talar för att behandlingen har god säkerhet med noggrann övervakning.
I en ny studie har man undersökt patienters tolerans för risker associerade till behandling som strävar mot total/nästan total utläkning. Studien visade att 72 procent av patienterna kunde tänka sig att acceptera högre risker med behandling som helt kan läka huden, särskilt om man hade ansiktspsoriasis. Majoriteten av patienter värderade således högre att bli av med små fläckar och plack än att undvika behandlingsrelaterade risker.
Den dokumenterade vikten av helt läkt hud jämfört med nästan läkt hud var mycket starkare än vi tidigare känt till [18]. Därför är patientens perspektiv oerhört viktigt för beslut om behandling, samtidigt som vår roll som läkare är att integrera patientens önskan med realistiska risker.
Trappstegsmodellen har använts historiskt
Historiskt sett har den s k trappstegsmodellen använts för behandling av psoriasis, där utvärtes behandling och egenvård erbjudits som första steget i trappan. Lokaliserad sjukdom behandlas med topikal behandling, som omfattar mjukgörande kräm innehållande karbamid, propylenglykol och salicylsyra för avfjällning, kortikosteroider, vitamin D-preparat (kalcipotriol) ensamt eller i kombination med kortikosteroid och takrolimus (en kalcineurinhämmare). Topikal behandling är standardbehandling för lindrig psoriasis. Mjukgörande kräm och egenvård ingår i all behandling av psoriasis.
Vid otillräcklig effekt av topikal behandling eller vid utbredd sjukdom trappas behandlingen upp till ljusbehandling med ultraviolett ljus B (UVB), s k smalspektrum-UVB (311–312 nm) eller PUVA (psoralen plus UVA (320–400 nm). Ljusbehandling kan ges som monoterapi eller i kombination med annan topikal eller systemisk behandling.
Klimatvård och historia av ljusbehandling
Det är känt sedan flera tusen år att solljus (helioterapi) kan ha läkande effekt på en rad hudsjukdomar inklusive psoriasis, men bakomliggande mekanismer som kan förklara biologiska effekter av UV-ljus har systematiskt undersökts först under de senaste decennierna. I början av 1900-talet användes kolbågslampa, kvicksilverlampa och naturlig sol i kombination med tjära, s k Goeckerman-regim. Sedan utvecklades PUVA och smalspektrum-UVB.
Klimatvård innebär en rehabiliteringsresa som omfattar kontrollerad solning, undervisning om psoriasis och relaterade sjukdomar, kosthållning, fysisk aktivitet, egenvård och livsstil samt utbyte av erfarenheter med andra patienter. En behandlingsperiod omfattande 3 veckor erbjuds på Kanarieöarna och bekostas av landstinget. Hudläkare kan remittera patienter som anses lämpliga för denna behandlingsform. Beslut om detta fattas dock av uttagningsläkare utifrån prioriteringsreglerna.
Systemisk behandling vid medelsvår till svår sjukdom
Vid medelsvår och svår psoriasis, när topikal behandling och ljusbehandling inte har tillräcklig effekt eller av olika skäl är svår att genomföra, kan behandling med en rad olika systemiska läkemedel erbjudas. Dessa patienter bör remitteras till specialist för bedömning och val av behandling.
Flera preparat för konventionell systemisk behandling
Konventionell systemisk behandling omfattar de tidigt utvecklade systemiska läkemedlen där metotrexat introducerades först (1958), därefter ciklosporin (1990) och acitretin (1992). Vid val av konventionell systemisk behandling beaktas typ av psoriasis, eventuell förekomst av psoriasisartrit, fertilitet, annan sjukdom eller riskfaktorer som övervikt och alkoholproblem.
Metotrexat (folsyraantagonist) är ett välbeprövat och billigt preparat [19]. Över 40 procent av patienterna når acceptabel förbättring efter 4 månaders behandling [20, 21]. Metotrexat ska inte ges till gravida, ammande eller till patienter med nedsatt lever-/njurfunktion eller alkoholproblem.
Ciklosporin (kalcineurinhämmre) kan ges under korta perioder (4–6 månader, längst 2 år). Preparatet ska inte ges till patienter med nedsatt njurfunktion, svåra infektioner eller tidigare omfattande ljus- eller PUVA-behandling. Ciklosporin har snabbt insättande effekt, upp till 70 procent kan nå betydande effekt [22]. Ciklosporin är inte lämpligt för långtidsbehandling på grund av njurtoxicitet.
Acitretin (A-vitaminderivat) har god effekt vid pustulös psoriasis och kraftig hyperkeratos vid hand-och fotpsoriasis. 20–30 procent av patienterna når god effekt. Acitretin kan kombineras med ljusbehandling. Preparatet är teratogent, har lång halveringstid och ska inte ges till kvinnor i fertil ålder.
Fumarsyra är en peroral immunmodulerande behandling som använts mest i Tyskland. Över 40 procent av patienterna når god effekt efter ca 4 månader [23]. Preparatet har i Sverige varit tillgängligt med licensförskrivning. Nyligen har dock ett nytt preparat (dimetylfumarat) registrerats som kan vara ett alternativ till metotrexat som singelterapi.
Apremilast (fosfodiesteras-4-hämmare) är en relativt ny peroral behandling av psoriasis och psoriasisartrit. I kliniska studier uppnår ca 30 procent av patienterna acceptabel effekt [24].
Andra perorala medel som tioguanin, vitamin D och lågdos naltrexon har också, dock med bristande evidens, använts som psoriasisbehandling.
Biologiska läkemedel är effektiva – ett paradigmskifte
Biologisk behandling har nu använts i över 10 år med ett växande antal behandlade patienter och ökande klinisk erfarenhet [25]. Biologiska läkemedel är stora proteinmolekyler som produceras med hjälp av levande celler och ges som infusion eller injektion. Biologiska preparat rekommenderas till patienter med medelsvår/svår psoriasis (PASI ≥10, DLQI ≥10 eller BSA ≥10) med kontraindikation för annan systemisk behandling (eller som inte svarat på eller är intoleranta mot sådan behandling).
Biologiska läkemedel är mycket effektiva i behandlingen av psoriasis. De kan leda till helt läkt hud och har inneburit ett paradigmskifte i psoriasisbehandlingen. TNF-α-hämmare (etanercept, infliximab och adalimumab) är de första biologiska läkemedel som använts vid behandling av psoriasis och psoriasisartrit. Ustekinumab har en annan verkningsmekanism med blockering av IL-12/IL-23. Cirka 50–80 procent (beroende på preparat) av patienterna når PASI 75 efter ca 3 månaders behandling [26-29].
De senaste godkända biologiska läkemedlen är IL-17-hämmare (sekukinumab och ixekizumab), som har visat goda resultat i kliniska prövningar på både psoriasis och psoriasisartrit; >80 procent når PASI 75 efter 3 månaders behandling och >60 procent blir nästan helt läkta [30, 31]. Fler patienter som behandlats med IL-17-hämmare når PASI 75 eller blir helt läkta än patienter som behandlats med TNF-α-hämmare. Dock har IL-17-hämmarna funnits kortare tid på marknaden, och långtidseffekter kan inte helt bedömas ännu.
I tillägg finns biosimilarer, »kopior« som liknar redan godkända biologiska läkemedel vars patent har gått ut. Det finns tillgängliga biosimilarer för infliximab och etanercept. Precis som generiska läkemedelskopior är biosimilarer vanligtvis billigare än originalen, eftersom utvecklingskostnaden är lägre.
Hälsoekonomiska aspekter måste vägas in
Behandling med biologiska läkemedel är dyr men kan leda till avsevärd förbättring av patientens livskvalitet [18, 32], vilket bör beaktas vid psoriasisbehandling. Hälsoekonomiska aspekter måste givetvis också vägas in; konventionell systemisk behandling är mest kostnadseffektiv hos de patienter som uppnår god klinisk respons och är nöjda [19].
Vid val/byte av biologisk behandling ska man ta hänsyn till förekomst och fenotyp av psoriasisartrit (perifer vs axial). Dessa patienter bör skötas i samarbete med reumatologer. Biologisk behandling med TNF-α-hämmare är nödvändig för patienter med psoriasisartrit som behöver snabb och effektiv sjukdomskontroll [33].
Behandling med biologiska läkemedel behövs oftast under många år, och livslång behandling kan vara nödvändig. Biverkningar skiljer sig mellan preparaten, men mest förekommande biverkning är ökad infektionsrisk. Det finns också risk för antikroppsutveckling och terapisvikt.
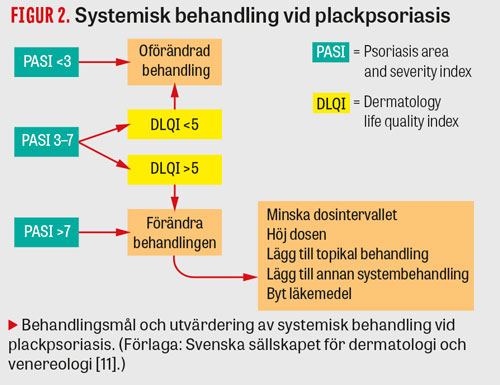
Vid insättande av systemisk behandling ska effekten utvärderas efter 3 respektive 6 månader. Man ska sträva efter att uppnå behandlingsmål med låg sjukdomsaktivitet (PASI <3 och förbättrad livskvalitet).Om detta inte uppnås bör behandlingsstrategin modifieras (Figur 2).
Alla patienter som behandlas med systemiska läkemedel, inklusive PUVA, bör registreras av hudläkare eller sjuksköterska i Register för systembehandling av psoriasis (PsoReg), om patienten inte avböjer. På så sätt kan man utvärdera långtidseffekterna och följsamhet till behandlingsrekommendationer [11].
Nya behandlingar på gång
En rad nya, i första hand biologiska läkemedel väntar på godkännande av den europeiska läkemedelsmyndigheten (EMA) samt Tandvårds- och läkemedelsförmånsverket (TLV) och därmed registrering och förskrivning till svenska patienter. Ökad kunskap om molekylära mekanismer vid psoriasis har möjliggjort utvecklingen av dessa nya läkemedel.
Nya läkemedel som befinner sig inför snar registrering är brodalumab (IL-17RA [receptor A]-antagonist) och IL-23-p19-antikroppar (guselkumab, risankizumab och tildrakizumab). Det har visat sig att dessa läkemedel är ännu mer effektiva; >40 procent når PASI 100, dvs helt läkt hud, 70 procent blir nästan helt läkta (PASI 90) och upp till 90 procent når PASI 75, viket överträffar alla tidigare behandlingar [34]. Enligt data från kliniska prövningar skiljer sig biverkningsprofilen inte negativt från redan godkända biologiska läkemedel. Selektiviteten för IL-23-p19 kan vara fördelaktig i effektivitets- och säkerhetsprofilen jämfört med anti-p40-blockering.
Specificiteten för just IL-23-p19-blockaden med antikroppar med hög affinitet kan ge långvarig läkning av psoriasis med minimal förlust av effekten vid återinsättning och på så sätt presentera ett paradigmskifte i psoriasisbehandling [34].
Många andra biologiska läkemedel är under prövning, t ex bimekizumab (IL-17A, IL-17F-antikropp), certolizumab pegol (anti-TNF-α-hämmare), IMO-8400 (Toll-lik receptor [TLR] 7-, 8- och 9-antagonist), tregalizumab (anti-CD-4-antikropp som aktiverar regulatoriska T-celler), namilumab, neihulizumab (förebygger T-cellsaktivering) m fl.
Även många läkemedel för peroral och topikal behandling av psoriasis är under prövning, t ex fumarsyra, baricitinib (JAK [januskinas]-1- och JAK-2-hämmare), piclidenoson (adenosin A3-receptoragonist), tofacitinib (JAK-hämmare), SNA-120/CT 327 (tropomyosinreceptorkinas A-hämmare), MOL4239 (p-STAT3 [signal transducer and activator of transcription 3 protein]) etc.
Antiinflammatorisk behandling och hjärt–kärlsjukdom
Patienter med psoriasis har ökad förekomst av kardiovaskulär och metabol samsjuklighet som är viktig att ta hänsyn till vid val av psoriasisbehandling. Generellt sett påverkar biologisk behandling inte negativt metabola parametrar som vid konventionell systemisk behandling. TNF-α-hämmare ska ordineras med försiktighet till patienter med tecken på hjärtsvikt, men i övrigt har man inte sett någon ökad risk för kardiovaskulär sjuklighet. Tvärtom ses en trend mot minskning av hjärtinfarkt hos patienter med måttlig till svår psoriasis som behandlas med biologiska läkemedel [35].
I en systematisk översikt har man sett att behandling med metotrexat är associerad med lägre risk för kardiovaskulära sjukdomar, vilket talar för att antiinflammatorisk behandling kan minska risken för kardiovaskulär sjuklighet [13]. En ny studie visade att patienter som får TNF-α-hämmare har lägre risk för kardiovaskulär sjuklighet än de som får metotrexat [36]. Detta understryker vikten av att effektivt behandla patienter med pågående inflammation [12].
Hälsosam livsstil är både preventiv och terapeutisk
Stress, rökning, övervikt med låg fysisk aktivitet och alkoholkonsumtion kan både utlösa och försämra psoriasis och negativt påverka effekten av behandlingen [37]. En hälsosam livsstil (hälsosam kost, ökad fysisk aktivitet, rökstopp och minskad alkoholkonsumtion) kan verka både preventivt mot samsjuklighet vid psoriasis och terapeutiskt, och dessutom kan effekter av sjukdomsspecifik behandling potentieras [38, 39].
Rekommendationer finns nu för systemisk behandling
Antalet behandlingsalternativ för psoriasis har ökat dramatiskt. Det är därför viktigt att utveckla rekommendationer som kan möta behovet av ett stadigt ökande kunskapsläge om psoriasis.
Intressegruppen för psoriasis inom Svenska sällskapet för dermatologi och venereologi (SSDV) har nyligen publicerat behandlingsrekommendationer för systemisk behandling av psoriasis [11]. I ett behandlingsschema presenteras en översikt över möjliga behandlingar vid kronisk plackpsoriasis (Figur 3). Om annan behandling har visat sig vara otillräcklig kan man överväga att direkt sätta in behandling med biologiska läkemedel utan att testa konventionell systemisk behandling hos patienter med måttlig till svår psoriasis [11].
Behandlingen i framtiden – patientcentrerad vård
Individanpassad, s k patientcentrerad vård är essentiell för effektiv behandling av psoriasis och relaterad samsjuklighet [3]. Individanpassad vård vid psoriasis omfattar bättre förståelse av hudsymtom, fysisk och psykisk samsjuklighet, sjukdomens påverkan på livskvalitet, behandling och prevention samt god relation mellan patient och doktor, ökat engagemang av familj och vänner och patientutbildning om sjukdomen och behandlingsstrategin [3].
I ett framtidsscenario kommer vi att basera behandlingen på en mer preciserad definition av psoriasisfenotyper och bättre insyn i den patofysiologi som kan vara unik för olika typer av psoriasis. Detta skulle kunna möjliggöra en för individen skräddarsydd behandlingsplan.
Med en sådan behandlingsplan tidigt i livet skulle sjukdomen kunna behandlas optimalt och samsjukligheten minimeras, och därmed skulle livskvaliteten öka.
Potentiella bindningar eller jävsförhållanden: Amra Osmancevic har deltagit i rådgivande kommittéer och/eller föreläst för AbbVie, Celgene, Eli Lilly, Novartis, Pfizer, Meda, Janssen-Cilag, Almirall och LEO Pharma samt deltagit i kliniska prövningar för Novartis, AbbVie och Boehringer Ingelheim. Mona Ståhle har erhållit arvoden från Novartis, Celgene, Eli-Lilly, UCB, AbbVie, Leo Pharma, Pfizer och Janssen-Cilag för föreläsningar och deltagande i rådgivande kommittéer.