Den nya generationens glukossänkande läkemedel för personer med typ 2-diabetes är generellt säkra ur kardiovaskulär synpunkt.
Hittills har enstaka läkemedel inom gruppen SGLT2 (natriumglukoskotransportör 2)-hämmare respektive GLP-1 (glukagonlik peptid 1)-receptoragonister visat positiva effekter på kardiovaskulära och renala utfallsmått. Pågående studier får visa om detta är giltigt för hela läkemedelsklasser.
Utfallsstudierna är genomförda i en population med särskilt hög risk för kardiovaskulära händelser. Resultaten kan därför inte överföras till alla patienter med typ 2-diabetes.
Risken för makrovaskulära komplikationer inklusive kardiovaskulär död är minst dubblerad hos personer med typ 2-diabetes jämfört med hos personer utan diabetes [1]. Förutom lidandet för individen bidrar kardiovaskulär sjuklighet inklusive perifer kärlsjukdom och amputationer till höga direkta och indirekta kostnader [2]. Bland de mikrovaskulära komplikationerna utgör diabetesnefropati en allvarlig komplikation som i sin allvarligaste form leder till dialys- eller transplantationskrävande njursvikt. Den kardiovaskulära sjukligheten ökar dessutom väsentligt vid samtidig njurskada.
Effekter av intensiv glukossänkande behandling
Det är välkänt att personer med typ 2-diabetes ofta har multipla kardiovaskulära riskfaktorer. Multifaktoriell läkemedelsbehandling som sänker glukos, lipider och blodtryck samt stöd för rökstopp har visats reducera makro- och mikrovaskulära komplikationer och mortalitet [3]. Det var dock under många år oklart hur mycket intensiv glukossänkning, det vill säga en behandling med plasmaglukos-/HbA1c-mål kring normala värden, bidrog till minskning av makro- och mikrovaskulära komplikationer.
Fram till mitten av 1990-talet var metformin, sulfonureider och insulin de alternativ som fanns att välja mellan för glukossänkning. I den banbrytande UKPDS (United Kingdom prospective diabetes study), där ca 4 200 nydiagnostiserade personer med typ 2-diabetes randomiserades till intensiv- eller standardbehandling under 10 år, kunde man visa att mer intensiv glukossänkning, oavsett med vilket av dessa farmaka, minskade risken för mikrovaskulära komplikationer [4, 5]. I den subgrupp (n = 342) som behandlades med metformin såg man även en minskning av makrovaskulära komplikationer och mortalitet [4]. Uppföljning av alla patienter i UKPDS efter studiens avslut (medianuppföljning 8,5–8,8 år) kunde sedermera visa att intensivgruppen hade bättre effekt på både makro- och mikrovaskulära utfallsmått oavsett läkemedelsbehandling [6]. Intensiv glukossänkande behandling hos personer med etablerad typ 2-diabetes med lång duration (ca 10 år) har också positiva effekter på mikrovaskulära komplikationer [7-9] men har antingen varit neutral [7, 8] eller i ett fall till och med ökat risken vad gäller kardiovaskulär död [10].
Risker med olika glukossänkande läkemedel
Under senare år har det vid flera tillfällen hänt att läkemedel efter introduktion på marknaden dragits in på grund av misstanke om ökad risk för kardiovaskulära händelser (till exempel rosiglitazon). Med en ökad farmakologisk mångfald och ett flertal nya grupper av glukossänkande läkemedel i verktygslådan har kraven på att visa kardiovaskulär säkerhet därför ökat. För att godkänna nya preparat riktade mot folksjukdomar, såsom typ 2-diabetes, hypertoni och hyperlipidemi, kräver läkemedelsmyndigheterna i USA (FDA) och Europa (EMA) sedan 2008 att företagen visar att de i en högriskpopulation inte ökar risken för kardiovaskulära händelser under en uppföljningstid av minst två år. Det betyder således inte att man behöver påvisa positiva effekter på detta utfallsmått utan enbart att nya läkemedel ska vara minst lika säkra som redan etablerade läkemedel. Ett stort antal av dessa studier med kardiovaskulära utfallsmått (så kallade cardiovascular outcome trials, CVOT) inom typ 2-diabetesfältet har påbörjats och även avslutats under senare år. Bland dessa finns även några där man i sekundära analyser kunnat visa positiva effekter på njurfunktion. Sammantaget har dessa studier gett en hel del ny kunskap men även medfört en intensiv debatt kring hur man ska tolka och eventuellt extrapolera fynden.
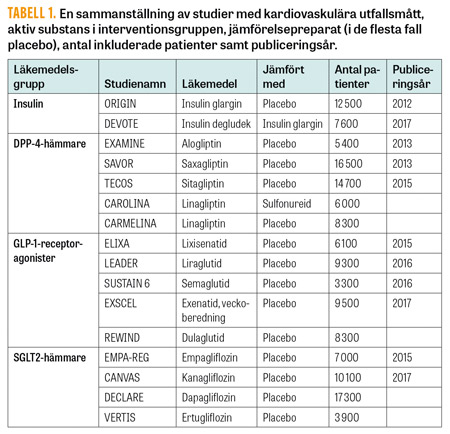
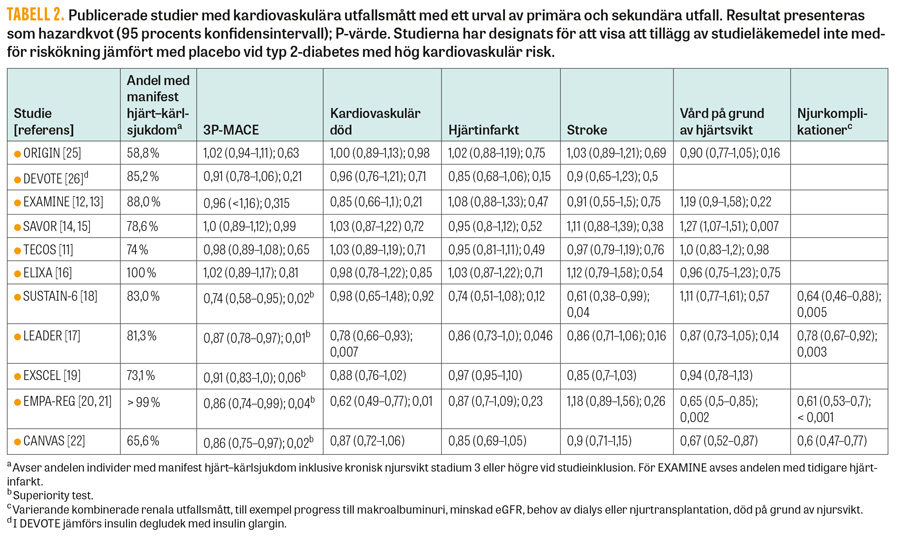
Tabell 1 visar en sammanställning av sådana studier, där några är genomförda och publicerade medan andra fortfarande pågår. Studierna har inkluderat patienter med etablerad och/eller hög risk för hjärt–kärlsjukdom, men skiljer sig alla åt avseende faktiska riskfaktorer, studielängd, patienternas ålder, annan pågående medicinering, diabetesduration samt till viss del även det primära utfallsmåttet. Det senare är oftast ett kombinationsmått med tid till första allvarliga kardiovaskulära händelse (major adverse cardiovascular event, MACE). MACE kan definieras något olika men i dessa studier omfattas oftast kardiovaskulär död, icke-fatal hjärtinfarkt och icke-fatal stroke (ofta benämnt 3-punkts-MACE, 3P-MACE), ibland ingår i sekundära utfallsmått även instabil angina och/eller total mortalitet (4P- eller 5P-MACE). Det är viktigt att poängtera att dessa studier med kardiovaskulära utfallsmått i första hand designats för att visa kardiovaskulär säkerhet; i några fall har man dock haft tillräcklig statistisk styrka för att även visa positiva effekter på det primära utfallsmåttet. En kort sammanfattning av studierna, deras resultat och hur man ska tolka dessa redovisas nedan och sammanfattas i Tabell 2. Notera att andelen patienter med manifest hjärt–kärlsjukdom vid studieinklusion skiljer sig mellan studierna.
DPP-4-hämmare (dipeptidylpeptidas 4-hämmare). I denna grupp av perorala läkemedel som hämmar nedbrytning av det endogena inkretinhormonet GLP-1 finns för närvarande fyra preparat registrerade i Sverige: sitagliptin, saxagliptin, vildagliptin och linagliptin. I studierna TECOS (sitagliptin) [11], EXAMINE (alogliptin – inte registerat i Sverige) [12, 13] och SAVOR-TIMI53 (saxagliptin) [14] var effekten likvärdig med placebo avseende både primära och sekundära kardiovaskulära utfallsmått med undantag för att saxagliptin medförde en ökad risk för att läggas in på sjukhus till följd av hjärtsvikt, oberoende av patientens ålder [15]. Någon ökad risk för allvarliga händelser såsom svår hypoglykemi, njursvikt eller akut pankreatit sågs inte. Sammantaget visar detta att DPP-4-hämmare är kardiovaskulärt säkra men att saxagliptin ska undvikas vid manifest hjärtsvikt.
GLP-1-receptoragonister (glukagonlik peptid 1-receptoragonister). I denna grupp av injektionsläkemedel som stimulerar GLP-1-receptorn ingår för närvarande fyra preparat registrerade i Sverige: liraglutid, exenatid i veckoberedning, lixisenatid och dulaglutid.
Fyra studier med kardiovaskulära utfallsmått är publicerade: ELIXA (lixisenatid) [16], LEADER (liraglutid) [17], SUSTAIN-6 (semaglutid – en ännu inte registerad veckoberedning) [18] och EXSCEL (exenatid i veckoberedning) [19]. Ytterligare studier pågår där aktivt läkemedel jämförs med placebo. I ELIXA inkluderades patienter äldre än 30 år som vårdats för akut koronart syndrom inom ett halvår före inklusion. I de tre andra studierna var patienterna äldre och hade etablerad hjärt–kärlsjukdom och/eller njursvikt. Lixisenatid och exenatid var neutrala medan både liraglutid och semaglutid gav en signifikant positiv effekt på 3P-MACE jämfört med placebo (P = 0,01 respektive 0,02). I den mindre semaglutidstudien drevs effekten av en minskad risk för stroke (P = 0,04), vilket inte sågs för liraglutid. För liraglutid sågs i stället lägre risk för hjärtinfarkt (P = 0,046) och kardiovaskulär död (P = 0,007) jämfört med placebo. I Kaplan–Meier-kurvor var effekten på det primära utfallsmåttet i LEADER synlig efter drygt 1 år, SUSTAIN-6 visade en skillnad mellan behandlingsarmarna redan efter ca 4 månader.
I LEADER fanns ett kombinerat mikrovaskulärt utfallsmått (progress av retinopati respektive njurskada) där en fördel sågs för liraglutidbehandlade, främst orsakad av färre fall av dubblerat kreatininvärde eller tillkomst av makroalbuminuri. För semaglutid sågs en liknande fördel avseende njurkomplikationer, och där inkluderade utfallsmåttet även progress till terminal njursvikt. I den semaglutidbehandlade gruppen var det dock vanligare med allvarliga retinopatikomplikationer. Patienterna som behandlades med liraglutid drabbades i lägre utsträckning av allvarliga hypoglykemier, möjligen på grund av en lägre användning av insulin (samt eventuellt minskade insulindoser) och andra preparat med hypoglykema effekter jämfört med placebogruppen. Sammantaget är GLP-1-receptoragonister säkra ur ett kardiovaskulärt perspektiv, men det finns i dag endast ett preparat på den svenska marknaden som visat en positiv effekt på det primära utfallsmåttet MACE. Det är i dagsläget svårt att förklara dessa skillnader mekanistiskt, och det går inte att utesluta att de beror på olikheter i studieupplägg och/eller studiepopulation såsom diskuteras nedan.
SGLT2-hämmare (natriumglukoskotransportör 2-hämmare). I den senast introducerade gruppen diabetesläkemedel framkallas den glukossänkande effekten av ökad glukosutsöndring i urinen. I Sverige finns tre preparat registrerade: empagliflozin, kanagliflozin och dapagliflozin.
Hittills är resultat från två studieprogram publicerade: EMPA-REG (empagliflozin) [20, 21] och CANVAS (kanagliflozin) [22]. Ytterligare studier pågår med substanserna dapagliflozin respektive ertugliflozin (inte registerat i Sverige). I EMPA-REG, där drygt 7 000 patienter, de flesta med etablerad kranskärlssjukdom, följdes under drygt 3 år sågs en lägre risk för det sammanslagna utfallsmåttet 3P-MACE samt en minskad risk för sjukhusinläggning på grund av hjärtsvikt [21]. Dessa effekter sågs snabbt; redan efter någon månad devierade interventionsgruppen från den standardbehandlade avseende 3P-MACE, vilket framför allt drevs av en positiv effekt på det sekundära effektmåttet kardiovaskulär död. För sjukhusinläggning på grund av hjärtsvikt sågs skillnaden i det närmaste omedelbart. Dock förelåg en icke-signifikant tendens till ökad incidens av stroke som huvudsakligen sågs under uppföljningstiden efter studiens avslut. Därutöver fann man minskad progress av njurskada i empagliflozingruppen [20]. I CANVAS-programmet, som hade samma primära utfallsmått, inkluderades ca 10 100 patienter. Resultaten visade en liknande fördel avseende kardiovaskulära utfall och njurprotektion även om effekterna på sekundära effektmått inte var signifikanta och skillnaderna mellan behandlingsgrupperna inte sågs lika snabbt som i EMPA-REG. Noteras bör fyndet av en ökad risk för distala fotamputationer (hazardkvot 1,97; 95 procents konfidensintervall 1,41–2,75). Sammantaget visar dessa två studier på liknande effekt när det gäller MACE och renala komplikationer, vilket skulle kunna tyda på att det rör sig om en klasseffekt för SGLT2-hämmare. Det har också presenterats en rad teorier om vilka mekanismer som skulle kunna förklara detta [23, 24]. Utöver eventuella skillnader i biverkningar mellan preparaten bör det också påpekas att det för hela gruppen varnats för en något ökad risk för normoglykemisk diabetesketoacidos.
Insulin. I jämförelse med de nya preparat som beskrivs ovan finns det färre data avseende den kardiovaskulära säkerheten hos insulin. I ORIGIN [25] studerades effekten av insulin glargin jämfört med placebo, och huvudfyndet (3P-MACE) var neutralt. I DEVOTE [26] jämfördes insulin glargin med insulin degludek hos diabetespatienter med hög risk för kardiovaskulära händelser. Här sågs ingen skillnad i kardiovaskulärt kombinerat utfallsmått (kardiovaskulär död, hjärtinfarkt, stroke) mellan behandlingsgrupperna. Insulin degludek medförde dock något lägre risk för allvarlig hypoglykemi. Sammantaget talar detta för att nyare långverkande insulinanaloger (åtminstone glargin och degludek) är kardiovaskulärt säkra i en högriskpopulation.
Diskussion
Hittills publicerade studier med kardiovaskulära utfallsmått visar att alla nyare diabetesläkemedel är kardiovaskulärt säkra. När det kommer till tolkning av resultaten finns dock begränsningar, främst studiernas längd (alla är kortare än 4 år) och det begränsade urvalet av patienter. Då andelen med etablerad hjärt–kärlsjukdom skiljer sig väsentligt mellan studierna skulle detta tillsammans med andra skillnader (till exempel åldersspann, diabetesduration, BMI och HbA1c) också kunna bidra till att effekterna ser olika ut. Detta gäller även samtidig medicinering, där generellt en hög andel patienter är statinbehandlade (64–93 procent) men variationen är stor för samtidig behandling med sulfonureider (från 20 procent i EMPA-REG till 70 procent i EXAMINE). Det har också spekulerats över om en del av de positiva effekterna kan förklaras av att standardgrupperna behandlats med en högre andel läkemedel med ökad hypoglykemirisk. Det går därför inte att extrapolera resultaten från dessa studier till hela typ 2-diabetespopulationen. Dessutom innebär det kombinerade utfallsmåttet MACE att de individuella komponenterna kan bidra i olika grad till måttet; en positiv effekt på icke-dödlig hjärtinfarkt kan till exempel motverkas av en negativ effekt på icke-dödlig stroke, vilket försvårar tolkningen.
Många frågor förblir i nuläget obesvarade, framför allt huruvida det finns mekanismer som förklarar likheterna samt eventuella skillnader mellan olika preparats effekter och biverkningsprofiler. Oavsett detta, till skillnad från DPP-4-hämmare och långverkande insulinanaloger som är väsentligen neutrala, talar effekterna av SGLT2-hämmare för en klassövergripande positiv effekt på kardiovaskulära och renala komplikationer medan detta inte gäller för GLP-1-receptoragonister. Dessa resultat har lett till att både Socialstyrelsen [27] och Läkemedelsverket [28] reviderat sina prioriteringar/rekommendationer väsentligt. I till exempel Läkemedelsverkets behandlingsrekommendationer anges empagliflozin, kanagliflozin och liraglutid som särskilt lämpliga till patienter med manifest hjärt–kärlsjukdom. Det är dock viktigt att påpeka att de positiva effekterna inte kan extrapoleras till alla patienter med typ 2-diabetes. I övrigt kan man konstatera att behandlingsarsenalen vid typ 2-diabetes i dag förefaller säker ur ett kardiovaskulärt perspektiv. Detta är viktig kunskap eftersom vi aldrig tidigare haft tillgång till en sådan bred antidiabetisk terapiarsenal som i dag.
Potentiella bindningar eller jävsförhållanden: Eva Toft har haft produktoberoende föreläsaruppdrag inom diabetesområdet arvoderad av Novo Nordisk, Sanofi och MSD. Mikael Rydén har haft produktoberoende föreläsaruppdrag inom diabetesområdet arvoderad av Novo Nordisk, Boehringer Ingelheim och Novartis samt deltagit i expertgrupper för Novo Nordisk, Eli-Lilly, Boehringer Ingelheim, MSD och Sanofi. Båda författarna har deltagit som experter vid framtagandet av Läkemedelsverkets uppdaterade behandlingsrekommendationer avseende läkemedelsbehandling för glukoskontroll vid typ 2-diabetes som publicerades i oktober 2017.