- Parkinsons sjukdom är den näst vanligaste neurodegenerativa sjukdomen.
- Lewykroppar med alfa-synuklein som huvudbeståndsdel och förlust av dopaminerga nervceller i substantia nigra är neuropatologiska kännetecken.
- Diagnosen baseras på förekomst av bradykinesi och rigiditet eller vilotremor. Sjukdomen är också förknippad med många icke-motoriska symtom.
- Behandlingen baserar sig främst på farmakologisk behandling i syfte att öka dopaminsignalering och neurokirurgisk djup hjärnstimulering.
- Den progressiva sjukdomens symtomflora ändrar sig över tid, vilket kräver behandlingsjusteringar och anpassningar. Patienter bör följas av läkare, sjuksköterska och multidisciplinärt team med parkinsonexpertis.
Parkinsons sjukdom drabbar fler män än kvinnor (4:3) av hormonella orsaker [1, 2]. I en global studie från 2016 beräknade man att det finns 6,1 miljoner personer i världen som lider av sjukdomen [3]. I en amerikansk studie var incidensen 14/100 000 personer i den totala befolkningen och 160/100 000 personer i åldersgruppen äldre än 65 år [2].
Hos 5–10 procent av patienterna har man identifierat sjukdomsassocierade gener [1]. Upprepade skalltrauman ökar risken för att utveckla Parkinsons sjukdom [2]. Exponering för tungmetaller, exempelvis mangan, eller pesticider som paraquat, är associerad med något högre incidens [2]. Urat är en kraftig antioxidant, och studier har visat en lägre prevalens hos män med höga koncentrationer, medan hög konsumtion av mejeriprodukter, som har uratsänkande effekt, kan öka risken för Parkinsons sjukdom [2]. Incidensen är lägre hos personer som äter mycket tomater, rökare, snusanvändare och kaffedrickare [1, 2]. Det är dock fortfarande oklart om nikotin och koffein kan motverka neurodegeneration vid Parkinsons sjukdom.
Patogenes
De karakteristiska patologiska förändringarna vid Parkinsons sjukdom är förlust av de pigmenterade dopaminerga nervcellerna i substantia nigra och utbredd ackumulering av intracellulärt alfa-synuklein, ett protein som bildar Lewykroppar [4]. Nervcellsförlust och Lewykroppar förekommer även i många andra hjärnregioner och i det perifera nervsystemet.
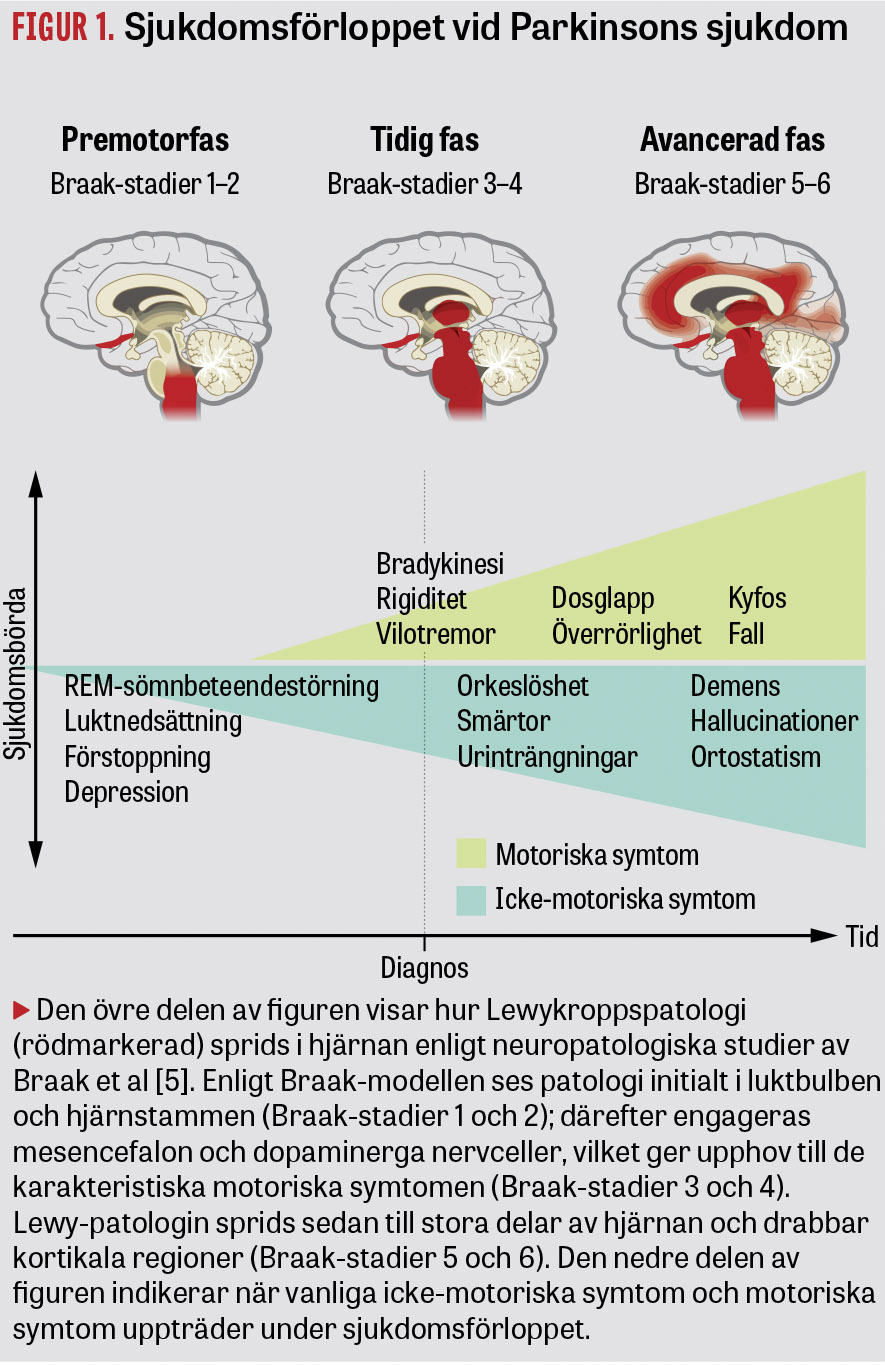
Braak et al har föreslagit att Lewy-patologin fortskrider i sex etapper med början i det perifera nervsystemet och gradvis påverkar det centrala nervsystemet [5] (Figur 1). Braak-modellen är attraktiv, då den föreslagna tidsmässiga och rumsliga utvecklingen av Lewy-patologin korrelerar med den kliniska utvecklingen av Parkinsons sjukdom (Figur 1). Det ska dock framhållas att Braak-modellen fortfarande behöver studeras i fler patientpopulationer, då den bara bekräftas i ca 50 procent av patienterna i vissa kohorter.
Det har vidare uppmärksammats att många patienter med Parkinsons sjukdom i senare stadier även har beta-amyloid- och tau-patologi som är karakteristiska för Alzheimers sjukdom [6]. Det är inte enbart en ansamling av felveckade proteiner som ses vid Parkinsons sjukdom utan även låggradig neuroinflammation med aktiverade astrocyter och mikroglia samt oxidativ stress associerad med störd mitokondriefunktion [7, 8]. Det stora flertalet personer med Parkinsons sjukdom har idiopatisk sjukdom, men det finns även autosomalt dominanta och recessiva former [2]. Den först identifierade genen som orsakar autosomalt dominant Parkinsons sjukdom var SNCA, som kodar för alfa-synuklein, och det finns former med både punktmutationer och multiplikationer av genen [2]. En vanligare form av autosomalt dominant Parkinsons sjukdom, framför allt bland judar och berber, orsakas av mutationer i LRRK2 [2]. Mutationer i parkin, ett protein involverat i mitokondriefunktion, orsakar autosomalt recessiv Parkinsons sjukdom och förekommer hos 50 procent av personer som får Parkinsons sjukdom före 40 års ålder [2]. En vanlig genetisk riskfaktor för att utveckla Parkinsons sjukdom är mutationer i den lysosomala GBA-genen, vilka leder till ackumulering av felveckat alfa-synuklein och lipider [9].
Diagnostik och sjukdomsförlopp
En rad icke-motoriska symtom, såsom REM-sömnbeteendestörning (REM sleep behavioral disorder, RBD), nedsatt luktsinne, förstoppning, depression och ångest, kan föregå de motoriska symtomen (Figur 1).
I dag är det dock först då motoriska symtom uppkommit som patienten kan diagnostiseras. Den kliniska diagnosen av Parkinsons sjukdom baseras på ett förlopp av parkinsonism-symtom som utvecklas över tid, från enstaka lateraliserade symtom till mer komplexa och mer omfattande motoriska symtom och ackumulering av icke-motoriska manifestationer. Definitiv diagnos kan bara fastställas efter obduktion.
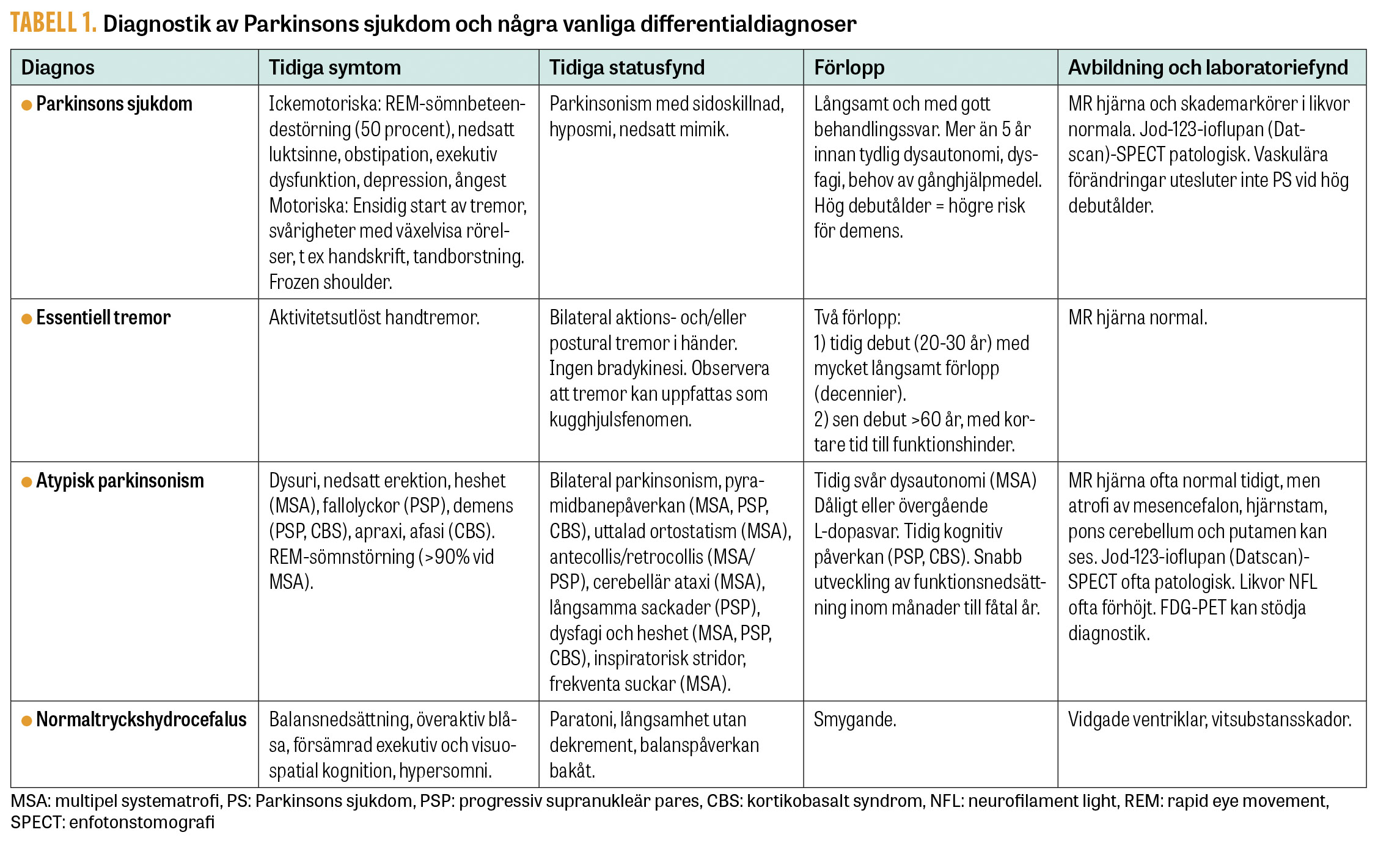
De mest etablerade diagnoskriterierna, UK Parkinson’s Disease Society Brain Bank criteria [10] har på senare tid kompletterats med MDS Clinical diagnostic criteria for PD [11] där förekomsten av icke-motoriska symtom betonas mer och där enstaka »röda flaggor« kan vägas upp av stödjande kriterier. Det kliniska syndromet parkinsonism föreligger vid bradykinesi (förlångsammade rörelser med dekrement, dvs växelvisa rörelser som diadokokinesi eller handknytningar hindras av gradvis amplitud- och frekvensminskning) i kombination med minst ett av statusfynden vilotremor (skakning som minskar av viljemässig rörelse) och rigiditet (Tabell 1).
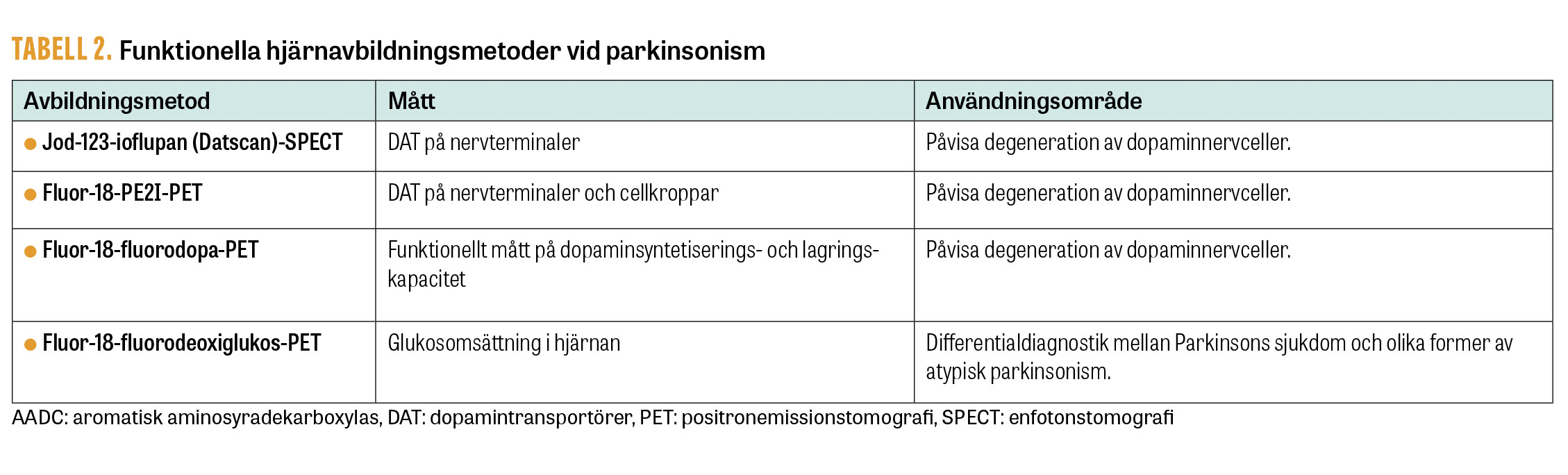
Parkinsonism är mycket starkt associerad med nedsatt dopaminsignalering i hjärnan. Presynaptisk orsak, som vid Parkinsons sjukdom, stöds därför av god behandlingseffekt av levodopa eller dopaminreceptoragonister. Eftersom behandlingssvaret ofta utvecklas successivt vid tidiga sjukdomsstadier ska test av akut behandlingsrespons (levodopa-test) dock inte användas diagnostiskt. Hjärnavbildande undersökningar används främst för att påvisa annan orsak till symtom eller samsjuklighet. Funktionell avbildning av dopaminsystemet kan bekräfta förlust av dopaminnervceller [12] (Tabell 2). Detta är användbart vid svårtolkad tremor eller vid misstanke om farmakologiskt orsakad parkinsonism, men undersökningen differentierar inte mot andra degenerativa sjukdomar med parkinsonism som multipel systematrofi, progressiv supranukleär pares och kortikobasalt syndrom. Funktionsavbildning med FDG-PET kan delvis differentiera mellan Parkinsons sjukdom och olika former av atypisk parkinsonism [13] (Tabell 2). MR-undersökning av hjärnan kan påvisa småkärlsskador eller mindre lakunära stroke i och kring de basala ganglierna, som ger upphov till gångsvårigheter, generellt förlångsammade rörelser och ibland tremor som konsekvens av hypertoni och diabetes mellitus, och som utgör en viktig samsjuklighet eller differentialdiagnosen sekundär parkinsonism.
Efter diagnos och initiering av behandling har de flesta patienter med Parkinsons sjukdom en period med god funktion och livskvalitet under minst 3–5 år. Tilltagande motoriska och icke-motoriska problem uppkommer därefter under sjukdomsförloppet (Figur 1).
Man delar ofta upp patienterna i två huvudgrupper: tremordominant eller akinetisk-rigid Parkinsons sjukdom [7,8]. Ungefär 40 procent av patienterna har akinetisk-rigid Parkinsons sjukdom och överlag ett snabbare och mer elakartat sjukdomsförlopp, där de ofta drabbas av axiala symtom såsom kyfos, balansproblem och fall samt hallucinationer och kognitiv svikt som utvecklas till demens.
Även om motoriska symtom är nödvändiga för diagnos är det vanligt att personer med Parkinsons sjukdom är mest handikappade av icke-motoriska symtom som stresskänslighet, orkeslöshet, sömnbesvär, ångest/depression, smärtor och autonoma besvär som urinträngningar, förstoppning och ortostatism [7, 8].
Behandling
Behandlingen av Parkinsons sjukdom är mångfasetterad och involverar en rad olika läkemedel, neurokirurgi och träningsbaserade strategier. Behandlingen ändras också under sjukdomens faser.
Nedan ges en översikt kring behandlingen av Parkinsons sjukdom. För en mer fullödig beskrivning, se Swemodis riktlinjer för utredning och behandling av Parkinsons sjukdom (https://www.swemodis.se).
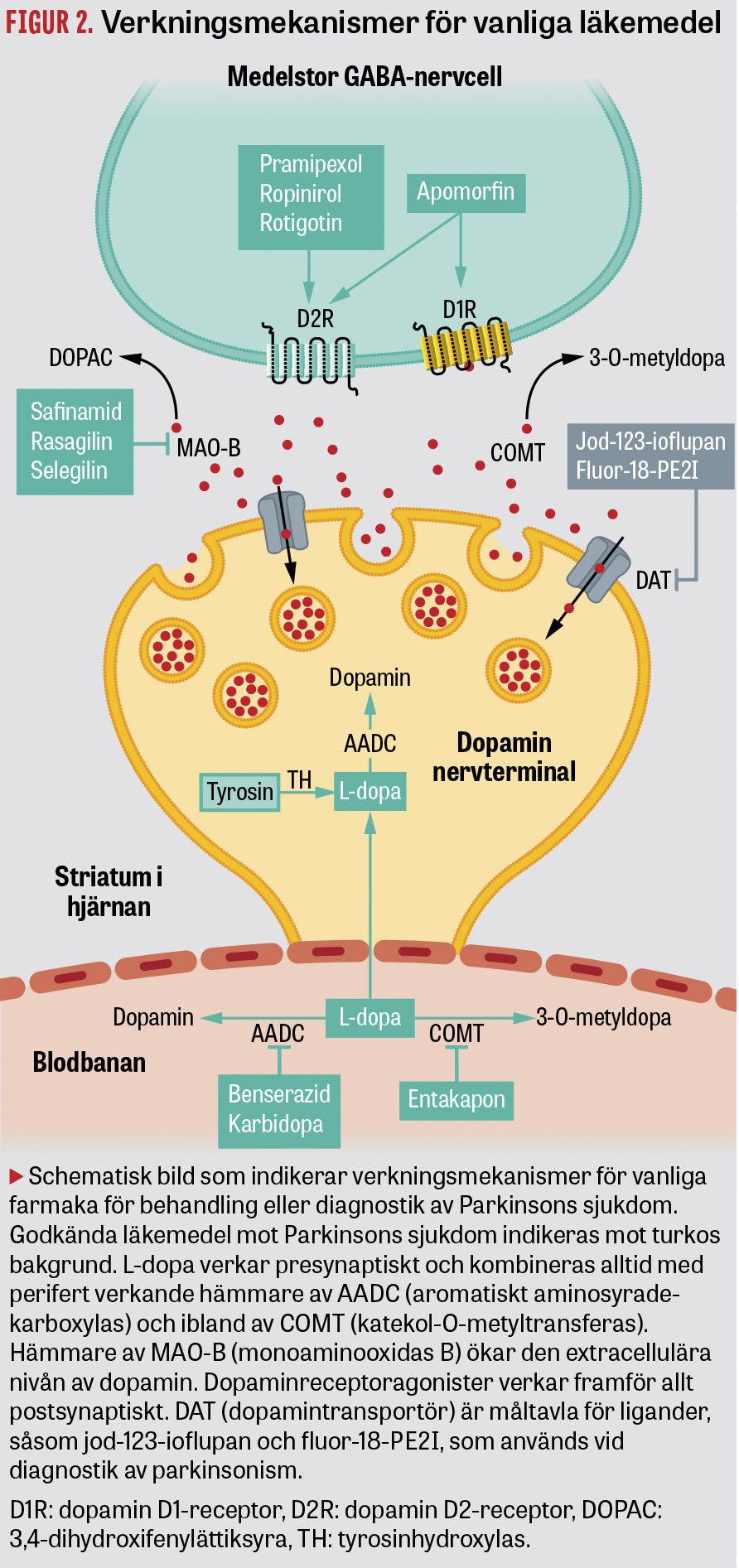
Behandling i tidig fas. Läkemedel som ökar dopaminsignalering är centrala för behandlingen. Dessa läkemedel inkluderar levodopa, dopaminreceptoragonister samt hämmare av monoaminooxidas B (MAO-B) eller katekol-O-metyltransferas (COMT) [7, 8, 14] (Figur 2).
Behandlingen bör inledas när patienten har fått sin diagnos. Levodopa, som alltid ges tillsammans med en hämmare av aromatiskt aminosyradekarboxylas (AADC) för att minska perifer metabolism, ger den största symtomlindringen, men med tiden uppstår ofta fluktuationer och dyskinesier [14]. Fluktuationer yttrar sig som perioder då behandlingen har god effekt (s k »on«), varvat med perioder av dålig effekt som vid dosglapp (s k »off«) eller övereffekt (med överrörlighet, s k dyskinesier). För att undvika fluktuationer och dyskinesier är det vanligt att behandlingen inleds med dopaminreceptoragonister, i synnerhet hos yngre patienter.
Dopaminreceptoragonister bör dock ej ges till patienter som har en historik av störd impulskontroll, såsom svårigheter att kontrollera spelande, inköp och andra njutningsmedel, då sådan problematik kan förstärkas. I stort sett alla patienter kommer att behöva behandling med levodopa för att hantera sin parkinsonism. De levodopa-relaterade fluktuationerna och dyskinesierna beror åtminstone delvis på den pulsativa behandlingen och kan delvis kuperas med tillägg av hämmare av MAO-B eller COMT [7, 8]. Frekvent och exakt peroral dosering med mikrotabletter av levodopa har också utvecklats för att finjustera medicineringen [15].
Tillägg av amantadin, som verkar på glutamaterg neurotransmission, kan motverka dyskinesier [7, 8].
De dopaminerga läkemedlen har ofta en mycket god effekt på bradykinesi och rigiditet, men kan ibland ha en begränsad effekt på vilotremor. Även en del icke-motoriska symtom förbättras när den dopaminerga behandlingen optimeras. För specifik behandling av icke-motoriska symtom som demens, depression, hallucinationer, sömnbesvär och autonom dysfunktion används läkemedel som är godkända för dessa indikationer men som inte förvärrar de motoriska symtomen vid Parkinsons sjukdom [16].
Utöver läkemedel så är det viktigt att patienterna genomför olika träningsbaserade strategier för att förbättra balans, hållning, muskelstyrka och tal.
Behandling i avancerad fas. För att effektivt behandla fluktuationer och dyskinesier används i dag ofta så kallade avancerade, eller apparatassisterade, behandlingar som syftar till att uppnå mer kontinuerlig och stabil behandlingseffekt:
- Kontinuerlig tillförsel av levodopa till proximala delen av tunntarmen via PEG, med bärbar pump [17-19].
- Kontinuerlig tillförsel av dopaminreceptor-agonisten apomorfin subkutant med bärbar pump [20, 21].
- Djupelektrodstimulering (DBS) med högfrekvent ström från en subkutan stimulator till elektroder som opererats in stereotaktiskt, företrädesvis i nucleus subthalamicus [22-24].
Dessa behandlingsalternativ ger främst mer kontinuerlig effekt av behandlingen – tiden i »off« reduceras kraftigt [25,26]. Ofta dämpas också dyskinesier. Även många icke-motoriska symtom (som sömn, depression, smärta) kan förbättras. De flesta patienter som ställs in på avancerad behandling får därmed bättre livskvalitet [25, 26], men behandlingarna påverkar inte sjukdomens förlopp. De avancerade terapierna bygger på olika metodik, och därmed skiljer de sig åt vad gäller risker och biverkningar [16-26]: vid enteral levodopainfusion är det oftast sondsystemet som krånglar. Vid apomorfinbehandling kan läkemedlet orsaka inflammerade knölar, noduli, i underhuden men även systemiska biverkningar som blodtrycksfall eller hallucinationer. DBS innebär en liten risk för allvarliga biverkningar som blödningar eller infektioner i hjärnan (< 1 procent av patienter), men oftare stimuleringsberoende biverkningar som dysartri.
I konsensusförfaranden med experter på behandling av Parkinsons sjukdom har man enats om att avancerad terapi bör övervägas [27, 28] när patienten har minst 5 dagliga doser av peroralt levodopa och har prövat övriga gängse perorala och transdermala terapialternativ och trots detta har minst 1–2 timmar i besvärande »off« och/eller med störande dyskinesier per dag.
Valet av avancerad terapi är en komplicerad process, som baseras på indikationer/kontraindikationer för respektive terapi, patientens motoriska och icke-motoriska symtomprofil samt patientens egna preferenser. Socialstyrelsens nationella riktlinjer understryker att detta är beslut som bör tas inom parkinsonteam med erfarenhet av alla terapialternativ.
Även i avancerad fas har specifik behandling av enskilda icke-motoriska symtom hög prioritet; detta gäller exempelvis behandling av depression med antidepressiva (i första hand selektiva serotonin-/noradrenalinåterupptagshämmare), psykotiska symtom med atypiska neuroleptika och demens med kolinesterashämmare [15].
Uppföljning
Den progressiva sjukdomens symtomflora ändrar sig över tid, vilket kräver behandlingsjusteringar och anpassningar. Sjukdomen är förenad med individuella kombinationer av motoriska och icke-motoriska symtom, vilket hos äldre personer ofta kompliceras av annan samsjuklighet. Vid uppföljning behöver därför helheten kartläggas.
Behandlingen kan påverka vilka komplikationer som dominerar. Man har sett en association mellan höga levodopa-doser och både off-fluktuationer och dyskinesier, men det är svårt att föra i bevis att läkemedlet är orsaken. Impulskontrollstörningar förekommer oftare hos patienter som har behandlats med höga doser av dopaminreceptor-agonister under lång tid [29, 30]. Dopaminerg behandling kan lindra vissa symtom (såsom bradykinesi, tremor, initativlöshet) men utlösa eller förvärra andra (såsom ortostatism, somnolens, hallucinationer och dyskinesi). Att kartlägga tidssamband mellan medicinintag och symtom är centralt.
Omhändertagandet av patienter med Parkinsons sjukdom syftar till att nå så god symtomlindring som möjligt med hänsyn till riskerna för såväl under- som överbehandlingssymtom. Vårdens uppföljning hjälper patienten att säkerställa att den aktuella symtombilden är resultatet av optimal avvägning mellan effekt och dessa risker.
Enligt Socialstyrelsens nationella riktlinjer för vård vid MS och Parkinsons sjukdom bör hälso- och sjukvården erbjuda personer med Parkinsons sjukdom återkommande undersökningar, minst två gånger per år, hos en läkare med betydande erfarenhet av sjukdomen. Läkarkontakten kan i perioder av stabil sjukdom ersättas av kontakt med en parkinsonsjuksköterska eller med annan hälso- och sjukvårdspersonal som ingår i det multidisciplinära teamet. Patienter bör ha tillgång till parkinsonsjuksköterska, multidisciplinär teamuppföljning och vid behov perioder av sammanhängande teamrehabilitering.
Frågeformulär och skattningsskalor inför besök kan användas för att säkra att relevant information kommer fram och möjliggöra att man vid besöket fokuserar på det för patienten viktigaste.
I Parkinsonregistret (del av Svenska neuroregister, www.neuroreg.se), finns nu möjlighet för patienter att själva registrera frågeformulär om icke-motoriska symtom, on-off-score och hälsorelaterad livskvalitet. Anamnes och status kan sedan ta stöd av besöksmallen i Parkinsonregistret, och detta kan vid behov kompletteras med patientdagböcker, observation på mottagning eller vårdavdelning och kartläggning av rörelsemönster med parkinsonspecifik aktigrafi [31], som tillsammans ger ett bra underlag för rekommendationer.
Konklusion och framtidsperspektiv
Den kliniska diagnosen Parkinsons sjukdom baserar sig på motoriska symtom som huvudsakligen beror på förlust av dopamin och kan behandlas framgångsrikt med substitutionsbehandling. Parkinsons sjukdom är dock heterogen och komplex i sitt kliniska uttryck, och många patienter drabbas av olika icke-motoriska symtom samt motoriska komplikationer, mot vilka bättre symtomatiska terapier behöver utvecklas. Individualiserad behandling vid Parkinsons sjukdom för subgrupper av patienter, exempelvis med GBA- eller LRRK2-mutationer, är under utveckling.
Det stora genombrottet för behandlingen skulle vara terapier som bromsar den neurodegenerativa processen. Flera kliniska behandlingsstudier försöker minska spridning och aggregering av alfa-synuklein. Vidare utvecklas gen- och cellbaserade tillvägagångssätt för att återskapa dopaminerg funktion.
Potentiella bindningar eller jävsförhållanden: Filip Bergquist har fått arvode ifrån Global Kinetics Inc och AbbVie. Anders Johansson har fått arvode till sin klinik ifrån Abbvie, Nordic InfuCare, Global Kinetics och Integrative Research Laboratories. Nil Dizdar har fått arvode ifrån AbbVie, UCB och Zambon (Nilgaard). Håkan Widner har fått arvode ifrån Medtronic, CBD Solutions AB och Neurovive. Dag Nyholm har fått arvode ifrån AbbVie, NeuroDerm och NordicInfu Care. Per Odin har fått arvode ifrån UCB, AbbVie, Air Liquide, Bial, Britannia, Lobsor, Nordic Infucare, Stada och Zambon. Per Svenningsson har fått arvode ifrån AbbVie, Sanofi Genzyme, Shire/Takeda och CBD solutions AB.
(uppdaterad 2020-03-16)