Gikt är en kronisk inflammatorisk sjukdom som orsakas av förhöjda uratnivåer, vilket leder till klinisk gikt, det vill säga utfällningar av uratkristaller i mjukdelar och ledinflammationer.
Överkonsumtion av puriner eller endogen överproduktion av urat bidrar i liten utsträckning till förhöjda uratnivåer – genetiska faktorer som styr njurutsöndring av urat är viktigare. Ändrad kosthållning ger därför i allmänhet inte någon betydelsefull sänkning av uratnivåer.
Guldstandarden vid diagnostik är påvisande av uratkristaller i ledvätska, men nya radiologiska metoder som muskuloskeletalt ultraljud och datortomografi med dubbelenergiteknik har god sensitivitet och specificitet.
Gikt är vanligt – prevalens och incidens ökar i västvärlden.
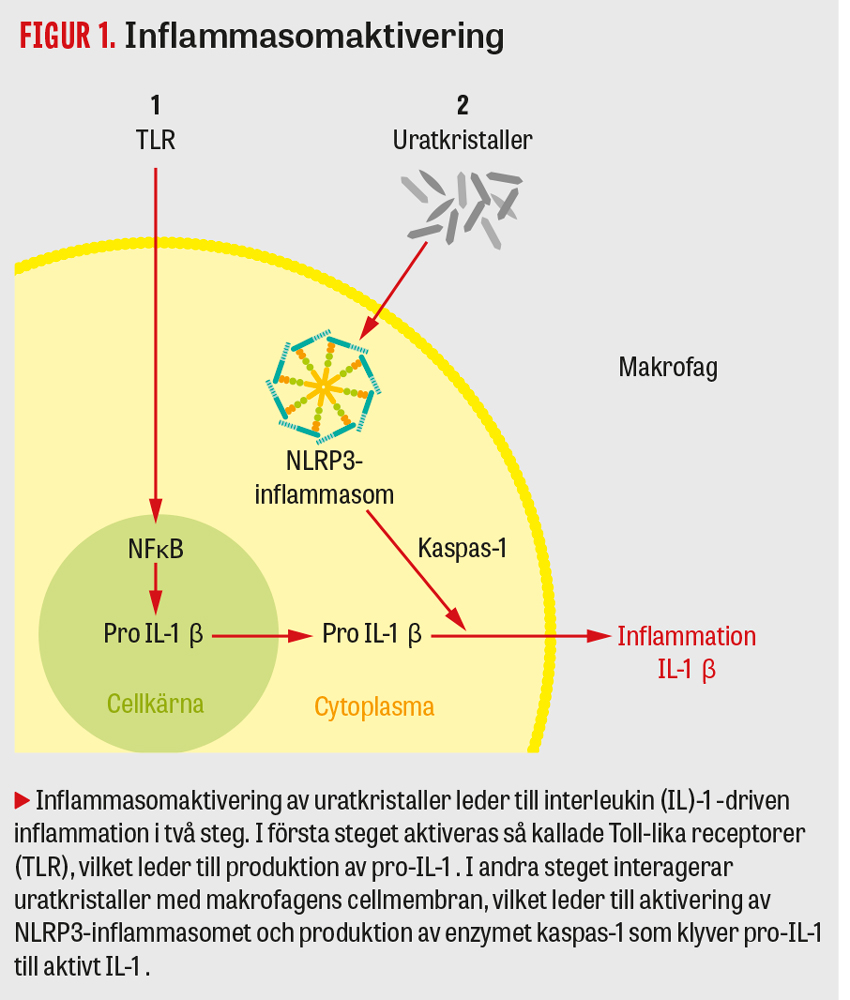
Gikt är en kronisk sjukdom som orsakas av inlagringar av uratkristaller i leder och mjukdelar. Patogenesen är känd i stora drag: en förhöjd nivå av urat i blodet leder hos vissa individer till kristallisering av urat. Uratkristaller ansamlas då i leder och mjukdelar, där de episodvis utlöser ett immunsvar i leden som kliniskt presenterar sig som en akut giktattack. I avsaknad av effektiv uratsänkande behandling ligger uratinlagringarna kvar i den giktdrabbade leden/vävnaden även under den asymtomatiska perioden mellan giktattacker och kan då på sikt utlösa nya giktattacker. De intracellulära mekanismer som ligger bakom inflammationen vid den akuta giktattacken är delvis kända. Den viktigaste komponenten anses vara aktivering av NLRP3-inflammasomen [1]. För inflammasomaktivering krävs en interaktion mellan makrofager och uratkristaller. Vid aktivering av NLRP3-inflammasomet aktiveras sedan enzymet kaspas-1, som i sin tur klyver pro-interleukin (IL)-1β till aktivt IL-1β. Det uppstår då en inflammationskaskad med produktion av IL-1 och andra proinflammatoriska cytokiner (se Figur 1).
Den klassiska kliniska bilden vid en giktattack är en hastigt påkommen, smärtsam monoartrit där stortåns grundled oftast är engagerad vid det första anfallet. Att giktattacker drabbar mellanfotens leder, fotled eller knä är heller inte ovanligt, medan giktartriter i övre extremiteter är mindre vanliga vid sjukdomsdebut. Förhöjda inflammationsparametrar i blodet är vanliga vid en giktattack, och subfebrilitet kan förekomma. Karaktäristiskt för inflammationen vid en akut giktattack är att den ebbar ut på 1–2 veckor.
Cirka en femtedel av patienterna utvecklar med tiden en svårare giktsjukdom med allt tätare och ofta polyartikulära giktattacker som då kan engagera både övre och nedre extremiteter. De besvärsfria intervallen mellan attacker tenderar då att till sist i stort sett upphöra, varvid en mera kronisk polyartritbild uppträder. Detta sjukdomsstadium kännetecknas av genom huden synbara tofi, det vill säga utfällningar av uratkristaller i mjukdelar och kring leder.
Hyperurikemi och gikt
Förhöjda uratnivåer är en förutsättning för att uratkristallisering ska ske och leda till klinisk gikt, men långt ifrån alla individer med hyperurikemi får gikt. I en svensk kohortstudie visades att endast 13 procent av män och 18 procent av kvinnor med förhöjda uratnivåer under en uppföljningstid på knappt 30 år utvecklade gikt, då förhöjd uratkoncentration var definierad som över nivån för löslighet av urat in vivo (405 µmol/) [2]. Risken för att utveckla klinisk gikt ökade linjärt med stigande uratnivåer.
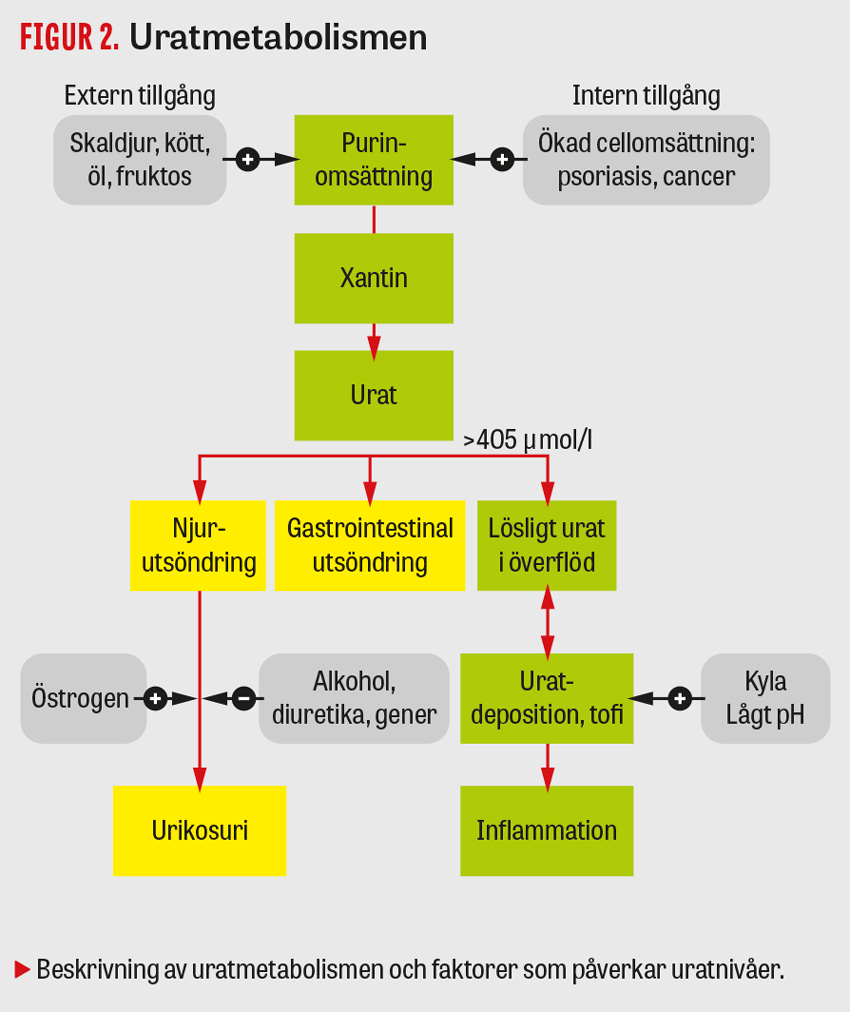
Urat är slutsteget i purinmetabolismen, där de puriner som bryts ned till urat har sitt ursprung dels från cellsönderfall, dels från intag av purininnehållande livsmedel, se Figur 2. Förhöjda uratnivåer uppstår dock främst på grund av otillräcklig utsöndring av slutprodukten urat via njurarna, där nedsatt njurfunktion i sig ger hyperurikemi, men där även genetisk variation i gener som kodar för urattransportörer har visat sig ha en avgörande roll. Överkonsumtion av puriner eller endogen överproduktion av urat är således sällan huvudorsaken till höga uratvärden. Detta innebär att enbart ändrad kosthållning sällan är framgångsrik som giktbehandling. Däremot är det tänkbart att man kan få relevanta effekter på uratnivån av att minska en hög alkoholkonsumtion, då alkohol (speciellt öl) såväl kan ha en lätt urathöjande effekt som vara en utlösande faktor för giktattacker.
Resultat från tvillingstudier talar för att ärftlighet förklarar 45–73 procent av variationen i uratnivåer [3-5]. Genetiska studier har de senaste åren identifierat ett flertal lokus som influerar uratnivåer. De största effekterna på uratnivåer ses vid variationer i gener som kodar för urattransportörer i njure och tarm [6].
URAT-1 är en viktig urattransportör i proximala tubuli. Tiaziddiuretika och även loopdiuretika ökar aktiviteten av URAT-1, vilket leder till ökad reabsorption av urat i tubuli och därmed förhöjda nivåer av serum-urat. Omvänt fungerar urikosuriska läkemedel som probenecid genom att hämma aktiviteten av URAT-1.
Den kemiska löslighetsgränsen för urat in vitro vid pH 7,4 och 37 °C är 405 µmol/l [7]. Löslighetsnivån sjunker kraftigt vid lägre temperaturer [7], vilket förklarar att uratkristallisering kan ske även vid lägre nivåer av urat, framför allt i perifera leder och i mjukdelar där temperaturen är lägre än 37 °C. Uratkristallisering kan ske vid uratkoncentrationer ner till 360 µmol/l, vilket är det allmänt accepterade gränsvärdet för hyperurikemi hos patienter med gikt. Att denna kliniskt relevanta gräns är lägre än laboratoriernas övre referensintervall (kvinnor > 50 år: 400 µmol/l och män ≥ 18 år: 480 µmol/l) leder troligtvis till att hyperurikemi vid gikt ofta underbehandlas.
Det har noterats att uratkristaller inlagras i senor i kollagenfibrernas längdriktning [8]. Kollagenfibrer antas kunna fungera som ett slags ramverk för kristallbildning och på så sätt underlätta denna. Vid artros exponeras ytliga kollagenfibrer på ledbroskets yta på ett sätt som verkar främja inlagring av uratkristaller [8]. Detta antas kunna förklara den kliniska observationen att giktattacker i hög utsträckning drabbar leder där artros föreligger [9].
Diagnostik
Guldstandarden vid diagnostik av gikt är påvisande av uratkristaller i ledvätska från engagerad led eller från misstänkta tofi. I praktiken är det dock vanligast att diagnosen ställs utifrån klinisk bild. Vid genomgång av patientjournaler i Västra Götalandsregionen noterades att ledpunktion för diagnos endast gjordes i cirka 1 procent av fallen [10].
Poängbaserade klassifikationskriterier för gikt togs fram gemensamt av de europeiska och amerikanska reumatologorganisationerna EULAR (European League Against Rheumatism) och ACR (American College of Rheumatology) 2015 och kan utgöra ett stöd vid diagnostik (se webb-kalkylator på http://goutclassificationcalculator.auckland.ac.nz/).
Ett mer lättanvänt kliniskt diagnosstöd som är framtaget för att användas när ledvätskeanalys inte har genomförts togs fram av holländska primärvårdsläkare 2010 [11] och validerades i en studie några år senare [12], se Tabell 1.
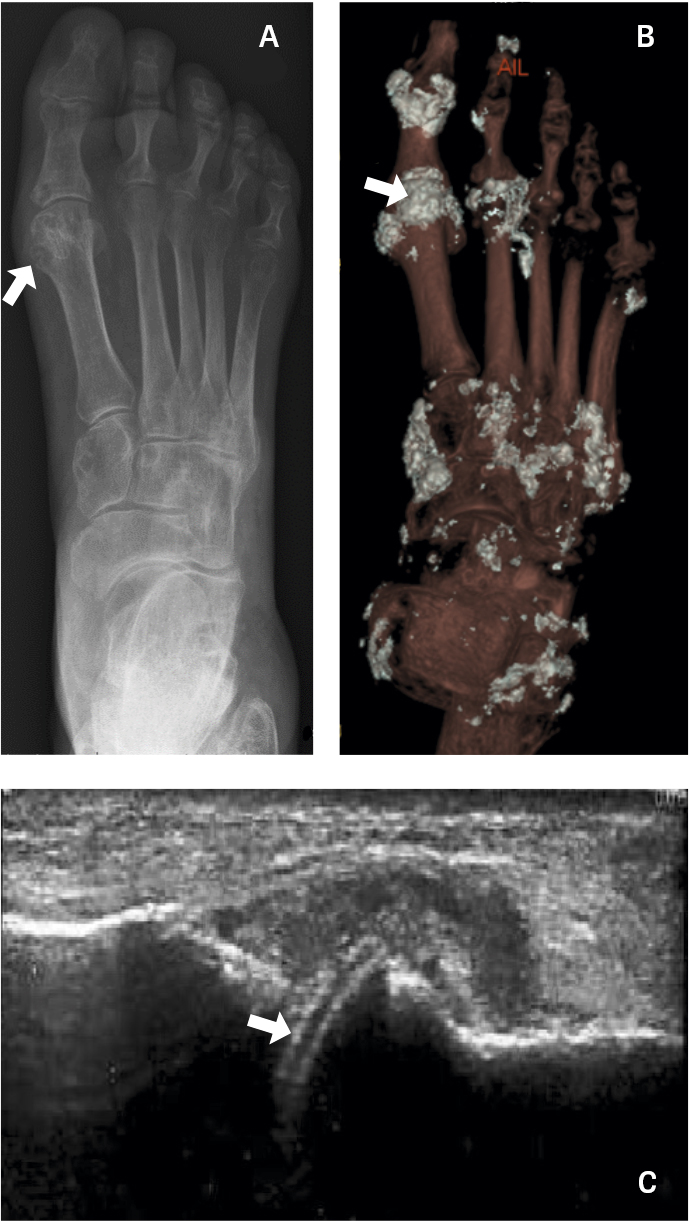
Konventionell slätröntgen är inte av något värde vid diagnostik av akut gikt, men vid kronisk tofös gikt kan lederna uppvisa typiska erosiva förändringar, ofta belägna en bit utanför ledkapselns fäste (Figur 3A), och vid långt gången sjukdom ses subluxationer och ankylos.
Under det senaste decenniet har nya användbara bilddiagnostiska metoder för gikt utvecklats. Datortomografi med dubbelenergiteknik, DECT, kan vara användbar för diagnostik i oklara fall (Figur 3B). Dubbelenergitekniken möjliggör distinktion mellan olika kemiska substanser, vilket kan nyttjas till att bildmässigt påvisa uratkristallinlagringar som då tydligt kan skiljas från kalkinnehållande material. Undersökning med DECT har 81 procents sensitivitet och 91 procents specificitet för gikt jämfört med den diagnostiska guldstandarden, det vill säga påvisande av uratkristaller i ledvätska [13]. Muskuloskeletalt ultraljud kan användas som stöd vid diagnostik av gikt. Inlagringar av uratkristaller på ledbroskets yta visualiseras med ultraljud som en dubbelkontur (Figur 3C).
Epidemiologi
Gikt är den vanligaste inflammatoriska ledsjukdomen, och prevalens och incidens ökar såväl i Sverige [14] som i övriga västvärlden.
Prevalensen ökar med stigande ålder och är högre hos män än kvinnor i alla åldersgrupper (se Figur 4). Prevalensen av gikt utifrån ICD-10-kodad giktdiagnos i register har i Sverige studerats i Västra Götaland, där den befanns vara 1,8 procent [14]; i Skåne 1,7 procent [15]; i Dalarna 2,1 procent [opubl data; 2018] och i Stockholm 0,9 procent hos män och 0,3 procent hos kvinnor [16]. De lägre prevalenssiffrorna i studien från Stockholm förklaras utifrån en kortare »fångstperiod« i den studien; då diagnoser från tidigare år inkluderades var den totala prevalensen i Stockholm 1,4 procent. Hos män över 70 års ålder är prevalensen över 10 procent, vilket med hänsyn till sjukdomens vanlighet förmodligen innebär att gikt är en av de sämst behandlade sjukdomarna i sjukvården (se nästa artikel i temat).
Prevalens och incidens av gikt ter sig ha ökat globalt de senaste 50 åren [17], men olika falldefinitioner och metoder för prevalens- och incidensskattning försvårar till viss del jämförelse mellan länder och världsdelar. I de flesta västländer har prevalensen beräknats vara > 1 procent. Generellt verkar prevalensen av gikt vara lägre i utvecklingsländer, med reservation för att giktepidemiologi inte är studerad i lika stor utsträckning i dessa länder. Genetiska faktorer/etnisk bakgrund anses förklara en stor del av de skillnader i giktprevalens man ser globalt, tillsammans med omgivningsfaktorer som blyexponering, kost och alkoholkonsumtion [17]. Den högsta rapporterade prevalensen av gikt i världen återfinns hos maori-befolkningen i Australien och Nya Zeeland, där prevalensen beräknats vara 3,4 procent bland vuxna maorier [17]. Maori-befolkningen tenderar dessutom i större utsträckning att ha en svårare gikt med tofi jämfört med befolkning av europeiskt ursprung.
Incidensen av gikt i den vuxna befolkningen beräknades i Västra Götalandsregionen år 2012 vara 190 fall per 100 000 invånare och år, i Skåne 238 per 100 000 och i Dalarna 248 per 100 000 invånare.
Utifrån tillgängliga prevalens- och incidensdata kan man beräkna att 150 000 personer lever med gikt och att totalt kring 15 000 individer årligen i Sverige insjuknar i gikt.
Sammanfattningsvis är gikt en sjukdom med i stort känd patofysiologi och tillgänglig men sällan använd effektiv behandling (se artikel om behandling av gikt). Sjukdomen blir allt vanligare och borde uppmärksammas mer i dagens sjukvård.
Läs även författarintervjun med Valgerdur Sigurdardottir.
Potentiella bindningar eller jävsförhållanden: Valgerdur Sigurdardottir, Per Wändell, Mats Dehlin och Lennart Jacobsson har erhållit konsultarvode från Grünenthal.
(uppdaterad 2023-04-12)