Läkemedelsbiverkningar och bristande effekt orsakar stora problem i sjukvården.
Farmakogenomik är den del av precisionsmedicin som fokuserar på individuell risk för läkemedelsbiverkningar eller terapisvikt.
Genomic Medicine Sweden gör en nationell satsning på precisionsmedicin och farmakogenomik vid maligna sjukdomar. Detta stärker möjligheterna till individanpassad behandling och förbättrad patientsäkerhet.
Farmakogenomisk information bör presenteras i ett särskilt avsnitt i patientens journal.
Elektroniskt beslutsstöd behöver utvecklas och användas vid ordination av läkemedel.
Farmakogenomik är den del av precisionsmedicin som fokuserar på genetiskt betingad risk för läkemedelsbiverkningar eller underbehandling. Farmakogenomik är en del i det nationella projektet Genomic Medicine Sweden (GMS), som avser att förbättra möjligheterna till individanpassad behandling och förbättrad patientsäkerhet. För att satsningen på farmakogenomik ska nå framgång i klinisk praxis behövs:
- Evidensbaserade farmakogenetiska råd, vilket ställer krav på kritisk litteraturvärdering.
- Lättillgänglig presentation av råden i journalen inför framtida läkemedelsbehandling.
- Ett elektroniskt beslutsstöd för ordination av läkemedel som påverkas av farmakogener.
- Uppföljning av genetiska varianter med okänd betydelse som påträffas vid sekvensering.
Genernas betydelse för läkemedel
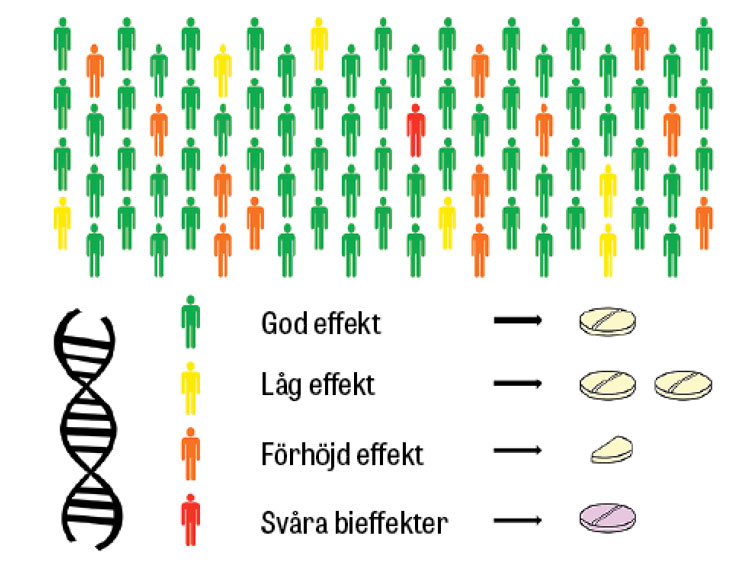
Betydelsen av medfödda genvarianter för kroppens svar på läkemedel studeras inom farmakogenetik – eller farmakogenomik när mer storskaliga analyser används [1-4]. Genernas betydelse för läkemedel undersöks allt oftare redan under läkemedelsutvecklingen. I en översikt från European Medicines Agency 2015 beskrivs att 17 procent av alla produktresuméer under de senaste 20 åren innehåller farmakogenetisk information [5]. Det handlar inte sällan om genetiska varianter som förknippas med nedsatt nedbrytning av läkemedel, vilket kan leda till ackumulering och risk för biverkningar eller allvarlig toxicitet (Figur 1).
Förstärkt effekt och toxicitet av läkemedel
Personer med nedsatt aktivitet i enzymet tiopurinmetyltransferas (TPMT) bör få anpassad startdos av tiopuriner (azatioprin, merkaptopurin och tioguanin, som används som immunsuppressiva eller cytostatika) för att undvika benmärgshämning [2]. Insättning av fluoropyrimidiner (framför allt 5-fluorouracil och kapecitabin, som används som cytostatika) bör föregås av screening för varianter i genen dihydropyrimidindehydrogenas (DPYD) som ökar risken för allvarlig läkemedelsutlöst toxicitet [6, 7]. Dessutom finns många exempel från psykofarmakologin där risken för biverkningar eller terapisvikt ökar vid avvikande aktivitet i enzymet cytokrom P450 2D6 (CYP2D6) [8, 9]. Se Fakta 1 för kliniska exempel.
Nedsatt effekt av läkemedel
För läkemedel som kräver aktivering för att få farmakologisk effekt kan nedsatt enzymaktivitet förknippas med försämrat eller uteblivet behandlingssvar. Typexempel är kodein där CYP2D6 bildar morfin som ger analgetisk effekt [10], klopidogrel som oxideras av CYP2C19 för att bli aktivt mot trombocytaggregation [11] och tamoxifen där CYP2D6 bildar den aktiva metaboliten endoxifen som skyddar mot återfall i bröstcancer [12].
Problem vid ultrasnabb metabolism
Det finns komplikationer förknippade med genetiskt betingad ultrasnabb metabolism som medför lägre nivåer av läkemedel i plasma och/eller höga metabolitnivåer. Exempel på det förstnämnda är risk för terapisvikt vid behandling med escitalopram hos patienter med ultrasnabb CYP2C19-metabolism [13]. Exempel på det sistnämnda är risk för att behandling med tamoxifen måste avbrytas på grund av biverkningar av den aktiva metaboliten endoxifen vid ultrasnabb CYP2D6-metabolism [14].
Ärftlig överkänslighet mot läkemedel
Utöver farmakokinetiska förklaringar till toxicitet och terapisvikt, så bidrar genetiska förutsättningar i immunförsvaret till kraftiga överkänslighetsreaktioner [15]. Exempelvis ska bärare av HLA-B*57:01 exkluderas från abakavirbehandling vid hiv och bärare av HLA-B*15:02 ska undvika karbamazepin eftersom de har kraftigt förhöjd risk för allvarliga hudreaktioner. Det Uppsalabaserade projektet Swedegene samlar DNA från patienter med biverkningar rapporterade till Läkemedelsverket med syfte att finna fler biomarkörer för allvarliga biverkningar [16].
Rutinanalyser
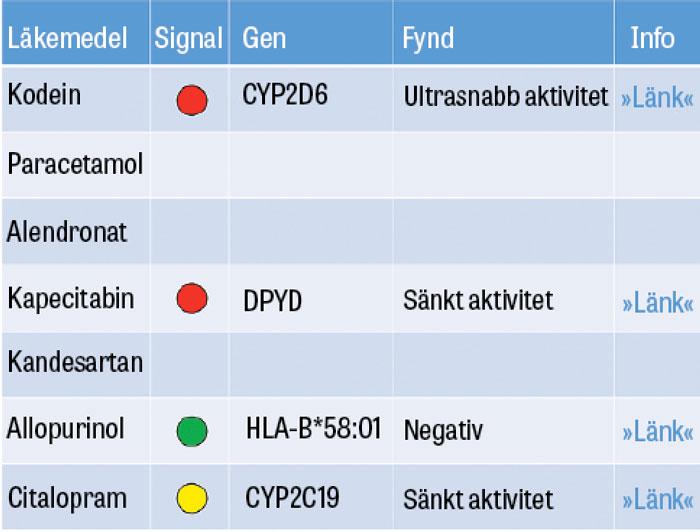
I Tabell 1 listas farmakogenetiska undersökningar som i dag erbjuds vid landets universitetssjukhus. Med dessa framför allt PCR-baserade analyser finner man förutbestämda genvarianter, och vid negativt fynd anses patienten ha normala genetiska förutsättningar. Mer sällsynta eller nya varianter undgår detektion, med risk för felbedömning av patienten. Ibland kan man därför kombinera genotypning med fenotypning, det vill säga test av enzymaktivitet eller läkemedelsomsättning [2].
NGS och farmakogenomik
Stora tekniska framsteg det senaste årtiondet har lett till högeffektiva metoder för gensekvensering, så kallad NGS (nya generationens sekvensering, även kallad massiv parallell DNA-sekvensering). När NGS används för farmakogenomik bör man helst utgå från DNA från normala celler, eftersom det finns risk för att tumörens arvsmassa innehåller mutationer och rearrangemang [12]. Vissa farmakogener är också svåra att analysera i sekvensdata på grund av komplicerade genstrukturer och förekomst av väldigt snarlika gener [5].
Det nationella projektet GMS ska gensekvensera ett stort antal patienter med maligna sjukdomar med hjälp av genpaneler som använder NGS. Arbetsgruppen för farmakogenomik inom GMS har lagt till utvalda farmakogener till genpanelerna och utvecklat tolkningsmetoder och svarsrutiner för dem.
Målbild
Den nya tekniken NGS öppnar för en mer fullständig genetisk datainhämtning och bred karakterisering av farmakologiska förutsättningar. Mot denna bakgrund är målbilden i klinisk praxis att genotyper finns enkelt tillgängliga i patientens journal och kan vägas in vid ordination av läkemedel (Figur 2). I analogi med elektroniska varningssystem för olämpliga läkemedelskombinationer och -interaktioner, liksom system som påminner om dosanpassning efter njurfunktion, bör en farmakogenomisk kunskapsdatabas kunna varna för unika dosbehov, läkemedelsöverkänslighet eller terapisvikt vid ordinationstillfället.
Viktiga steg mot målet
Men bortom teknikframstegen måste sjukvården hantera flera viktiga frågor som gäller handläggningen av enskilda patienter. Vi uppmanar till en vidare diskussion kring frågeställningarna nedan:
1. Hur ska patienten ge informerat samtycke inför farmakogenomisk kartläggning? Huvudregeln är att all provtagning inom sjukvården baseras på frivillighet och patientens eller målsmans informerade samtycke till analysen. Denne ska med andra ord vara införstådd med vad som ska analyseras och ha godkänt syftet med analysen. Farmakogenomisk analys kan ur detta perspektiv vara komplicerad, speciellt om det inte handlar om en aktuell behandlingssituation utan om framtida läkemedelsval. Det informerade samtycket bör därför gälla utredning av läkemedelsomsättning och -tolerabilitet med potential att påverka läkemedelsval och dosering under hela livet.
2. Hur ska den nya analystekniken valideras? Om NGS-fynd begränsas till redan välkända genetiska varianter kan resultaten valideras med annan kvalitetssäkrad analysteknik. Komplexa fynd, såsom när en gen finns i olika antal kopior, kan bekräftas med en vedertagen molekylärbiologisk metod. Gener med snarlik sekvens kan vara svåra att skilja åt och fynden kan i dessa fall behöva valideras.
3. Under vilka förutsättningar kan prov analyseras utanför sjukvården? För NGS-analyser används ibland laboratorier inom universitetsvärlden. Dessa laboratorier behöver följa sjukvårdens krav på säkerhetsrutiner kring provtagning, providentitet och provtransport samt dokumentation. Det gäller även patientsekretess och kodning liksom hur analysresultat återförs till sjukvården och patientjournalen på ett säkert sätt. Det bör klargöras vem som äger analysdata och hur patienten kan få ut sina analysresultat eller be om att de förstörs.
4. För vilka genetiska varianter ska data extraheras till sjukvården? Det finns i dag omfattande kunskaper om hur specifika läkemedel omsätts och hur olika genvarianter slår igenom funktionellt. Denna kunskap har delvis vuxit fram ur experimentella modellsystem med bekräftande studier på försökspersoner. Likaså har nya betydelsefulla varianter upptäckts genom genetisk karakterisering av farmakokinetiska extremfall (outliers) [17, 18]. Både akademiska och kommersiella initiativ har tagit sikte på att erbjuda bred farmakogenetisk profilering av de vanligaste och bäst karakteriserade genvarianterna. Som exempel kan nämnas ett projekt i Nederländerna där resultaten finns tillgängliga i ett elektroniskt farmakogenetiskt pass som patienten kan hänvisa till vid besök hos läkare eller apotek. Urvalet av 14 farmakogener, huvudsakligen läkemedelsomsättande enzymer, utgick delvis från att minst ett betydelsefullt fynd borde göras hos varje genotypad individ [19].
5. Vem ansvarar för klinisk tolkning av de genetiska fynden? Att sammanväga och tolka olika genetiska varianters betydelse för läkemedelsomsättning kräver expertis. Farmakogenomiskt baserade råd om startdos måste vara evidensbaserade, vilket ställer krav på kritisk litteraturvärdering inför klinisk implementering. Klinisk farmakologi, som har mångårig erfarenhet från utarbetande av evidensbaserade kliniska beslutsstöd kombinerad med bioanalytisk och farmakokinetisk kompetens spelar här en viktig roll. Prediktion av individuellt dosbehov gäller i första hand differentierad startdos. Om möjligt kan det följas upp med bestämning av jämviktskoncentration i blod/plasma för mer exakt vägledning kring eventuell dosjustering.
6. Hur presenteras resultaten för provbeställaren respektive i patientens journal? Farmakogenomiska undersökningsresultat har generell betydelse för patientens framtida läkemedelsbehandling. Farmakogenomiska analysresultat bör därför inte ingå som en vanlig post i journalens labblista, utan behöver ett reserverat utrymme under särskild rubrik (till exempel »Genetik och läkemedel«) eller kopplas till journalens uppmärksamhetsinformation för läkemedelsöverkänslighet. Lämpligen bör detta verktyg samköras med befintliga beslutsstöd som varnar för ogynnsamma läkemedelsinteraktioner och dosjustering vid sänkt njurfunktion.
7. Vem har ansvaret för reviderad tolkning i relation till ny kunskap över tid? Extraktion av relevanta genetiska data från en definierad NGS-panel kräver omfattande bioinformatisk expertis. Parallellt med ny forskning och växande kunskap över tid kan man behöva utvidga analyserade genpaneler och revidera tolkningen av data. Vem som bär ansvaret för att genomföra förändringar av genpaneler och tolkning måste definieras, liksom vem som har tillgång till patientens analysresultat.
8. Hur hanteras helt nya genetiska varianter med osäkert kliniskt genomslag? Man har nyligen sett att det förekommer många hittills okända mutationer i gener för enzymer som omsätter läkemedel. Resultaten från studier på 208 farmakogener indikerar att varje individ bär på i genomsnitt fyra mycket sällsynta – eller till och med helt unika – mutationer med potential att slå igenom i läkemedelsomsättning [20]. Det blir en utmaning att hantera sällsynta fynd med osäkert genomslag. Ett alternativ är att flagga för att hittills okända mutationer påträffats och att plasmakoncentrationsbestämning eller test av enzymaktivitet är motiverad. Ett annat alternativ är att rekommendera särskilt noggrann uppföljning av ny läkemedelsbehandling med avseende på effekt och biverkningar.
Framtidsvision
Med de nya tekniker som används inom precisionsmedicin ingår inte bara möjligheter att identifiera goda kandidater för målinriktad läkemedelsbehandling (till exempel vid molekylär diagnostik av tumörer) utan även att bättre karakterisera patientens generella förutsättningar för läkemedelsval nu och framöver. Ett elektroniskt beslutsstöd för det senare behöver utvecklas. Rätt utformning av detta verktyg skulle ge ett bättre underlag för individanpassad läkemedelsbehandling och -dosering. Sjukvården måste axla ansvaret för denna nya kunskap, som ställer krav på innovativa IT-lösningar för att göra farmakogenomisk information hanterbar och säker i klinisk praxis.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Mia Wadelius och Erik Eliasson är ordförande respektive vice ordförande i den nationella arbetsgruppen för farmakogenomik inom det Vinnovastödda projektet Genomic Medicine Sweden. I arbetsgruppen ingår Lena Fredriksson, Joel Ås, Pär Hallberg, Gabriella Scordo och Arja Harila-Saari (Uppsala), Henrik Gréen och Malin Lindqvist Appell (Linköping), Alan Fotoohi, Olof Breuer och Jonatan Lindh (Stockholm), Arne Reimers, Jasmine Brandt och Anders Helldén (Lund), Magnus Axelsson (Göteborg), Ulrika Pettersson (Umeå) samt Michael Andresen (Örebro).
Fakta 1. Kliniska exempel där farmakogener haft betydelse
- En ung person med inflammatorisk sjukdom påbörjade behandling med azatioprin i normal dos. Efter 1 månad lades patienten in akut med allvarlig benmärgshämning, och azatioprin sattes ut. Patienten behandlades med granulocytstimulerande faktor och antibiotika och kunde skrivas ut efter 1 månad. Genotypning av tiopurinmetyltransferas indikerade mycket låg enzymaktivitet. Om patienten genotypats i förväg hade rekommendationen varit att iaktta stor försiktighet och ge maximalt 10 procent av normal dos av azatioprin.
- En äldre person fick sin första cytostatikakur med oxilaplatin och fluorouracil i normal dos. Efter 2 veckor lades patienten in akut med allvarlig benmärgshämning. Patienten behandlades med bredspektrumantibiotika på grund av sepsis och kunde skrivas ut efter 2 veckor. Genotypning av dihydropyrimidindehydrogenas indikerade mycket låg enzymaktivitet. Om patienten genotypats i förväg hade rekommendationen varit att iaktta stor försiktighet och ge maximalt 25 procent av normal startdos av fluorouracil.
- En medelålders person som reagerat med biverkningar på ett flertal läkemedel mot depression fick vid behandling med paroxetin i maxdos tremor, koncentrationssvårigheter och somnolens. Toxisk serumkoncentration uppmättes och paroxetindosen trappades ned. Genotypning av CYP2D6 visade att patienten saknar enzymaktivitet. Om patienten genotypats i förväg hade rekommendationen varit att välja ett läkemedel som inte huvudsakligen bryts ned via CYP2D6 eller, om alternativ behandling saknades, börja med maximalt 50 procent av normal startdos av paroxetin.
- En äldre person upplevde otillräcklig effekt av kodeintabletter mot ischemiska bensmärtor. Patienten ökade därför på eget initiativ till dubbel rekommenderad maxdos. Trots detta uppnåddes inte adekvat smärtlindring. Genotypning av CYP2D6 visade att patienten saknar enzymaktivitet och därför inte kan aktivera kodein till morfin, som står för den analgetiska effekten. Om patienten genotypats i förväg hade rekommendationen varit att välja ett annat analgetikum.