Molekylär kunskap om tumörutveckling leder till allt fler målinriktade cancerbehandlingar.
Heltäckande molekylär tumörkarakterisering ger möjlighet att undersöka samtliga behandlingsalternativ med en analys.
Arbetsutskottet för solida tumörer inom Genomic Medicine Sweden samarbetar för att etablera regional och nationell infrastruktur för storskalig tumörsekvensering och kopplad dataanalys i sjukvården.
Utvecklingen ställer nya krav på vården, bland annat när det gäller kunskapsöverföring och rekrytering av nya kompetenser.
Långsiktiga mål är specifik cancerterapi för varje enskild patient, bättre möjlighet att bedriva kliniska behandlingsstudier och koppling av molekylära tumördata till landets cancerregister.
Framväxten av prediktiv molekylär patologi i Sverige
Vid millennieskiftet introducerades den första hämmaren av tillväxtfaktorreceptorn HER2 (protein som kodas av genen ERBB2) för behandling av bröstcancer. Därefter har ett stort antal läkemedel riktade mot tillväxtfaktorer och signalmolekyler nedströms dessa godkänts för behandling av olika solida tumörer [1]. Gemensamt för dessa behandlingar är att de endast är verksamma mot tumörer med specifika molekylära förändringar, oftast aktiverande mutationer som stimulerar tumörens fortsatta tillväxt och överlevnad. Lungcancer (som rutinmässigt undersöks avseende generna EGFR, ALK, ROS1 och BRAF), kolorektalcancer (KRAS, NRAS, BRAF, MSI) och maligna melanom (BRAF) är i dag de tumörformer som föranleder majoriteten av behandlingsprediktiva analyser inom molekylär patologi. Som ett resultat av detta informationsbehov har en sekvensbaserad klinisk diagnostik vuxit fram som i takt med ett ökat behov av information och en snabb teknisk utveckling både ökat i omfattning och gått från enstaka analyser till genpaneler analyserade med NGS, nya generationens sekvensering, även kallad massiv parallell DNA-sekvensering. Figur 1A visar den dramatiska ökningen av molekylära tumöranalyser, en fyrdubbling från ca 3 000 till 12 000 test mellan 2011 och 2019. Figuren visar också att NGS nu är den helt dominerande analysmetoden vid landets molekylärpatologiska laboratorier.
Ett konkret exempel är icke-småcellig lungcancer, där tumörerna hos ca 10 procent av patienterna innehåller en aktiverande mutation i tillväxtgenen EGFR. Påvisandet av en sådan mutation är kopplat till god effekt av behandling med riktade läkemedel, så kallade tyrosinkinashämmare. Här har möjligheten att behandla mot fler molekylära mål lett till ett tydligt skifte från selektiv analys av EGFR-genen till användande av mindre NGS-paneler, som utöver mutationer i EGFR kan fånga upp förändringar i upp emot ett 50-tal gener relevanta för tumörens biologi och som ibland är vägledande avseende ytterligare behandlingsalternativ (Figur 1B) [2].
Det blev relativt snart tydligt att cytologiskt material utgör ett värdefullt alternativ för patienter där vävnadsmaterialet är otillräckligt [3]. Under senare tid har även analyser av cirkulerande tumör-DNA i plasma tillkommit som en möjlighet att detektera mutationer i tumörer som är svåra eller riskabla att nå via biopsering eller punktionscytologi. Ofta handlar det om patienter med tumörer som progredierar under pågående terapi.
Under senare år har olika typer av kromosomala rearrangemang (involverarande kinasgener som till exempel ALK och ROS1) visat sig ge upphov till fusionsproteiner som kan hämmas av specifika cancerläkemedel. Detta har också stimulerat utvecklingen av RNA-baserade analyser som på ett enklare sätt kan detektera dessa jämfört med DNA-baserad teknologi. Trots att RNA är känsligare för nedbrytning och kräver särskilda metodologiska hänsyn växer dessa analyser i antal och betydelse (Figur 1C).
Heltäckande genomisk profilering
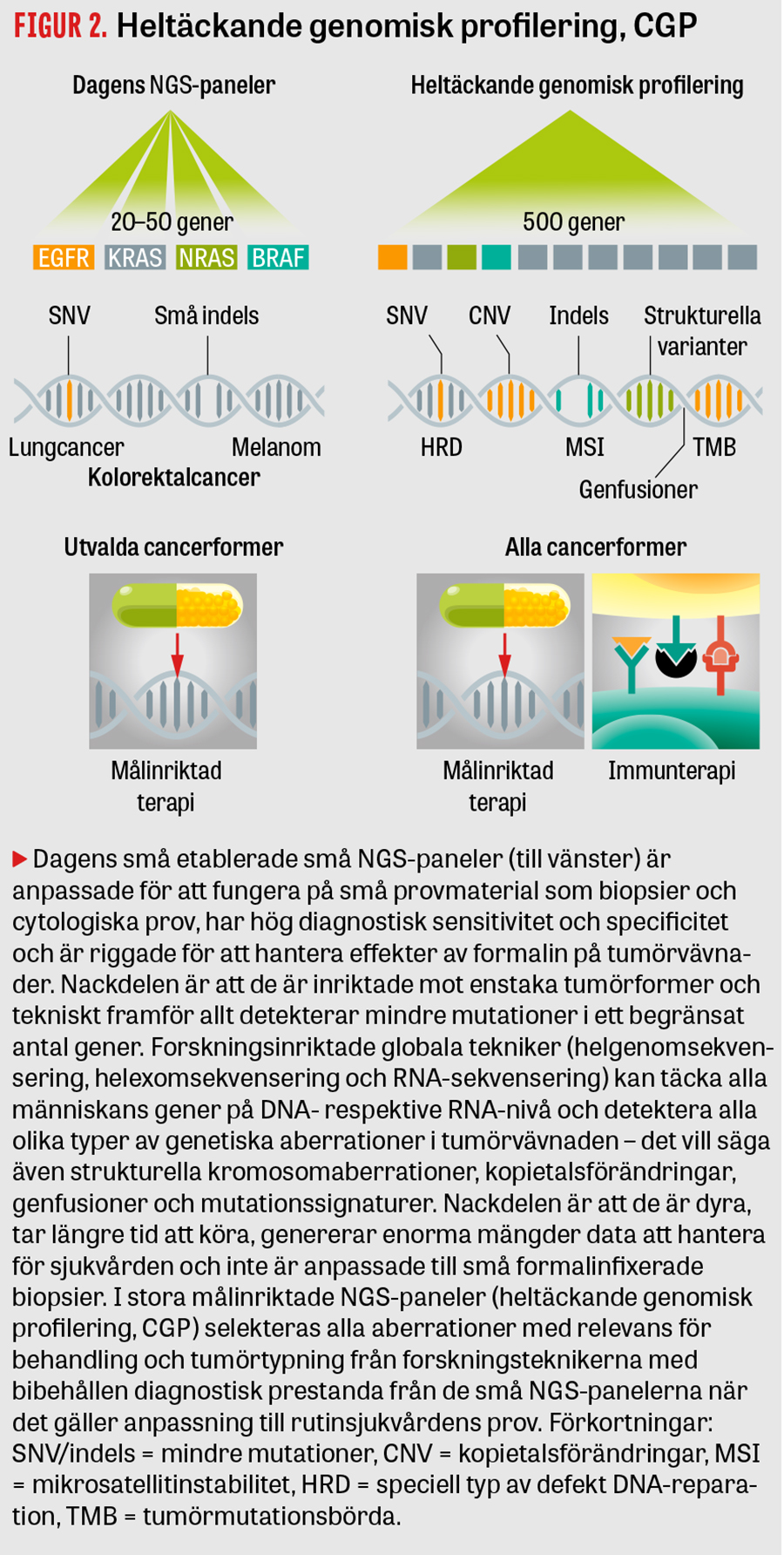
Det kunskapsmässiga språng som tagits vad gäller den grundläggande molekylära förståelsen av cancer, inte minst via projektet »The Cancer Genome Atlas« [4], har bidragit till en rad viktiga kunskapsdatabaser som COSMIC, cBioPortal och MyCancergenome och åtföljts av en snabb utveckling av nya målinriktade läkemedel. Utvecklingen har skapat ett behov av en analysmetod där man i samma test kan detektera alla kända måltavlor för läkemedelsbehandling och alla typer av molekylära förändringar som krävs för modern behandlingsprediktiv och prognostisk karakterisering av maligna tumörer. Dagens NGS-paneler som används i klinisk rutin är till sin omfattning mindre och vanligen inriktade på enstaka tumörformer, vilket är olämpligt om ett brett förutsättningslöst sökande efter behandlingsalternativ är önskvärt eller när tumördiagnosen är oklar. Målet med så kallad heltäckande genomisk profilering, CGP (comprehensive genomic profiling), ett koncept som lanserats på senare tid, är att i en analys kombinera den etablerade, riktade NGS-analysens fördelar med erfarenheter från en kombination av olika breda forskningsanalyser – och att samtidigt minimera nackdelarna med respektive analysstrategi (se Figur 2). De mest kända etablerade lösningarna för detta är CGP-panelerna MSK-IMPACT, FoundationOne, och TSO500 [5-7], där ca 350–500 gener analyseras med en och samma panel.
Genomic Medicine Sweden och solida tumörer
Det nationella initiativet för precisionsmedicin, Genomic Medicine Sweden (GMS, genomicmedicine.se/), började formeras 2017 och bedriver sedan 2018 ett koordinerat arbete med stöd från Vinnova. GMS bygger upp såväl en gemensam infrastruktur för analys och lagring av data som regionala genomiska medicincentrum, GMC, med landets sju universitetssjukhus som noder och universiteten på dessa orter som deltagande parter. Målen för GMS arbetspaket för solida tumörer inkluderar implementering av bred genpanelbaserad molekylär karakterisering av tumörer, analysmetoder för cirkulerande tumör-DNA samt en nationell harmoniserad struktur för multidisciplinära behandlingskonferenser för molekylär målinriktad terapi.
Längst har arbetet kommit med en DNA-baserad genpanel för analys av relevanta förändringar i 560 cancerassocierade gener. Urvalet av gener har i grunden gjorts utifrån kliniska behov, där konsensusdokument och kontakter med vårdprogramsgrupper varit viktiga. Utöver detta ingår gener där påvisade förändringar kan utgöra grund för inklusion i pågående studier, liksom gener av tumörbiologisk betydelse. Panelens storlek och design möjliggör även fastställande av mikrosatellitinstabilitet och tumörmutationsbörda [8], två frågeställningar som dagens generation av kliniskt använda NGS-paneler inte kan besvara och som får en ökande betydelse för att förutse svar på onkologisk immunterapi. En första version av en RNA-baserad genpanel för detektion av fusionsgener har också konstruerats och utvärderats under hösten 2020. Panelerna planeras för implementering vid alla regionala noder inom GMS under 2021.
Det kliniska värdet av bred precisionsdiagnostik
CGP kommer att spela en central roll inom patologin för förfinad molekylär subtypning av tumörer. Det har blivit uppenbart att den morfologiska klassifikationen av cancersjukdomar i många fall behöver kompletteras med genetisk profilering. Det gäller, utöver de maligniteter som karakteriserats molekylärt under en längre tid, även exempelvis hjärntumörer, ovarialcancer och bröstcancer. Den molekylära patologin kommer att påverka en allt större del av behandlingsbesluten inom onkologin. Inom en treårsperiod förväntas en lång rad nya läkemedel bli tillgängliga för behandlingar som är specifikt riktade mot molekylära rubbningar eller har mutationsmönster som underlag för behandling med immunstimulerande läkemedel.
Vår utvecklade CGP-panel för molekylär karakterisering kommer att användas i två kliniska studier: MEGALiT, som är inriktad på att hitta experimentell behandling för patienter som saknar fortsatta etablerade behandlingsalternativ [9], och PLUTO som är inriktad på att studera större svenska kohorter av lungcancerpatienter som behandlas med målinriktade läkemedel. Dessutom öppnar den nationella ansatsen mot bred molekylär profilering en möjlighet att länka en patients molekylära tumörprofil till kliniska data i landets cancerregister. Detta ger möjlighet att bedriva klinisk forskning på »real world data« och kan fungera som bas för hälsoekonomiska analyser vid införande och utvärdering av behandlingseffekten av nya riktade läkemedel och den kopplade diagnostiken.
Nya krav på sjukvården
En nationell satsning på IT-infrastruktur inom vården behövs för att hantera de stora datamängder som genereras vid bred molekylär tumörkarakterisering. Utvecklingen ställer också krav på nya yrkeskompetenser. Bioinformatiker, med en bakgrund inom både datavetenskap och molekylärbiologi, behövs för att analysera rådata från sekvensering i olika steg. Kliniska molekylärbiologer och sjukhusgenetiker finns redan inom sjukvården men ställs inför delvis nya och utmanande frågeställningar. Patologer behöver väga samman de alltmer komplexa molekylära fynden med all övrig information som histologi och immunhistokemi.
En utmaning som den molekylära patologin delar med modern radiologi är en oundviklig ökning av bifynd av varierande medicinsk relevans. Om inte vårdkedjan optimeras för att hantera dessa kan de möjligheter bred molekylär profilering erbjuder i stället komma att överskuggas av risken att överbelasta vården med onödiga utredningar och skapa svårhanterliga situationer för såväl patient som behandlande läkare. Nya analyser måste därför implementeras på ett genomtänkt sätt tillsammans med välstrukturerad information till patienterna [10, 11].
Behandlande kliniker måste också skaffa sig en allt större molekylär förståelse av cancersjukdomar för att kunna använda resultaten i rationella behandlingsbeslut för patienten. För mer svårbedömda fall kan den slutgiltiga medicinska tolkningen av svaret kräva multidisciplinära team bestående av patolog, molekylärbiolog och behandlande kliniker. En lösning är särskilda behandlingskonferenser, så kallade »molecular tumor boards«, som också i de fall där det inte finns etablerade behandlingsalternativ kan undersöka möjligheter till inklusion i kliniska prövningar.
Potentiella bindningar eller jävsförhållanden: Anders Edsjö har mottagit forskningsstöd från Amgen och Astra Zeneca samt ersättning för föreläsningar och deltagande i rådgivande kommittéer från Amgen, Astra Zeneca, Bayer, Diaceutics och Roche. Richard Palmqvist har mottagit arvode för föreläsning och deltagande i rådgivande kommittéer från Amgen och MSD. Gisela Helenius har mottagit forskningsstöd från Roche samt ersättning för föreläsningar och deltagande i rådgivande kommittéer från Astra Zeneca och Bayer. Johan Botling har mottagit forskningsstöd från Bristol-Myers Squibb och Illumina samt föreläsningsarvoden från Astra Zeneca, MSD, Roche, Pfizer, Bristol-Myers Squibb, Boehringer Ingelheim, Novartis och Illumina.
Per Levéen, Region Skåne, har sammanställt redovisade data kring genomförda analyser.
Fakta 1. Kliniska exempel
En man kom till akuten med svår andnöd. Utredning visade lungcancer med vätska i lungsäcken. NGS-analys visade att tumören innehöll en ovanlig mutation i EGFR (som hade missats med tidigare PCR-baserad diagnostik). Tablettbehandling med EGFR-hämmare gjorde att tumören krympte, vätskan i lungsäcken försvann och patienten återgick till sitt vanliga liv.
En kvinna hade en tumör av oklar typ i buken, så kallad CUP, cancer med okänt ursprung. En bred sekvenseringsanalys med stor CGP-panel visade att tumören hade så kallad mikrosatellitinstabilitet (MSI) och hög tumörmutationsbörda (TMB). Fynden gjorde att man ur ett molekylärt perspektiv kunde överväga tumörursprung i tjocktarm eller livmoder och att immunterapi kunde övervägas som ett av många onkologiska behandlingsalternativ.
En man med spritt malignt melanom hade flyttats till intensivvårdsavdelning på grund av organsvikt. Riktad snabbanalys av mutationer i BRAF gav positivt svar samma dag i väntan på den bredare NGS-analys som blev klar tre dagar senare och som gav en helhetsbild av tumörens molekylärgenetik. Behandling med BRAF-hämmare sattes in omedelbart och fick en god effekt.
(uppdaterad 2022-09-07)