Ett av de största problemen för många patienter är att de inte förbättras av läkemedelsbehandling. Detta orsakar, förutom lidande, stora samhällskostnader. Viktiga orsaker är sjukdomars molekylära komplexitet samt sen diagnostik och behandling.
Precisionsmedicin kan bidra till att lösa problem genom att karakterisera och tolka denna komplexitet. Ett exempel är att läkemedelsbehandling kan provas ut och individualiseras genom datorsimuleringar.
Precisionsmedicin har potential att påtagligt förbättra både hälsa och ekonomi. Detta kräver en bred IT-strategi för att integrera genomik- och andra storskaliga datakällor, som inkluderar nationella superdator-, visualiserings- och AI-centrum.
Trots stora biomedicinska framsteg erbjuds de flesta patienter standardiserade medicinska behandlingar som endast i begränsad utsträckning är anpassade till den enskilda patienten. Detta resulterar i begränsat terapisvar för många patienter. Enligt det amerikanska läkemedelsverket bedöms läkemedelsbehandling vara ineffektiv för 38–75 procent av alla patienter med komplexa sjukdomar [1]. Det resulterar i stort lidande samt höga kostnader för sjukvård, läkemedelsutveckling och produktionsbortfall. Ett aktuellt hälsoekonomiskt exempel är att en minskning med bara 10 procent av patienter med diabetes och hjärtsjukdomar som inte svarar bra på medicinering skulle medföra en årlig kostnadsbesparing på 200 miljarder dollar i USA [2]. En viktig orsak till bristande behandlingssvar vid komplexa sjukdomar är deras multifaktoriella orsaksmekanismer, som kan bero på olika kombinationer av arv- och miljöfaktorer. Varje sjukdom kan vara associerad med förändrad samverkan mellan tusentals gener i miljarder enskilda celler. Dessutom kan mekanismerna skilja sig mellan två patienter med samma diagnos. Det finns en stor klyfta mellan denna komplexitet och modern sjukvård. Precisionsmedicin kan bidra till att överbrygga denna klyfta genom avancerade metoder för helgenomanalyser av sjukdomsassocierade förändringar i till exempel DNA, DNA-metylering, mRNA, mikro-RNA, proteiner och lipider; sådana metoder samlas under namnet »omik«. Målet med precisionsmedicin är att specifikt behandla en enskild patients molekylära förändringar.
Ytterligare en orsak till bristande behandlingssvar är att sjukdomar kan utvecklas långsamt under många år innan de ger symtom och patienten får diagnos och behandling. Sjukdomen blir då alltmer svårbehandlad. Dessutom ökar risken att patienten utvecklar andra sjukdomar. Detta kan förklara varför multisjuka äldre står för 50 procent av sjukvårdskostnaderna i dag [3]. En idealisk lösning vore att tidigt kunna förutsäga och förhindra sjukdom, kanske redan i barndomen. Detta ideal sammanfattas i begreppet 4P-medicin (prediktiv, preventiv, personanpassad och patientdeltagande) [4].
Det här kommer att innebära stora utmaningar. En av de främsta är förståelse av den biologiska komplexiteten och de tekniker som behövs för detta, som användarvänliga visualiseringsverktyg för att patient och läkare gemensamt ska kunna fatta informerade beslut för att förhindra eller behandla sjukdom på ett individualiserat sätt. Till detta behövs ett nytt sätt att tänka, och även nya samarbeten med till exempel konstvetare, datorspelsexperter och konstnärer. Detta kan leda till en stor förbättring av sjukvården, men medför även tekniska, etiska, organisatoriska, sociala och regulatoriska utmaningar [5, 6]. Ett viktigt exempel på tekniska utmaningar är kapacitet för att lagra, harmonisera och integrera mycket stora och heterogena data från olika medicinska register samt bio-, bild- och omikbanker. Sverige har unika möjligheter att ta en ledande roll genom att integrera nationella organisationer för precisionsmedicin, superdatorer, artificiell intelligens (AI), visualisering och biobanker, i samverkan mellan sjukvård, universitet och industri. Genomic Medicine Sweden (GMS) är ett viktigt nationellt initiativ som syftar till sådan integration.
Potential och problem med klinisk implementering
Nyligen beskrevs i en debattartikel i Läkartidningen en svensk patient med bröstcancer som rekommenderats behandling med strålning, cytostatika och aromatashämmare. Eftersom litteraturstödet för att cytostatika skulle ge behandlingsvinst var begränsat, hade hon själv identifierat ett kommersiellt amerikanskt genexpressionstest som skulle visa om hon behövde sådan behandling. Dock hade Socialstyrelsen bedömt att testets vetenskapliga underlag inte var tillräckligt för att finansieras av sjukvården. Hon beslöt därför, i samråd med sin svenske onkolog, att själv bekosta testet (ca 4 000 dollar). Detta ledde till att hon avstod från cytostatika. Författaren argumenterade för att testets vetenskapliga stöd var tillräckligt för att det skulle bekostas av sjukvården [7]. Eftersom utbudet av omikbaserade kommersiella test kommer att öka inom de närmaste åren [7] är det viktigt att svenska läkare och beslutsfattare redan nu börjar diskutera både potentiell patientnytta och problem. Hur ska en enskild läkare, inom ramen för en pressad klinisk verksamhet, kunna förstå och värdera sådana komplicerade test i samråd med sin patient? Hur ska nya test systematiskt identifieras, utvärderas, bekostas och göras tillgängliga på ett jämlikt sätt? Vem tar ansvaret om en internationell vårdgivare har fel? Kommer precisionsmedicin att minska eller öka sjukvårdskostnaderna?
Ett annat exempel på klinisk implementering beskrevs nyligen i Nature Medicine [8]. En patient med en allvarlig hudsjukdom, DRESS (drug reaction with eosinophilia and systemic symptoms), förbättrades inte trots sedvanlig behandling. Detta ledde läkarna till att analysera hudbiopsier från patienten med hjälp av så kallad encells-RNA-sekvensering (scRNA-seq), vilket innebär helgenomanalys av mRNA-uttryck i var och en av tusentals enskilda celler. Liksom vid många andra immunologiska sjukdomar fann man tusentals sjukdomsassocierade mRNA-uttryck i flera olika celltyper [9]. Med bioinformatiska metoder identifierades sjukdomsassocierade signalvägar i erhållna data, och författarna valde empiriskt en signalväg, nämligen JAK-STAT, för vilken det fanns en specifik medicin (Figur 1).
Encells-RNA-sekvensering har stora fördelar jämfört med så kallade bulkanalyser, där alla celler i en biopsi analyseras tillsammans (Figur 2) [10]. Detta belystes av en aktuell fallbeskrivning av en patient med blåscancer som inte svarade på sedvanlig behandling. Analys med encells-RNA-sekvensering av alla celler i tumören indikerade att uppreglering av en immunsupprimerande ligand (PD-L1) i överlevande tumörceller ledde till minskat immunsvar. Detta ledde i sin tur till behandling med en PD-L1-hämmare (atezolizumab) och minskad tumörtillväxt [11]. Nyligen diskuterades hur encells-RNA-sekvensering kan bli lika självklar för högupplöst molekylär diagnostik som i dag avancerade visualiseringsmetoder som MR och DT [10]. Även om kostnaderna för encells-RNA-sekvensering fortfarande är mycket höga är det rimligt att anta att de kommer att minska exponentiellt, och kanske redan nu är lägre än för sjukvård och produktionsbortfall [10]. Lyckade beskrivningar finns av hur genomtäckande bulkanalyser av DNA använts för precisionsmedicin vid cancer och ovanliga sjukdomar [12, 13]. Sådana framgångar har inspirerat strategiska internationella precisionsmedicinska satsningar [14].
Klinisk implementering av precisionsmedicin vid cancer kompliceras dock av att många tumörer inte har genetiska förändringar mot vilka det finns specifika läkemedel eller av att samma tumör kan innehålla flera olika mutationer, vilkas relativa roller är oklara. Det behövs därför metoder för att prioritera de viktigaste förändringarna i en tumör, och kanske också för att finna kombinationsbehandlingar riktade mot sådana förändringar, som i det ovan beskrivna exemplet med blåscancerpatienten. Det har även argumenterats för att de mest effektiva medicinerna inte är riktade mot mekanismer som orsakas av genetiska förändringar [12, 15]. Detta har lett till ökat intresse för andra omikanalyser, till exempel av mRNA, mikroRNA, DNA-metylering och proteiner. Till exempel visade en aktuell studie av T-celler i perifert blod ändrat mRNA-uttryck av tusentals gener vid flera olika immunologiska, kardiovaskulära, metabola och maligna sjukdomar [16]. Till denna komplexitet tillkommer att många olika celltyper är inblandade i tumörer och andra sjukdomar. Var och en av dessa kan uttrycka mRNA för tusentals gener, som motsvarar hundratals kända biomarkörer och mediciner. Är det möjligt att finna en medicin som botar så komplexa förändringar? Behandlingen av patienten med DRESS byggde på att läkarna empiriskt valde mellan mediciner som var riktade mot enstaka gener. Det framgick inte hur viktig den valda genen var relativt alla andra av de tusentals generna.
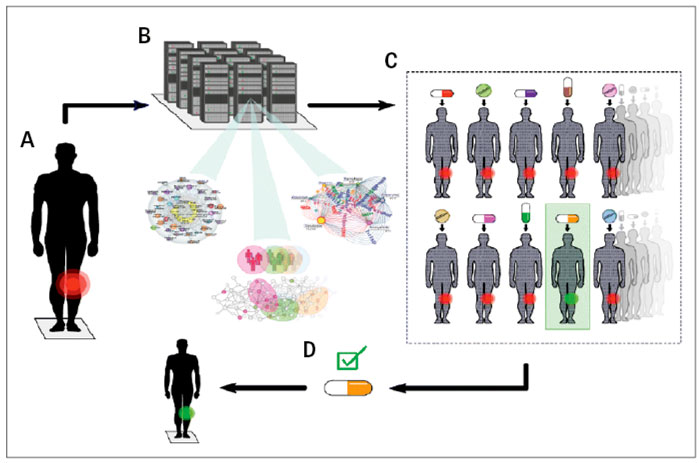
Aktuell forskning visar på möjliga lösningar. En systematisk strategi för precisionsmedicin baserad på encells-RNA-sekvensering beskrevs nyligen [16]. Den byggde på ett gränsöverskridande samarbete mellan svenska, spanska, sydkoreanska och amerikanska forskare. De senare är verksamma vid Massachusetts Institute of Technology och utvecklade en encells-RNA-sekvenseringsmetod för precisionsmedicin [10]. I korthet byggde strategin på att konstruera en datormodell av encells-RNA-sekvenseringsdata från en musmodell av artrit. Med datorns hjälp behandlades modellen med tusentals godkända mediciner. De mediciner som datorbehandlingen förutspådde var mest effektiva var redan kända för artritbehandling, förutom en som var avsedd för att sänka blodfetter och som är både billig och har få bieffekter. I nya musförsök visades den nästan helt bota artriten. Det ledde till målsättningen att skapa och datorbehandla så kallade digitala tvillingar av enskilda patienter med hjälp av encells-RNA-sekvensering och andra storskaliga data.
Begreppet digitala tvillingar är väletablerat inom teknologisk forskning och industri. Syftet är att optimera utvecklingen av komplicerade strukturer, som flygplan eller hela städer. Tvillingarna är högupplösta datormodeller som används för att testa effekter av yttre hot eller lösningar. Detta är effektivare, billigare och enklare att genomföra än på de verkliga strukturerna. Överfört till precisionsmedicin kanske en patients digitala tvilling kan datorbehandlas med tusentals läkemedel för att välja ut det som mest precist påverkar patientens sjukdomsmekanismer (Figur 3). Förutom den precisionsmedicinska fördelen kan tiden mellan diagnos och effektiv behandling kortas – i dagens sjukvård krävs ofta en stegvis utprovning av läkemedel. En annan viktig fördel kan bli individualiserade kombinationsbehandlingar till multisjuka patienter. Dessutom kanske digitala tvillingar kan användas för att förutsäga och förhindra sjukdomar samt biverkningar [17]. Ett svenskt konsortium för att skapa och datorbehandla digitala tvillingar för att kliniskt implementera precisionsmedicin har startats (Swedish Digital Twin Consortium, SDTC) [17]. Konsortiet inkluderar läkare, specialister på encells-RNA-sekvensering, bioinformatiker och experimentalister från Chalmers, Linköpings universitet, Karolinska institutet samt Uppsala universitet. Dessutom ingår etikexperter samt industriella representanter. SDTC är också kopplat till ett europeiskt och ett nordiskt konsortium för 4P-medicin.
Implementering kräver helhetsbild
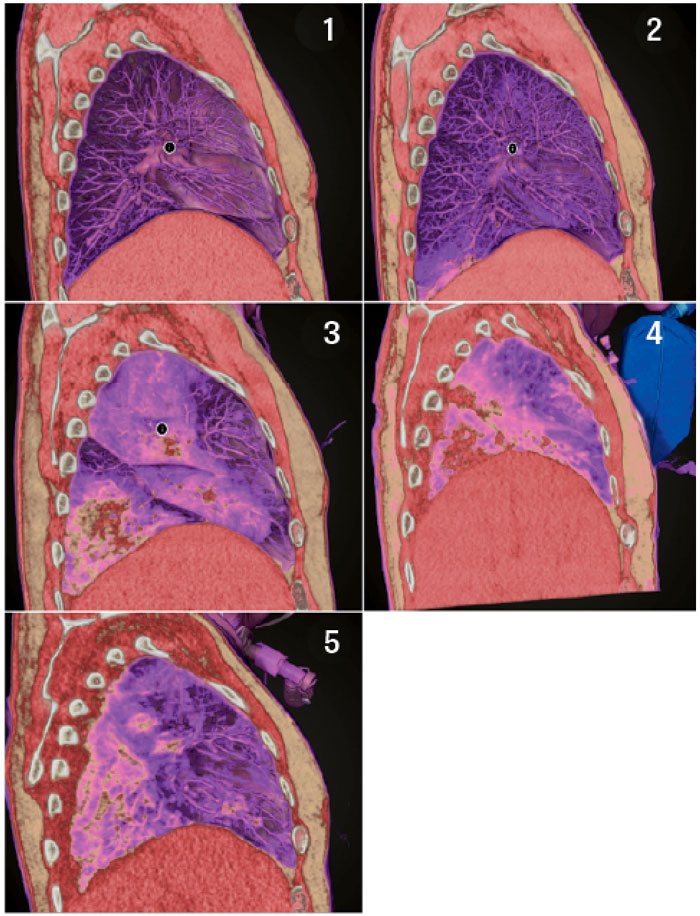
En grundläggande förutsättning för klinisk implementering av precisionsmedicin är att man har tillgång till en helhetsbild av patientens sjukdom som innefattar data som ålder, kön, samsjuklighet, psykosociala faktorer och omgivningsfaktorer. Ett aktuellt exempel är att morbiditeten vid covid-19 ökar med stigande ålder, manligt kön, fetma och rökning. Därför måste de komplexa molekylära modellerna i en digital tvilling för just covid-19 integrera denna typ av information samt även olika medicinska undersökningar. Exempelvis kan datortomografi bidra till att undergruppera patienter med samma diagnos. Vid covid-19 kan datortomografi tidigt identifiera och följa patienter med lungförändringar (Figur 4). Bilderna är valda för att lyfta fram två möjliga fördelar med avancerade medicinska bildtekniker: 1) tidig diagnostik av förändringar, kanske till och med före symtom, och 2) att ett helt sjukdomsförlopp kan karakteriseras. Om även de underliggande molekylära förändringarna kunde beskrivas skulle ett idealscenario vara att bild- och omikdata integreras för 4P-medicin. Aktuell forskning talar till exempel för att molekylära signaturer vid covid-19 kan användas för tidig prediktion och prevention av allvarlig sjukdom [18]. Ett annat idealscenario skulle kunna vara att datorbehandla digitala tvillingar av covid-19-patienter genom att integrera visualiserings- och omikdata. Ett generellt problem med tidig diagnostik är dock att många sjukdomar kan utvecklas under långa perioder före symtomdebut och diagnos. Detta medför alltmer svårbehandlade molekylära förändringar. Helgenomanalyser av DNA kan dock öka möjligheten att förutsäga vilka individer i kända riskgrupper som kommer att utveckla sjukdom [19].
En annan möjlighet att identifiera molekylära markörer för tidig diagnos är att konstruera matematiska modeller av hur geninteraktioner förändras under ett sjukdomsförlopp. En sådan modell skulle kanske kunna användas för att förutse och förhindra tidiga sjukdomsförändringar i T-lymfocyter från patienter med många olika komplexa sjukdomar [20] (Figur 5). I kombination med andra kliniska och storskaliga data pekar T-cellsanalyserna på ett utvidgat idealscenario: varje frisk individ får en egen digital tvilling för att förutspå och förhindra sjukdom. Detta leder till den andra viktiga förutsättningen för klinisk implementering av precisionsmedicin: att informerade beslut måste ske i samråd mellan patient och läkare. Det är närmast en självklarhet i dagens sjukvård, men blir en stor utmaning vid precisionsmedicin på grund av de komplexa mekanismerna vid vanliga sjukdomar. Hur ska en läkare få överblick av sådana mekanismer och kunna diskutera dem med en patient för informerade beslut? Vi ser framför oss en visuell 3D-representation av patienten med hyperlänkad information till sjukdomsmodeller som representerar olika möjliga utfall av behandlingar och progression av sjukdom. För att göra dessa modeller tillgängliga och attraktiva för patienter tror vi att utformningen av modellerna kommer att gynnas av nya konstellationer, där till exempel konstnärer och konstvetare ingår. Ett tidigt exempel är att Karolinska institutet och Kungliga Musikhögskolan samarbetar för att implementera musikteori och musikalisk gestaltning i medicinsk forskning och sjukvård. Bland annat diskuteras hur musikteoretiska principer och konst kan användas för att strukturera och gestalta komplexa och dynamiska molekylära sjukdomsförlopp. Musikteoretiska analyser har tidigare tillämpats i relation till kognitiv analys och syntax, men ännu inte använts som underlag till en förklaringsmodell inom precisionsmedicin.
AI kan integrera många typer av data
Artificiell intelligens (AI), och specifikt maskininlärning, är en av de mest lovande teknikerna för att hantera komplexa mängder av omik- och andra storskaliga data samt automatisera skapandet av till exempel digitala tvillingar, förutse progression och föreslå behandlingar. Här kan visualisering komma att spela en viktig roll för den fortsatta utvecklingen och acceptansen av AI. Genom satsningar på ett nationellt superdatornätverk, SNIC (Swedish National Infrastructure for Computing), WASP (Wallenberg AI, Autonomous Systems and Software Program), samt AI Sweden, har Sverige positionerat sig väl inom AI. Genom en donation från Knut och Alice Wallenbergs stiftelse kommer Linköpings universitet inom kort att kunna erbjuda resurser för maskininlärning i absolut världsklass. AI har också en viktig roll inom en aktuell satsning av Knut och Alice Wallenbergs stiftelse på datadriven livsvetenskap.
Hörnstenar för klinisk implementering
Allvaret i de underliggande medicinska problemen samt de diagnostiska och terapeutiska möjligheter som beskrivits ovan talar för att klinisk implementering av precisionsmedicin kan bidra till att nå 4P-idealet. Det europeiska konsortiet Icpermed (International Consortium for Personalised Medicine) publicerade nyligen en vision för hur detta ideal kommer att innebära genomgripande förändringar av hälso- och sjukvård inom det närmaste decenniet [5]. Dessa förändringar kan väsentligt minska kostnader för läkemedel, vård och produktionsbortfall. Detta innebär dock betydande medicinska, tekniska, etiska, organisatoriska, regulatoriska och hälsoekonomiska utmaningar, vilka kommer att kräva expertis inom alla dessa områden. Icpermed identifierade fem hörnstenar som möjliggör klinisk implementering av precisionsmedicin:
- Informerade, ansvarstagande och engagerade medborgare behövs för informerat samråd mellan patient och vårdgivare. Detta kräver lättillgänglig, korrekt och förståelig medicinsk information.
- Informerade, ansvarsfulla och engagerade vårdgivare behövs för säker, ansvarstagande och optimal användning av medicinsk information i klinisk rutin. Detta förutsätter att klinisk forskning och praxis samt utbildning bygger på tvärvetenskaplig samverkan, som integrerar molekylär, omik-, digital, etisk och regulatorisk expertis.
- Hälso- och sjukvårdssystem behöver organiseras för jämlik tillgång till precisionsmedicin. Detta kan kräva stora organisatoriska och regulatoriska förändringar, som dessutom tar hänsyn till nya privata vårdgivare, som multinationella IT-företag, på ett kontrollerat och säkert sätt.
- Medicinska data ska vara tillgängliga för både klinik och forskning. Detta kräver att sådana data digitaliseras för säker tillgång som är anpassad till patienter, vårdgivare och forskare.
- Hälsoekonomiska analyser och strategier behövs. Detta kräver balans mellan hälsovinster, etiska och sociala aspekter samt kostnader.
Sammanfattning
De enorma medicinska, ekonomiska och samhälleliga problem som uppstår till följd av att läkemedelsbehandling är ineffektiv för många patienter understryker behovet av nya diagnostiska och terapeutiska lösningar för 4P-medicin. Precisionsmedicin har stor potential att bidra till en förbättrad sjukvård. Detta innebär betydande utmaningar som kommer att kräva både nationell och internationell samverkan.
Bo Jacobsson, Erik Melén och Mikael Benson ingår i arbetsgruppen Komplexa sjukdomar, Genomic Medicine Sweden. Mikael Benson har anslag från Vinnova (Nora-projektet).
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.





![Figur 1. Individualiserad medicinering med hjälp av encells-RNA-sekvensering (scRNA-seq). 1–3) Hudbiopsi från en patient med en allvarlig hudsjukdom analyserades med encells-RNA-sekvensering [8]. 4) Detta resulterade i identifiering av tusentals gener som skiljer sig i mRNA-uttryck i var och en av tusentals olika celler jämfört med frisk hud. Dessa analyserades av läkare för att 5) identifiera en medicin som var avpassad till patientens mRNA-uttryck. 6) Denna medicin botade patienten. Bild: Danuta Gawel](https://lakartidningen.se/wp-content/uploads/2021/04/wFig1-4.jpg)
![Figur 2. Idealiserad illustration av fördelar med encells-RNA-sekvensering jämfört med bulk-RNA-sekvensering. A) Bulk-RNA-sekvensering av alla celler i en tumör som innehåller tre olika tumörcellskloner resulterar i en genomsnittsklon. En känd medicin påverkar bara en av de tre klonerna och botar därför inte tumören. B) Encells-RNA-sekvensering identifierar alla tre klonerna samt biomarkörer och precisionsmediciner för dessa. Detta resulterar i att tumören botas. Bild från [10], med tillstånd från Alex Shalek, MIT, samt Science Translational Medicine.](https://lakartidningen.se/wp-content/uploads/2021/04/wFig2-1.jpg)
![Figur 5. En matematisk modell av T-cellsaktivering för tidig diagnostik av komplexa sjukdomar. 1) T-celler patrullerar ständigt hela kroppen för att tidigt upptäcka och bekämpa sjukdom. 2) Vid tidig eller symtomfri sjukdom aktiveras tidiga regulatorer (gula prickar). Dessa aktiverar 3) symtomframkallande gener (blåröda prickar), vilka till skillnad från de tidiga regulatorerna är lätta att identifiera hos patienter när de får symtom och söker sjukvård. 4) För att identifiera tidiga regulatorer konstruerades en matematisk modell av T-cellsaktivering byggd på omikanalyser av aktiveringsprocessen in vitro. 5) De tidiga regulatorerna visades ha potential för tidig diagnostik i studier av T-celler från symtomfria patienter med allergi och MS [19]. Eftersom T-celler är engagerade vid flertalet inflammatoriska, metabola och kardiovaskulära sjukdomar kan principerna vara generellt applicerbara på komplexa sjukdomar. Bild: Danuta Gawel](https://lakartidningen.se/wp-content/uploads/2021/04/wFig5.jpg)



















