Både överdriven opioidrädsla och opiocentrism (att på ett överdrivet sätt ställa opioider i centrum för smärtvården) kan skada patienten. En klok användning av opioider handlar om att undvika dessa båda extremer.
Smärta är ett mångfasetterat fenomen. Stereotyp förskrivning ska undvikas.
Smärtanalysen är grunden för en adekvat förskrivning.
Är smärtan akut, långvarig eller cancerrelaterad? Nociceptiv, neuropatisk eller nociplastisk?
Beakta biologiska, psykologiska/psykiatriska och sociala/kontextuella aspekter.
Det är i allmänhet olämpligt att behandla långvariga nociplastiska smärttillstånd som exempelvis fibromyalgi, IBS eller »ospecifik« ryggvärk med opioider.
Opioiderna hör till våra äldsta läkemedel och berusningsmedel. Vi har i Sverige i dag 18 olika substanser registrerade som läkemedel för behandling av smärta, opioidberoende, hosta eller diarré (Tabell 1). I en artikel i Läkartidningen 2017 beskrev vi hur expediering av recept på opioider för smärtbehandling förändrades i Sverige 2000–2015. Årsprevalensen, mätt som antalet individer per tusen invånare som minst en gång under ett år expedierades en opioid, var i stort sett konstant över perioden. Däremot hade ett markant skifte skett inom gruppen opioider. Efter att tramadol narkotikaklassades 2007 och dextropropoxifen avregistrerades 2011 hade antalet patienter som fått andra opioider, framför allt oxikodon, ökat kraftigt. Samtidigt hade årsmängden oxikodon per behandlad patient ≥30 år mer än halverats, vilket kunde tolkas som att patienter med kortvarig smärta utgjorde en större andel än tidigare [1].
En uppföljande analys visar att årsprevalensen för opioider för smärtbehandling (ATC-kod N02A) under perioden 2015–2020 minskade hos patienter ≥30 år från 112 till 92 individer per 1 000 invånare och år, det vill säga en minskning med 17 procent [2]. Samtidigt har det tidigare beskrivna skiftet i val av opioid förstärkts, med en fortsatt stigande årsprevalens för oxikodon och en minskande för morfin, tramadol och kodein (Figur 1).
En välfungerande sjukvård förutsätter en adekvat användning av opioider för smärtlindring. Utgångspunkten för denna artikel är att varken överdriven rädsla för opioider eller en övertro på opiodernas plats i smärtbehandlingen (opiocentrism) är förenligt med smärtvård enligt vetenskap och beprövad erfarenhet. Hur finner man en förnuftig balans mellan dessa två extremer?
Smärtanalysen – grunden för en klok opioidanvändning
Smärta är ett heterogent och mångfasetterat fenomen, och förskrivningen måste alltid anpassas efter både individen och situationen. För att kunna skräddarsy sin förskrivning är det avgörande med en smärtanalys, som bör kunna utföras av alla läkare som möter patienter med smärta [3-6]. Mötet med en smärtpatient skiljer sig inte på något avgörande sätt från andra konsultationer: anamnesen inhämtas i en öppen och interaktiv dialog med patienten, patienten undersöks, och det hela resulterar i en medicinsk bedömning med åtföljande planering. I engelskspråkig litteratur ges olika akronymer, vars innebörd kan vara till hjälp för vilka frågor som kan och bör ställas, till exempel WILDA (words to describe pain: intensity, location, duration, aggravating and alleviating factors) [7-10]. Förutom genom allmän anamnestisk nyfikenhet kommer man annars långt genom att fråga när, var, och hur det känns när det gör ont [6].
Ett ramverk som jag själv utgår ifrån när jag sammanfattar min smärtanalys omfattar tre nyckelområden, som vartdera kan delas in i tre delar: 1) är smärtan akut, kronisk eller cancerrelaterad? 2) är smärtan nociceptiv, neuropatisk eller nociplastisk? 3) hur ser samspelet ut mellan biologiska, psykologiska och sociala aspekter? Jag kallar detta ramverk för »Smärtanalys 3 × 3« (Figur 2). Därtill bör beslutet att behandla med en opioid eller inte, samt valet av vilken opioid som är mest lämplig, baseras på en individualiserad risk–nyttabedömning som grundas i kunskap om behandlingens biverkningar och risker; detta kommer också att tas upp nedan.
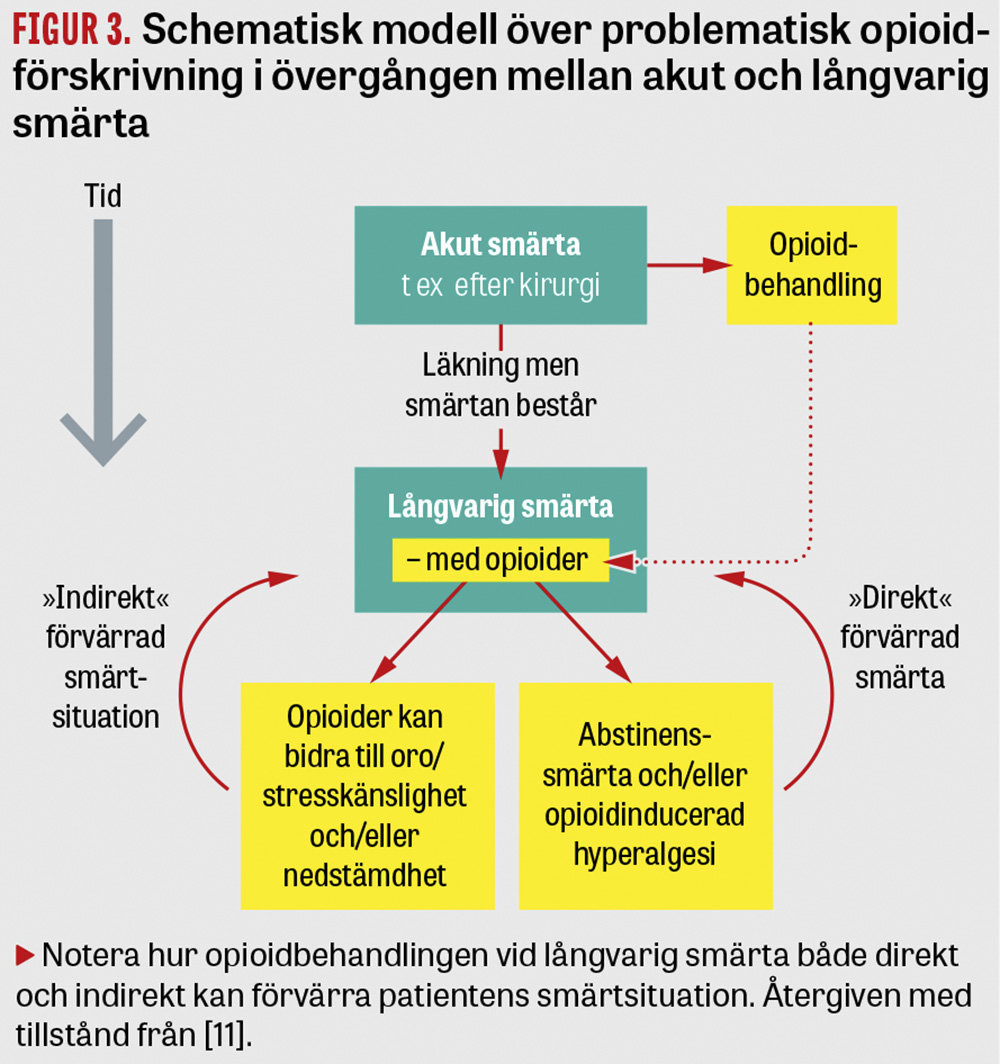
Akut, långvarig eller cancerrelaterad smärta? Vi börjar med distinktionen mellan akut, långvarig och cancerrelaterad smärta. I all sin enkelhet är uppdelningen till stor klinisk hjälp när det gäller opioidfrågan. Efter ett akut trauma, till exempel upp till kanske någon vecka efter en operation, är användning av opioider ofta en självklarhet. Men ju längre tid som gått efter traumat, desto mer minskar indikationen att behandla med opioider, och när smärtan blivit långvarig (>3 månader) bör man som förskrivare sedan länge ha tänkt till. Opioidbehandlingen i övergången mellan akut och långvarig smärta är ett svårt område, och problematiken sammanfattas schematiskt i Figur 3, som illustrerar hur en initialt oproblematisk förskrivning av opioider i en akut postoperativ smärtsituation övergår till en problematisk långtidsförskrivning i takt med att smärtan kronifieras. Det faktum att smärtan efter operation inte går över tas av förskrivaren som intäkt för att förskrivningen ska fortgå, inte sällan dessutom i en ökande dosering. Efter några månader befinner sig patienten i en situation med smärta och långvarig opioidförskrivning, och den senare kan både direkt och indirekt försvåra smärtsituationen. För att undvika en sådan utveckling har införandet av »transitional pain services« lyfts fram [12, 13], där tanken är att nogsamt följa patienten efter kirurgi för att säkerställa nedtrappning av opioider samtidigt som bästa möjliga smärtlindring bibehålls.
Vid långvarig smärta är indikationen för opioider i allmänhet svag, dels på grund av tveksamma effekter på smärtintensitet och funktion, dels på grund av behandlingens risker. Långvarig smärta är inte detsamma som akut smärta utsträckt i tiden. Kortfattat kan sägas att smärtan (i övergången mellan akut och långvarig) ofta går från att vara endast ett symtom till att bli en sjukdom i sig (förutsatt att ingen postoperativ komplikation föreligger). Man kan säga att även smärtsinnet kan bli sjukt, och för denna typ av smärta är opioider ofta olämpliga. Det betyder inte att man aldrig på goda grunder kan förskriva opioider vid långvarig smärta. Aktuella riktlinjer gällande farmakologisk behandling av långvarig smärta finns i Läkemedelsverkets rekommendationer från 2017 [14]. I den kommande elfte versionen av International Classification of Diseases (ICD-11, ännu ej översatt till svenska) har långvarig smärta blivit en egen diagnoskategori (chronic pain, MG30) med sju undergrupper av diagnoser [15].
Cancerrelaterad smärta betraktas traditionellt som en egen kategori. Smärtan kan vara både akut och långvarig. Cancersmärta där själva tumörbördan ger upphov till svår smärta är en klassisk och viktig indikation för opioidbehandling. Men även här finns gråzoner. De senaste årtiondenas utveckling inom onkologin har lett till att cancer i dag inte sällan kan ses som en kronisk sjukdom. Att oreflekterat »vräka på« med opioider enbart på grundval av en cancerdiagnos kan därför vara problematiskt, inte minst om patienten anses botad och smärtan snarare är sekundär till given onkologisk behandling, till exempel cytostatikainducerad smärtsam polyneuropati.
Nociceptiv, neuropatisk eller nociplastisk smärta? Förenklat kan man säga att det finns en klinisk gradient inbyggd i den trefaldiga distinktionen mellan nociceptiv, neuropatisk och nociplastisk smärta: indikationen för opioider är i allmänhet lägst vid nociplastisk smärta, något högre vid neuropatisk smärta, och högre vid nociceptiv smärta.
Nociceptiv smärta är den »vanliga« smärtan associerad med en vävnadsskada.
Vid neuropatisk smärta finns däremot en nervskada som orsak, och att kliniskt identifiera neuropatisk smärta [6, 16, 17] är viktigt, eftersom det finns behandlingsmässiga implikationer (användning av vissa antidepressiva på smärtindikation – amitriptylin, duloxetin – samt behandling med gabapentinoider [14, 16] eller, i vissa fall, invasiva behandlingar som exempelvis ryggmärgsstimulering [18].
Nociplastisk smärta är ett relativt nytt begrepp [19] som tillkommit eftersom dikotomin nociceptiv/neuropatisk inte passar in på de flesta patienter med långvarig smärta [6]. Typiska nociplastiska smärttillstånd är generaliserad smärta/fibromyalgi, ospecifik ryggvärk och IBS – det vill säga tillstånd där varken vävnadsskada i klassisk bemärkelse eller nervskada föreligger. I stället har nervsystemet blivit överkänsligt och signalerar för smärta, utan underliggande vävnadsskada. Intensiv forskning pågår rörande de biologiska mekanismerna som ligger bakom denna centrala hyperexcitabilitet; till exempel verkar kronisk inflammation/neuroinflammation finnas med i bilden [20].
Sammantaget är indikationen för opioider i allmänhet starkare för akut nociceptiv smärta, medan den är svagare för nociplastisk smärta (som nästan definitionsmässigt är långvarig [19]). Men det är viktigt att också väga in det tredje nyckelområdet.
Den biopsykosociala modellen. De föregående nyckelområdena handlar i mångt och mycket om ett antingen–eller, till exempel om att ta ställning till om smärtan ska betraktas som akut eller långvarig. Gällande den biopsykosociala modellen handlar det inte om att välja mellan någon av de tre ingående delarna (bio/psyko/social), utan att i varje enskild situation ta hänsyn till alla tre komponenterna och hur de interagerar. Förutom sedvanliga biomedicinska aspekter behöver smärtanalysen således även innehålla ett ställningstagande till hur psykologiska, sociala och kontextuella aspekter påverkar helheten i patientens livssituation, funktion och beteende [21, 22]. Ett exempel kan vara det svåröversatta begreppet »self-efficacy«, som handlar om patientens tilltro till den egna förmågan att påverka sin situation. En närmare genomgång av detta och andra för smärtmedicinen viktiga begrepp (till exempel konceptet psykosociala »gula flaggor«) faller utanför ramen för denna artikel, men kortfattade beskrivningar finns tillgängliga i aktuell svensk litteratur [6]. Att psykologiska fenomen realiseras biologiskt i hjärnan torde de flesta vara överens om, och inom ramen för den biopsykosociala modellen behöver man således inte alls vara »dualistisk« gällande förhållandet mellan »kropp och själ«. Det föreligger en påtaglig samsjuklighet mellan långvarig smärta och depression, ångest och PTSD [23]. Psykisk sjukdom är en påtaglig riskfaktor för att patienten ska hamna i ett problematiskt bruk av opioider, och därför kan man sammantaget säga att indikationen för opioider i allmänhet är lägst för långvariga nociplastiska smärttillstånd med en påtaglig psykisk samsjuklighet och/eller psykosocial sårbarhet.
Ett ställningstagande till förskrivning av opioider, inte minst när det gäller långvarig smärta, förutsätter således att man tar hänsyn till helheten i patientens situation, inklusive hennes eller hans förmåga (eller bristande förmåga) att påverka sin egen situation. Att förskriva är inte en värdeneutral handling, utan det är en kraftfull signal som påverkar patientens beteende och uppfattning av situationen. Man bör därför reflektera över möjliga konsekvenser av själva förskrivningsakten.
Opioidbehandlingens biverkningar och risker
Ovanstående ramverk är tre viktiga verktyg man kan använda sig av i sin smärtanalys för att undvika både opioidrädsla och opiocentrism.
Det finns dock många andra aspekter som också måste beaktas gällande den specifika frågan om opioidförskrivning. För att fatta ett välgrundat beslut måste man till exempel känna till vilka risker och biverkningar den tänkta behandlingen har och väga in dem i en analys om risk kontra nytta. Viktiga biverkningar finns listade i Fakta 1.
Det finns också skillnader mellan olika opioider gällande egenskaper, beredningar och användningsområden. Exempelvis har Läkemedelsverkets rekommendationer slagit fast att fentanylplåster i allmänhet är olämpliga att använda vid långvarig icke-cancerrelaterad smärta. Morfin kan ha en förlängd verkningstid vid nedsatt njurfunktion, medan oxikodon och fentanyl är förknippade med högre risk för läkemedelsinteraktioner [14].
I Fakta 2 återges riskfaktorer för beroendeutveckling och opioidbrukssyndrom enligt Läkemedelsverkets rekommendationer [14], och dessa måste beaktas innan man initierar en opioidbehandling (framför allt, men inte enbart, vid långvariga smärttillstånd). Som redan har påpekats är psykisk samsjuklighet (inklusive beroendesjukdom) en påtaglig riskfaktor för att patienten ska hamna i ett problematiskt bruk av opioider. Läkemedelsverket lyfter även fram ung ålder som en riskfaktor (se Fakta 2), och man skriver i sina rekommendationer att man bör vara särskilt restriktiv med behandling med opioider till yngre personer [14].
Behandlingsmål och uppföljning
Som vid all behandling behöver effekt och biverkningar följas upp, initialt lämpligen redan efter 2–4 veckor [14]. Det är viktigt att utvärdera effekt avseende inte bara smärtintensiteten, utan också avseende funktion och livskvalitet: vad kan patienten göra nu som han/hon inte kunde göra innan behandlingen påbörjades? Det är centralt att förskrivare och patient är överens om målen med behandlingen; att till varje pris ha total smärtfrihet som det absoluta målet för en opioidbehandling kan leda till icke-ändamålsenlig doseskalering och kan därmed vara riskfyllt.
Om behandlingen inte har avsedd effekt ska den trappas ut, helst inom 3 månader [14].
Om bedömningen är att behandlingen ska fortsätta, behöver den följas upp med jämna intervall som exempelvis var tredje till var sjätte månad [14]. Problematiskt bruk måste tas om hand på ett professionellt sätt genom att ta reda på orsaken, stabilisera och eventuellt trappa ut behandlingen samt ta ställning till om beroendemedicinsk expertis behöver kopplas in [11].
Man ska komma ihåg att den som påbörjar en opioidförskrivning är skyldig att följa upp den tills ansvaret tagits över av annan förskrivare [14].
Diskussion
Frågan om opioidernas plats och användning i sjukvården är ett exempel på att medicinhistoriska kunskaper kan vara viktiga för patientsäkerheten. Det har hävdats att cirka 10 procent av befolkningen i USA var opioidberoende i slutet på 1800-talet [24]. Även i en svensk kontext finns intressanta observationer från den tiden. I Henrik Bergs »Läkarebok« från 1919 kan man läsa [25]:
»Genom att vänja sig vid att begagna morfin för att stilla smärtor kan en människa mycket lätt bliva en slav under medlet d.v.s. bli morfinist. Oerhörda doser kunna förbrukas. … Det var Wood som 1853 införde insprutning av morfin under huden. Sedan dess har den förfärliga sjukdomen blivit mycket allmän.«
Mot denna bakgrund är den opioidrädsla som präglat mycket av 1900-talets sjukvård begriplig, även om den också är problematisk. En avgörande milstolpe för en rationell användning av opioider var publikationen av WHO:s analgetikatrappa i tre steg år 1986, med »starka opioider« som det avgörande tredje steget för en effektiv behandling av cancersmärta [26]. Analgetikatrappan kan ses som ett uttryck för en nödvändig liberalisering och ett avståndstagande från skadlig opioidrädsla.
Den nutida amerikanska opioidepidemin är ett mångbottnat fenomen där både läkar-, patient- och samhällsrelaterade faktorer har angivits som möjliga delförklaringar [27]. Men hade man kommit ihåg »morfinismens« härjningar för ett drygt sekel sedan, hade det kanske inte varit lika lätt att under kort tid dramatiskt ändra förskrivningspraxis i opiocentrisk riktning, med en fyrdubbling av opioidförskrivningen under 00-talet [27].
Opioider har fortsatt en viktig plats i dagens sjukvård, till exempel vid akuta smärttillstånd efter trauma/kirurgi, svår artrossmärta, cancersmärta eller palliativa situationer. Det är däremot i allmänhet olämpligt att behandla långvariga nociplastiska smärttillstånd som exempelvis fibromyalgi eller »ospecifik« ryggvärk med opioider; för dessa tillstånd är multimodal smärtrehabilitering att föredra [28]. Det är viktigt att undvika stereotyp förskrivning och således undvika både opioidrädslans och den oreflekterade opiocentrismens diken. En central färdighet i det avseendet torde vara att kunna utföra en smärtanalys, till vilken man också måste lägga till en individualiserad analys av risk och nytta med opioider samt kunskap om alternativa behandlingsmöjligheter. Det finns ofta andra, och inte sällan mer lämpliga, behandlingsmodaliteter än enbart opioider.
Opioider är narkotikaklassade läkemedel. Ibland behöver vi som är verksamma i sjukvården påminna varandra om det, och ibland också patienterna. Klinisk erfarenhet talar entydigt för att problematisk förskrivning av opioider förekommer, inte minst vid långvarig icke-cancerrelaterad smärta. Även om skiftet till mer oxikodon (Tabell 1) kan vara beroendemedicinskt bekymmersamt, tyder dock inget på att Sveriges läkarkår de senaste åren har blivit mer opiocentrisk i största allmänhet, snarare tvärtom (med tanke på minskningen av årsprevalensen med 17 procent under perioden 2015–2020). Man kan fråga sig om vi inte på sikt, om trenden fortsätter, riskerar att hamna i det andra diket – det vill säga i en skadlig opioidrädsla?
Vad som är »rätt nivå« gällande årsprevalensen för opioidbehandling går naturligtvis inte att säga med säkerhet. Förmågan att utföra en grundlig smärtanalys, parad med förmågan till en individualiserad analys av risk och nytta, kan kanske ses som en antidot mot både opioidrädsla och opiocentrism.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Viktiga biverkningar av opioidbehandling [11].
- Opioidinducerad tarmdysfunktion (»förstoppning«) inklusive illamående
- Beroende och substansbrukssyndrom
- Andningsdepression
- Sedation och kognitiv dysfunktion
- Endokrin dysfunktion, inte minst hypogonadism
- Klåda
- Urinretention
- Muntorrhet
- Opioidinducerad hyperalgesi
- Serotonergt syndrom
Fakta 2. Riskfaktorer för beroendeutveckling och opioidbrukssyndrom, återgivet från Läkemedelsverkets rekommendationer [14].
Låg risk
- Ålder >45 år
- Ingen anamnes eller hereditet för beroende
- Ingen psykisk samsjuklighet
- Stabil social situation
Medelhög risk
- Ålder <45 år
- Tidigare behandlad depression
- Hereditet för beroendesjukdom
- Tidigare beroendesjukdom
Hög risk
- Äldre tonåringar/unga vuxna
- Pågående beroendesjukdom
- Instabil och otillräckligt behandlad psykisk sjukdom
- Obehandlat neuropsykiatriskt tillstånd
- Instabil och antisocial personlighetsstörning
- Utsatt psykosocial situation
(uppdaterad 2022-05-02)