Graviditets- och födelsefrekvenser inom IVF fortsätter att öka, mycket på grund av förbättrade odlingsförhållanden och frystekniker (vitrifiering) för embryon.
Implementering av återförande av endast ett embryo i taget har kraftigt minskat flerbördsfrekvensen utan att påverka födelsefrekvensen negativt.
Odling och selektion av embryon har underlättats av så kallad time-lapse-teknik, där embryon odlas i ett slutet system med kameradokumentation.
Preimplantatorisk genetisk testning (PGT) av embryobiopsier utförs för att identifiera kända ärftliga sjukdomar och screena för aneuploidi. Det senare är dock inte tillåtet i Sverige.
Assisterad befruktning är ett område som efter 40 år fortsätter att utvecklas snabbt, framför allt på den laborativa och tekniska sidan. Hanteringen av gameter och embryon i laboratoriet kan vara avgörande för en framgångsrik behandling. Mycket fokus och stora resurser läggs även på att försöka utveckla objektiva och stabila metoder för att identifiera embryon med högst potential för graviditet och födsel.
I denna artikel diskuteras några av de förändringar som har haft mest inflytande på behandling med assisterad befruktning under de senaste åren.
Ett-embryoåterföring
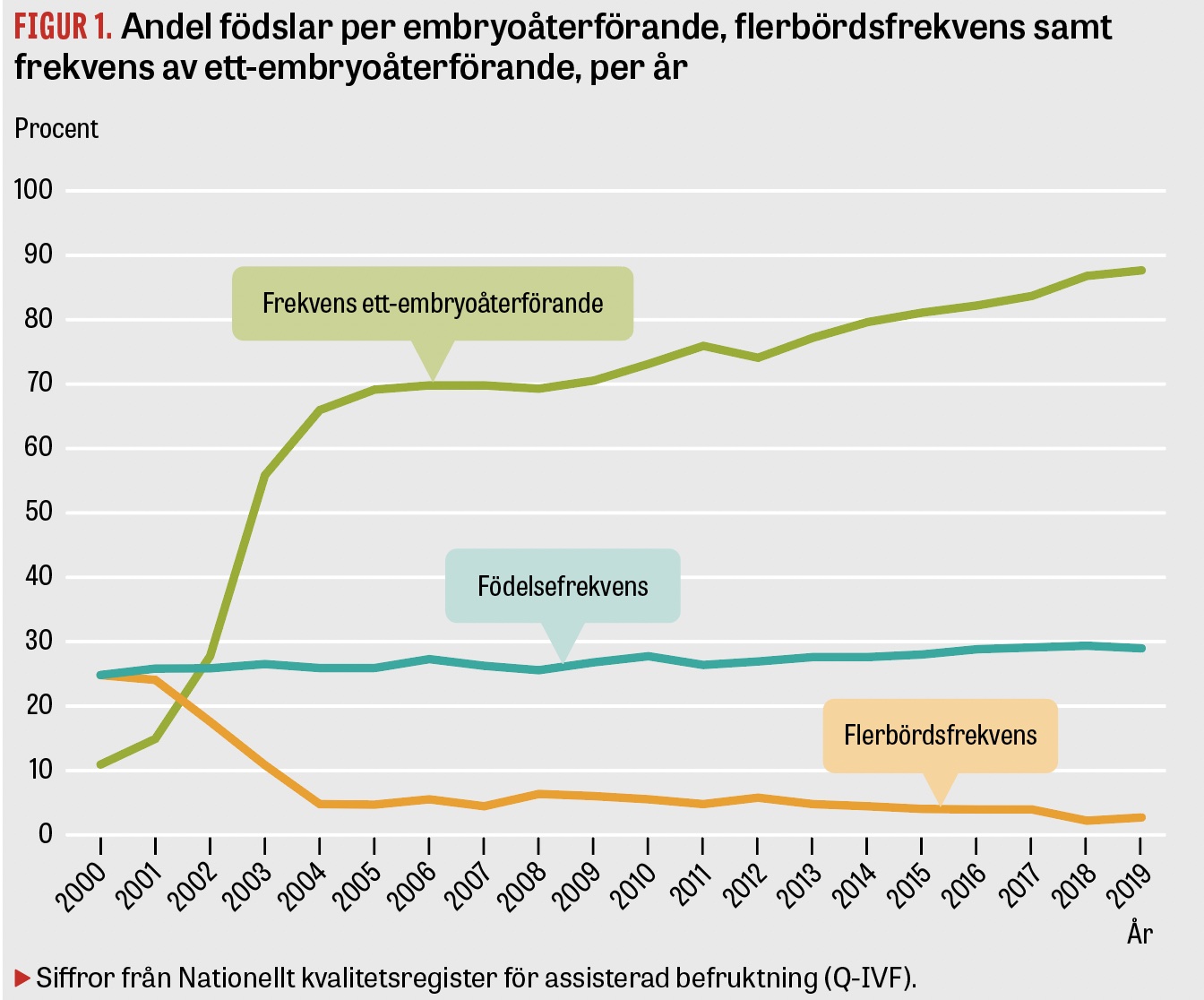
Vid IVF (in vitro-fertilisering) återfördes tidigare flera embryon samtidigt med avsikt att öka lyckandefrekvensen. När denna ökade så ökade även frekvensen av flerbördsgraviditeter och därmed riskerna för barnen. Som högst låg flerbördsfrekvensen på över 30 procent i Sverige. I slutet av 90-talet publicerades stora svenska registerstudier som tydligt visade riskerna för IVF-barnen, främst kopplade till den höga flerbördsfrekvensen. En stor nordisk randomiserad studie från 2004 visade att födelsefrekvensen inte skiljde sig nämnvärt vid återförande av ett embryo vid två tillfällen (ett färskt och ett fryst) jämfört med två embryon vid ett tillfälle. Samtidigt sjönk flerbördsfrekvensen dramatiskt [1]. Resultaten från denna studie blev på flera sätt en vändpunkt i Sverige och så småningom i världen, och policyn att återföra ett embryo i taget är nu på väg att bli internationell standard.
Redan 2003 införde Socialstyrelsen rekommendationen att bara återföra ett embryo i taget. Sverige har varit världsledande i att införa ett-embryoåterföring på bred front, och det sker i dag i cirka 90 procent av alla färska cykler och närmare 100 procent av alla frysåterföranden [2]. Flerbördsfrekvensen har samtidigt under de senaste 15 åren minskat från runt 25 procent till 2‒3 procent, vilket är bland de lägsta i världen. Man har också noterat en nedgång i andelen prematurbörd och barn med låg födelsevikt samt barn med allvarlig sjuklighet såsom cerebral pares (CP), där ingen signifikant skillnad i frekvens nu längre kan observeras [3, 4]. Flera länder har dock fortfarande flerbördsfrekvenser på över 25 procent.
Risken för att resultaten skulle försämras när man återförde endast ett embryo har inte besannats. Tvärtom har födelsefrekvenserna efter IVF i Sverige ökat genom åren, från 26 till 29 procent för de färska cyklerna och från 20 till 35 procent för frysåterföranden under en 10-årsperiod (Figur 1).
Förlängd odling till blastocyst
Det har länge diskuterats om återförande av embryo(n) efter en IVF-behandling bör ske 2‒3 dagar efter befruktning (i 4- respektive 8-cellsstadiet) eller dag 5 (i blastocyststadiet). Under många år dominerade tidigt återförande, där embryon med högst morfologisk kvalitet återfördes eller frystes efter 2‒3 dagar och övriga embryon destruerades. Under de senaste 10‒15 åren har framför allt mer fysiologiskt anpassade odlingsmedier möjliggjort en övergång till förlängd odling, med återförande dag 5. Det finns en generell tanke att odling till blastocyststadiet selekterar fram de mest viabla embryona, som dessutom har en bättre synkronicitet med endometriet [5]. Det kan å andra sidan vara så att odlingsförhållanden i laboratoriet inte är optimala och att vissa embryon som inte når blastocyststadiet kunde ha överlevt och gett upphov till graviditet om de återförts tidigare.
Många kliniker, inte minst i Sverige, tillämpar en flexibel inställning till antal odlingsdagar, där man bestämmer dag för återförande baserat på antal erhållna ägg, antal befruktade ägg och/eller antal embryon av god kvalitet dag 2‒3. Under 2019 utfördes i Sverige 35 procent av alla färska och 95 procent av alla frysta embryoåterföranden i blastocyststadiet. Detta kan jämföras med 2007, då dessa siffror var 5 respektive 6 procent [2, 6].
En stor förbättring i dag är att, även om återförande sker dag 2‒3, inga normalt befruktade embryon destrueras i detta stadium, utan alla extra embryon, oavsett kvalitet, odlas vidare till dag 5‒6. Man har funnit att ca 25 procent av embryon som bedömdes ha nedsatt morfologisk kvalitet i tidig utveckling ändå utvecklas till blastocyster av hög kvalitet och att dessa har likvärdig potential att resultera i graviditet och födsel som de av god morfologisk kvalitet dag 2‒3 [7-8]. Varje extra blastocyst är en chans till ett barn, och dessa embryon innebär således att fler patienter har möjlighet att uppnå en födsel.
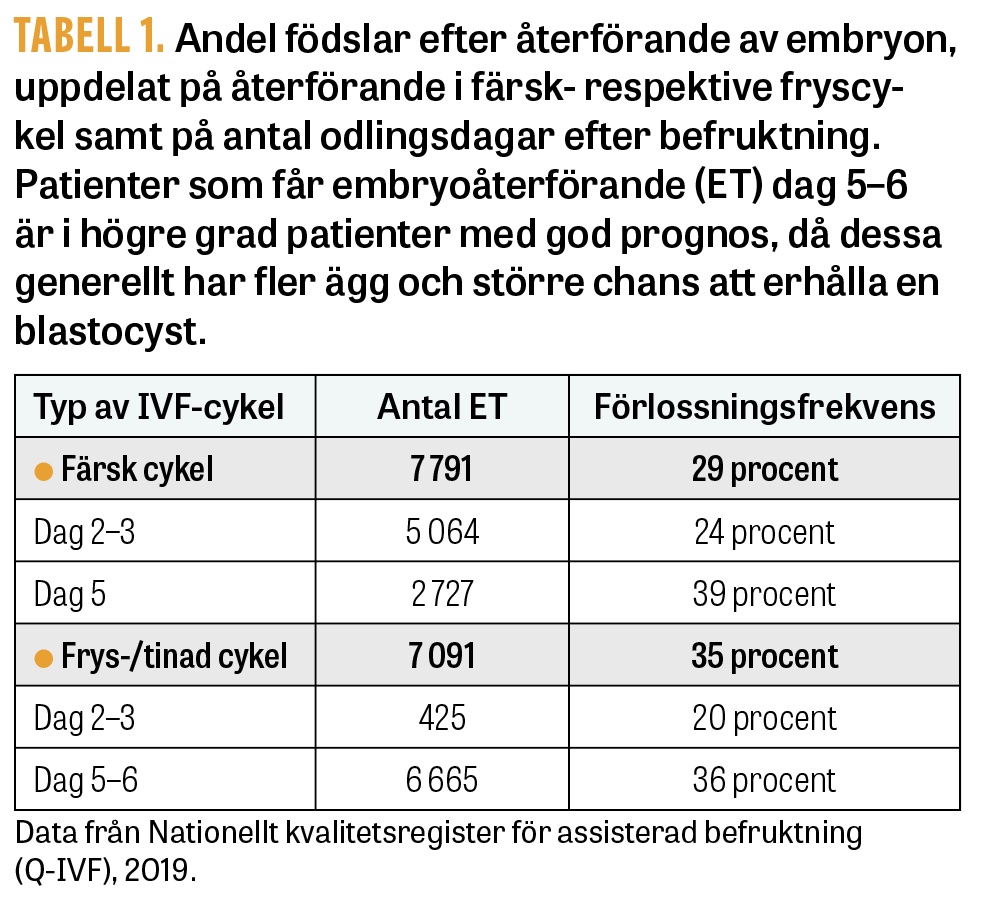
I Nationellt kvalitetsregister för assisterad befruktning (Q-IVF) kan man se att andelen födslar efter blastocyståterförande är betydligt högre än efter återförande av ett tidigt delat embryo (Tabell 1) [2]. Resultaten är dock baserade på ett urval av patienter, då de med god prognos har en större chans att erhålla blastocyster. Man vet inte i dag om en övergång till blastocyster för samtliga patienter i både färsk- och fryscykel skulle vara en fördel, då inga sådana studier av hög kvalitet har publicerats och de är svåra att genomföra.
Trots att likvärdiga kumulativa resultat, det vill säga när man räknar födsel per ägguttag och inkluderar återförande i färsk hormoncykel samt alla frysåterföranden från just den cykeln, har presenterats kräver återförande dag 2‒3 i genomsnitt fler återföranden jämfört med blastocyståterförande innan födsel uppnås. Detta kan innebära längre tid till graviditet och födsel samt högre kostnader.
»Time-lapse«-fotografering och algoritmer
Odling av embryon med hjälp av »time-lapse«-fotografering (intervallfotografering) betyder att embryon odlas i ett slutet inkubatorsystem med kontinuerlig bilddokumentation [9]. Detta innebär att bilder i flera fokalplan tas ungefär var 15:e minut. Embryots utveckling och delningsmönster kan därmed följas i realtid och retrospektivt över tid. Logistiskt innebär detta att embryologen kan bedöma embryot när som helst via en datorskärm i stället för att behöva ta ut odlingsskålen ur inkubatorn vid en exakt tidpunkt 1‒2 gånger per dag. Det underlättar arbetsflödet och innebär också att embryon odlas under mer stabila förhållanden, vilket är extra viktigt när de i större utsträckning odlas under längre tid.
Introduktionen av kontinuerlig bilddokumentation möjliggör även nya sätt att analysera embryoutveckling. Förutom att bedöma ett embryos morfologi utifrån en stillbild kan man nu även studera detaljerade tidsaspekter, så kallade morfokinetiska variabler. Dessa kan till exempel vara tidslängd mellan celldelningar, från insemination till uppkomst av cellkärnor, eller blastocystutveckling [10]. Förutom att kunna observera och bedöma embryon kontinuerligt utan att störa odlingsmiljön kan bilddokumentationen användas för spårbarhet, träning och validering. Tekniken kan också öka vår kunskap om hur morfokinetiska variabler och embryots utveckling i detalj korrelerar med exempelvis olika typer av odlingsförhållanden, varianter av odlingsmedier, genetiska avvikelser i embryot och patientpopulationer.
Man har dock inte kunnat visa att embryon som odlats med denna teknik ger förbättrade graviditets- eller födelsefrekvenser, eller att bildsekvenser är bättre än embryologens manuella bedömning på att selektera embryon med högst graviditetspotential. En metaanalys från 2019 inkluderande 6 RCT-studier (n=2 057 patienter) fann visserligen en signifikant högre födelsefrekvens i gruppen där embryon selekterats med time-lapse-teknik, men baserat på bara 2 studier och 932 återföranden [11]. Författarna påpekar att resultaten måste utvärderas försiktigt på grund av hög risk för bias ‒ i den största av dessa studier hade en del av patienterna möjlighet att välja grupp trots att studien rubricerats som randomiserad. Inga skillnader i klinisk eller pågående graviditet noterades, baserat på fler studier.
En framtida utveckling av tekniken kan vara att använda sig av så kallad maskininlärning, där ett datorprogram analyserar bilder som tagits av ett embryo under utvecklingen, vanligen vid runt 500 tidpunkter och i olika fokalplan, och tränas att hitta mönster som korrelerar med utfall såsom graviditet och/eller födsel. De studier som publicerats hittills indikerar att maskininlärning kan lära sig att hitta »rätt« embryo i samma grad som en embryolog, men inte bättre [12-14]. Systemen skulle därmed kunna utgöra ett kompletterande och objektivt stöd i samband med embryoselektion och eventuellt i framtiden ett likvärdigt alternativ med arbetstidsbesparing som vinst.
Sammantaget visar data i nuläget att time-lapse-tekniken ger likvärdiga resultat som konventionell teknik, men inte förbättrar embryokvaliteten, embryoselektionen eller graviditets- och födelsefrekvensen. Tekniken har dock ett flertal logistiska och kvalitativa fördelar, och det kan finnas en framtida potential för utveckling avseende mer precisa och stabila algoritmer baserade på till exempel maskininlärning.
Vitrifiering
Vitrifiering är en nyare frysteknik som revolutionerat överlevnaden vid frysförvaring av framför allt blastocyster och obefruktade ägg. Tekniken innebär kort att en kombination av höga koncentrationer av kryoprotektant och ultrasnabb sänkning av temperaturen bildar en glasliknande substans i stället för is, vilket minimerar risken för kristallbildning som kan skada cellmembran och cellorganeller.
Vitrifiering av obefruktade ägg har medfört kraftigt förbättrade resultat, med överlevnad efter upptining på 80‒100 procent [15] och befruktnings- och graviditetsfrekvenser likvärdiga färska oocyter. Även för blastocyster har överlevnaden efter frysförvaring förbättrats påtagligt med vitriferingstekniken, från cirka 50‒60 procent till 90‒95 procent [16]. I Sverige ligger födelsefrekvensen per återförd vitrifierad blastocyst på 36 procent (Tabell 1) [2]. De utmärkta resultaten efter vitrifiering av blastocyster, med hög överlevnad efter upptining och hög födelsefrekvens, uppmuntrar återförandet av ett embryo i taget och minimerar därmed andelen flerbördsgraviditeter i länder som traditionellt annars haft en låg andel ett-embryoåterföranden.
Elektiv totalfrysning
Det har länge diskuterats om hormonstimuleringen som görs i samband med äggutplockning skulle kunna påverka endometriets receptivitet negativt och störa synkroniciteten med embryots utveckling [5]. De goda resultat som nu erhålls med frysförvaring efter vitrifiering avseende överlevnad, graviditet och födsel har lett till diskussioner och försök med metoden att undvika återförande i den färska cykeln och i stället vitrifiera samtliga embryon/blastocyster. Teoretiskt borde återförande i en naturlig eller milt stimulerad cykel, med ett embryo som är i bättre fas med endometriet, leda till högre lyckandefrekvens. De randomiserade studier där man jämfört födelsefrekvensen efter återförande av färskt och fryst embryo har visat högre födelsefrekvens hos anovulatoriska patienter efter frysåterförande. Hos ovulatoriska patienter, som utgör majoriteten av infertilitetspatienter, ser man dock ingen skillnad [17]. Sammantaget tyder aktuella resultat på att policyn med elektiv totalfrysning kan vara värdefull för vissa infertilitetsgrupper och vid risk för hormonell överstimulering. Det är dock viktigt att betänka att frysning av alla embryon förlänger tiden till att uppnå en graviditet, och även ett par månaders fördröjning kan upplevas jobbig av paret/patienten.
Preimplantatorisk genetisk testning (PGT)
Metoden att kliniskt diagnostisera genetiska avvikelser hos humana embryon rapporterades första gången i slutet av 80-talet. Tekniken utvecklades framför allt för att identifiera embryon som bär på en svår och specifik ärftlig avvikelse i syfte att ersätta fosterdiagnostik och undvika eventuell sen abort [18]. Tekniken innebär att enstaka celler från det tidiga embryot uthämtas och analyseras genetiskt och återförande sker med genetiskt friska embryon. Lyckandefrekvensen beror framför allt på kvinnans ålder samt (genetisk) indikation hos mannen eller kvinnan. Internationellt används tekniken i ökande grad för att screena embryon för aneuploidi och då endast återföra kromosomalt normala (euploida) embryon i syfte att förbättra chansen för graviditet och födsel.
Nuvarande metoder för PGT är invasiva och innebär att man suger ut en eller flera celler från embryot. Studier pågår i syfte att utveckla icke-invasiva metoder, där man framför allt hoppas att i stället kunna analysera det medium som embryot odlats i.
Biopsi av celler från embryot görs i 8-cellsstadiet (3 dagar efter befruktning) eller i blastocyststadiet (5‒6 dagar efter befruktning). Fördelen med en senare biopsi är att fler celler kan tas, vilket ger en säkrare analys. Nackdelen kan vara att inget av patientens embryon utvecklas till blastocyststadiet. Det som tidigare kallades för PGD (preimplantatorisk genetisk diagnostik) respektive PGS (preimplantatorisk genetisk screening) har i dag delats upp i tre olika metoder: PGT-SR (strukturella rearrangemang), PGT-M (monogena sjukdomar) och PGT-A (aneuploidi). Analysteknikerna har utvecklats kontinuerligt genom åren och baseras på olika amplifieringsbaserade metoder, såsom PCR (polymeraskedjereaktion), array och NGS (nya generationens sekvensering), alternativt FISH-metodik (fluorescent in situ-hybridisering) [19].
PGT-SR används för att testa embryon/celler för strukturella avvikelser som vanligen orsakas av translokationer eller inversioner. PGT-M används för genetisk analys av mutation i en enskild gen med en autosomalt dominant, autosomalt recessiv eller X-länkad överföring, till exempel Huntingtons sjukdom eller muskeldystrofi.
PGT-A används med avsikten att endast återföra embryon med korrekt antal kromosomer (euploida embryon). Teoretiskt sett borde detta resultera i en ökad graviditets- och födelsefrekvens, men trots att metoden har använts och utvecklats betydligt sedan 90-talet har flertalet randomiserade studier inte kunnat visa någon fördel. En systematisk översikt inkluderande 11 randomiserade studier visade ingen ökad födelsefrekvens, även om en signifikant minskad missfallsfrekvens noterades för patienter vars embryon screenats för aneuploidi [20]. I Sverige är det endast tillåtet att genetiskt analysera embryon hos patienter med en ökad risk för en specifik ärftlig sjukdom, och genetisk screening av embryon utförs således inte.
Läs även
Författarintervjun med Kersti Lundin.
Potentiella bindningar eller jävsförhållanden: Kersti Lundin är huvudprövare för en studie om time-lapse-teknik sponsrad av Vitrolife AB.