Azoospermi förekommer hos ca 1 procent av den manliga befolkningen.
Vid icke-obstruktiv azoospermi (NOA) kan testikulär spermatogenes påvisas i ca 50 procent av fallen.
Om testikulära spermier kan påvisas finns möjlighet till biologiskt faderskap med hjälp av provrörsbefruktning och mikroinjektion av spermier (ICSI).
Barn födda efter ICSI med kirurgiskt uttagna testikulära spermier löper ingen större risk att drabbas av missbildningar, låg födelsevikt eller prematuritet jämfört med standard-IVF med ejakulerade spermier.
Val av testikulär operationsmetod kan påverka sannolikheten att finna spermier.
Kunskap om och rutiner för omhändertagande och behandling av män med NOA varierar i landet.
I dag finns det goda möjligheter att hjälpa infertila män att bli biologiska fäder, även i de mest svåra och komplicerade fallen. I början av 1990-talet introducerades i Bryssel intracytoplasmatisk spermieinjektion (ICSI), vilket ledde till en revolution inom behandling av manlig infertilitet [1]. Metoden innebär att spermier från antingen ejakulat, bitestiklar eller testiklar injiceras in i äggets cytoplasma, som via vaginal follikelaspiration plockats ut ur kvinnan efter hormonbehandling.
Azoospermi definieras som frånvaro av spermier i ejakulatet vid åtminstone 2 spermaprovsanalyser. Även dessa män kan bli hjälpta med ICSI-metoden, men då krävs att spermier kan utvinnas från antingen bitestiklar eller testiklar.
Hos ca 8 procent av ofruktsamma män påvisas azoospermi, och detta motsvarar ca 1 procent av den manliga befolkningen. Azoospermi indelas efter etiologin i tre grupper: pretestikulär, testikulär (icke-obstruktiv) och posttestikulär (obstruktiv). Vid pretestikulär azoospermi föreligger en hypogonadotrop hypogonadism på grund av nedsatt hormonproduktion från hypotalamus/hypofys. Hormonsubstitution är hos dessa män framgångsrik. Vid icke-obstruktiv azoospermi (NOA) föreligger en nedsatt eller helt utebliven spermieproduktion från testiklarna. Här föreligger i de flesta fall en hypergonadotrop hypogonadism, och enda sättet att påvisa spermier är via nålaspiration alternativt biopsier från testiklarna. NOA är den svåraste formen av azoospermi. Vid obstruktiv azoospermi (OA) föreligger någon typ av hinder i sädeslederna. Hormonprov i serum, såsom testosteron, follikelstimulerande hormon och luteiniserande hormon, är normala. Man förväntar sig i dessa fall en normal spermieproduktion, och spermier erhålls så gott som alltid från både testiklar och bitestiklar.
Nya tekniker för utvinning av spermier
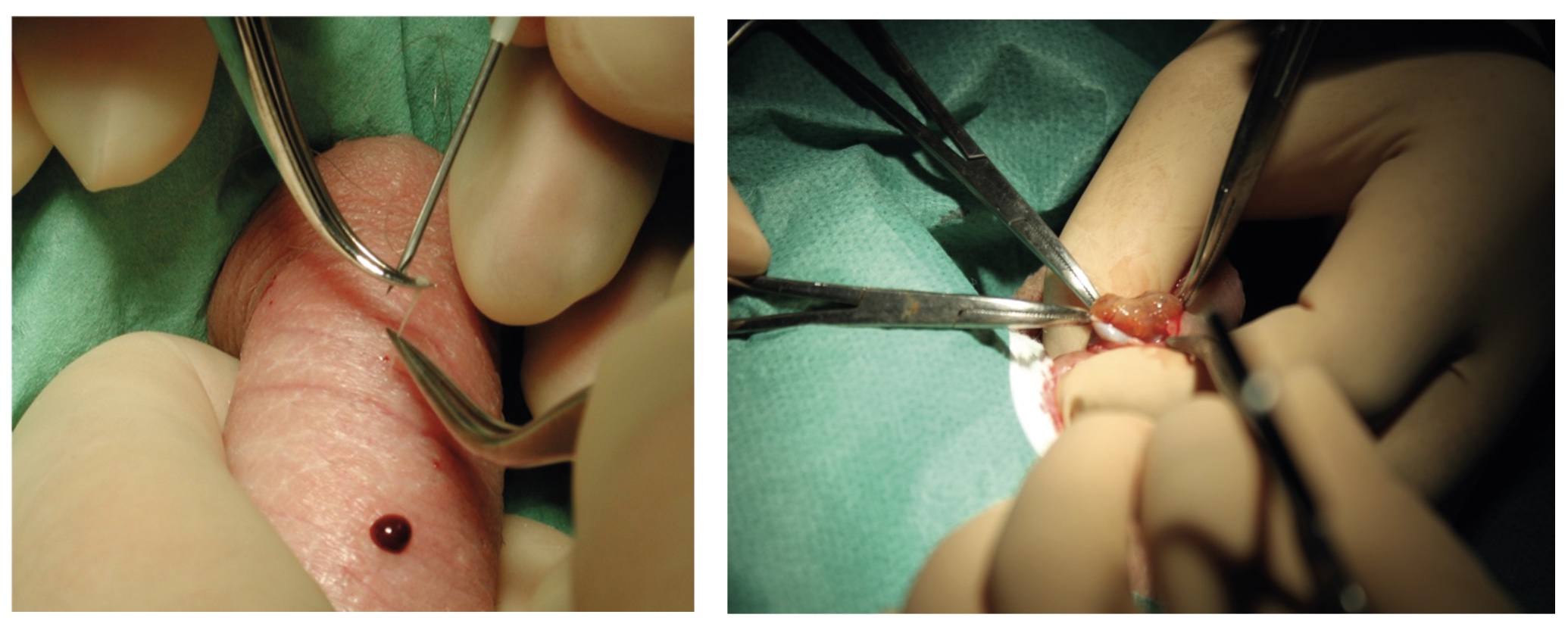
Någon form av kirurgisk intervention är alltid nödvändig för att utvinna spermier vid OA och NOA. Vid renodlad OA är spermatogenesen normal, varför det räcker med att antingen aspirera vätska från bitestiklar (perkutan epididymal spermieaspiration, PESA) alternativt vävnad från testiklar via nålaspiration/nålbiopsi (testikulär spermieaspiration, TESA, eller perkutana biopsier). Sannolikheten att finna spermier vid OA ligger kring 100 procent. Vid NOA är sannolikheten att finna spermier lägre och brukar variera mellan 25 och 60 procent beroende på orsak till mannens azoospermi och histologisk diagnos, men även spermieutvinningsmetod [2, 3].
Traditionella nålbiopsimetoder, såsom PESA, TESA och perkutana biopsier, har varit i bruk sedan början av 1990-talet. Metoderna är minimalt invasiva, enkla att utföra med lokalbedövning och kräver normalt ingen sjukskrivning postoperativt. PESA/TESA är förstahandsval vid OA, och även vid NOA bör TESA alternativt perkutana testikelbiopsier vara förstahandsval. Gemensamt för alla dessa metoder är att de är »blinda«.
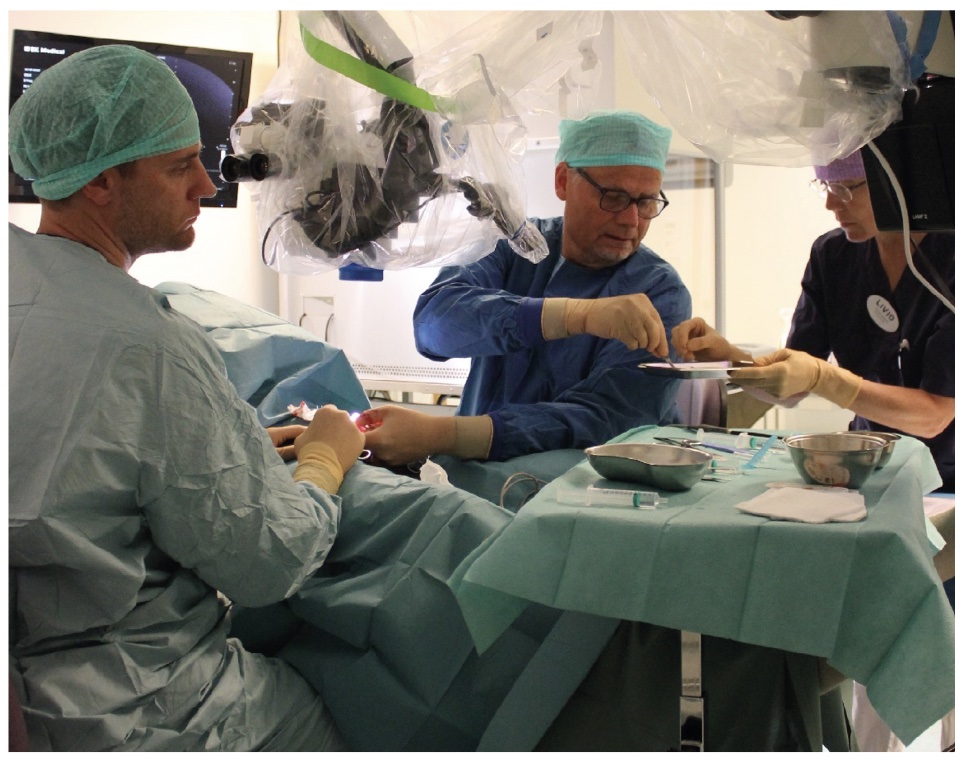
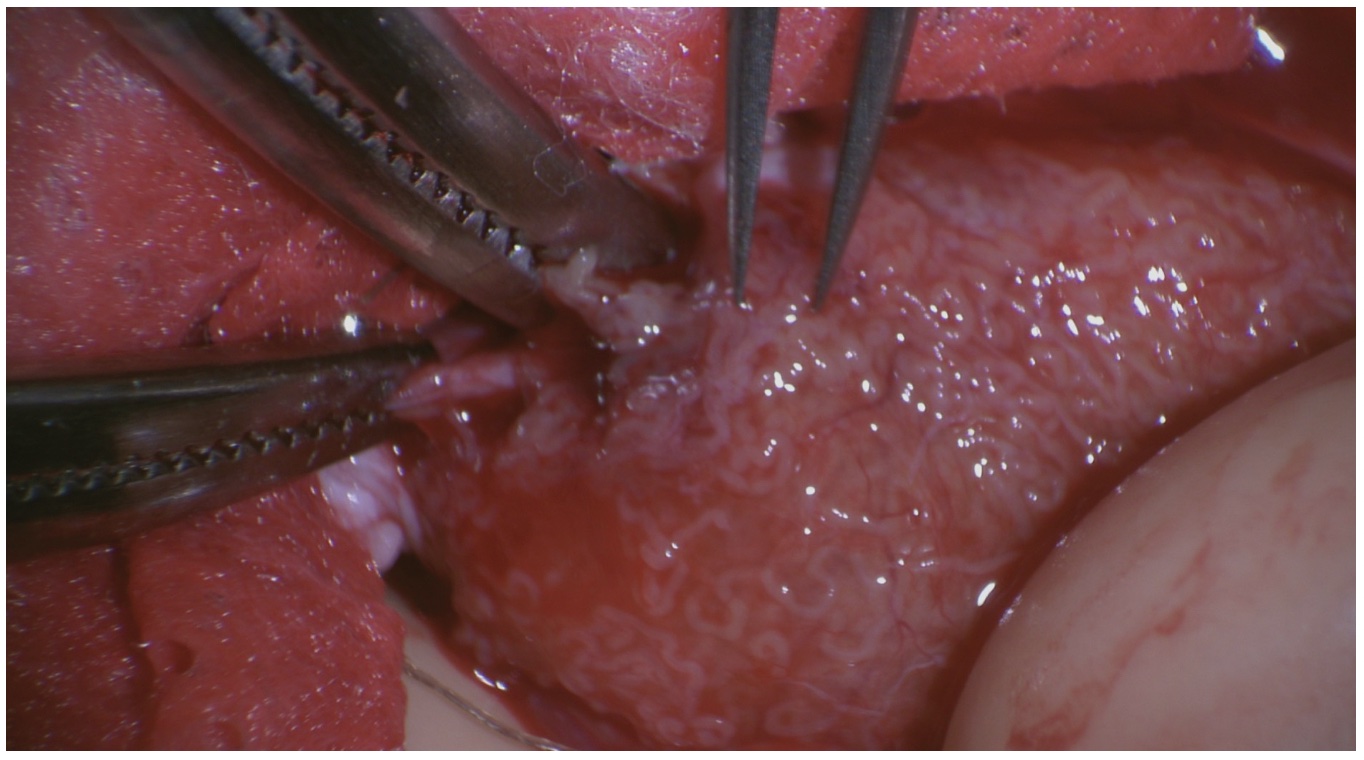
Sedan början av 2000-talet har en ny »icke-blind« spermieutvinningsmetod fått ökat gehör internationellt. Metoden benämns mikro-TESE och innebär att man öppnar och blottlägger större delen av testikelparenkymet [4, 5]. Med ett operationsmikroskop identifieras under 20‒25 gångers förstoring de tjockaste och mest vidgade sädeskanalerna (tubuli), vilka har störst sannolikhet att innehålla spermier. Med mikropincett tas ett flertal små riktade biopsier, som överlämnas till embryolog för vävnadspreparation och därefter tålmodigt letande efter funktionella spermier.
Kliniska rutiner för mikro-TESE
Den första och kanske mest vanliga rutinen är att man före behandling av kvinnan utför en diagnostisk mikro-TESE på mannen i kombination med infrysning av testikelvävnad i de fall spermier kan påvisas. Fördelen med denna rutin är att kvinnan i händelse av utebliven spermieförekomst inte behöver genomgå parallell hormonbehandling eller äggaspiration. I svåra NOA-fall kan dock utbytet av spermier vid mikro-TESE bli väldigt lågt trots flertalet riktade biopsier, och risk finns att inte hitta ett tillräckligt antal befruktningsdugliga spermier för ICSI efter frysning/upptining i efterföljande IVF-cykler.
Ett andra alternativ är att kryopreservera kvinnans obefruktade ägg före mikro-TESE. Ingreppet på mannen kan då planeras bättre, både för patienten och operationsteamet. Om spermier påvisas kan ägg tinas och mikroinjiceras med mannens färska testikulära spermier. Om inga spermier påvisas får äggen ligga kvar i frysen, och i stället kan planering för IVF med donatorspermier planeras om paret så önskar. Om kvinnans upptinade ägg används slipper hon genomgå ytterligare en hormonell behandling med äggaspiration.
Det tredje alternativet är att utföra en IVF-behandling på kvinnan parallellt med mikro-TESE på mannen. Det innebär att mikro-TESE utförs samma dag som äggaspirationen. Vid spermieförekomst kan färska spermier mikroinjiceras i färska ägg, och i händelse av utebliven spermieförekomst kan kvinnans ägg kryopreserveras samma dag för eventuell senare IVF-behandling med donerade spermier. Som vid alternativ två skulle inte en förnyad hormonstimulering med äggaspiration vara nödvändig för kvinnan.
Det finns fördelar och nackdelar med alla metoderna, och det är upp till varje klinik att utvärdera vilken rutin som passar dem bäst.
Behandlingsresultat efter IVF/ICSI
I Sverige utförs ca 12 000 IVF-behandlingar med färska egna ägg per år. Därtill kommer ca 7 500 fryscykler där upptinade embryon förs in i livmodern. Spermiekvaliteten avgör befruktningsmetod. I ungefär hälften av alla behandlingscykler utförs ICSI och i andra hälften standard-IVF, då äggen sammanförs med spermierna i en odlingsskål för befruktning. Resultaten av metoderna är jämförbara. Kvinnans ålder är vid all IVF-behandling den viktigaste faktorn för chansen att lyckas. Av alla behandlingscykler med färska embryon i Sverige leder ca 29 procent per embryoåterförande till förlossning. Motsvarande siffra för frysta/upptinade embryon är 35 procent. Detta ska dock inte tolkas som att återföringar av frysta/tinade embryon ger högre förlossningsfrekvens än färska embryon, utan det beror på att man i över 90 procent av fryscykler återför dag 5‒6-embryon, s k blastocystembryon, medan man i 70 procent av färska cykler använder dag 2‒3-embryon. Blastocystembryon har en högre chans till graviditet och förlossning, men samtidigt överlever endast en mindre del till dag 5‒6, vilket således ger färre återföringar [6].
Sannolikheten att få barn genom ICSI med kirurgiskt uttagna spermier från bitestiklar/testiklar är jämförbara med användning av ejakulerade spermier. Nationella kvalitetsregistret för assisterad befruktning (Q-IVF) rapporterade år 2019 förlossningar i 28 procent av fallen där ejakulerade spermier använts och i 36 procent av fallen där epididymala eller testikulära spermier använts.
Resultat vid mikro-TESE
I en svensk studie publicerad 2020 [5] där 159 män genomgått 171 mikro-TESE-ingrepp, fann man i 51 procent av fallen tillräckligt med spermier för ICSI vid det första ingreppet. I 77 procent av dessa skedde fertilisering och återförande av embryon, varav 35 procent resulterade i pågående klinisk graviditet. När även efterkommande behandlingscykler med upptinade mikro-TESE-spermier eller embryoåterföring av upptinade blastocyster inkluderades resulterade 21 procent av alla utförda mikro-TESE i pågående graviditet. Dessa resultat stämmer väl överens med en systematisk översikt från 2015, där 8 studier visade en variation mellan 43 och 63 procent i att finna spermier efter mikro-TESE hos män med NOA [3].
Klinefelters syndrom (47, XXY) är den vanligaste genetiska orsaken till NOA och drabbar 1:700–1:500 av pojkar. Med åldern utvecklas i de flesta fall en testikelatrofi ledande till NOA. Män med icke-mosaikisk form av Klinefelters syndrom har en varierande fenotyp, men i princip alltid små testiklar. Konventionell TESE- och mikro-TESE-teknik har förbättrat dessa mäns chanser att bli biologiska fäder. En systematisk översikt och metaanalys från 2017 inkluderande 37 studier visade en 40 procents sannolikhet att finna spermier för ICSI oberoende av ålder, testikelvolym eller hormonella nivåer [7]. Liknande resultat har publicerats i en svensk studie [5].
Ökade risker för barn födda efter ICSI?
En dansk nationell registerstudie, inkluderande över 90 000 födda barn, jämförde utfall för ICSI med epididymala eller testikulära spermier med utfall för ICSI med ejakulerade spermier, standard-IVF och spontan konception. Gruppen där spermier från bitestikel eller testikel använts för ICSI bestod av 466 barn. Ingen skillnad i kongenitala missbildningar eller neonatala utfall, såsom födelsevikt eller prematuritet, noterades för dessa barn i jämförelse med de övriga grupperna [8]. En intressant iakttagelse var att könsfördelningen skiljde sig något mellan de olika metoderna. Fler flickor föddes efter ICSI, såväl med kirurgiskt utvunna som ejakulerade spermier, jämfört med standard-IVF. Flera studier har noterat likartade risker för missbildningar och neonatala utfall mellan ICSI med ejakulerade respektive kirurgiskt uthämtade spermier [9, 10].
Kunskap om möjlighet till hjälp
Kunskapsläget och möjligheterna att få hjälp i landet varierar. Det är viktigt att kunskapen om dessa mäns behandlingsmöjligheter sprids även utanför de specialiserade IVF-klinikerna. Risken är annars att paren för tidigt remitteras till spermiedonation utan att man utrett möjligheterna för mannen att få ett biologiskt barn.
Besvikelsen är stor för de flesta par om man trots dessa nya tekniker inte lyckas påvisa förekomst av funktionsdugliga spermier. Konsekvensen blir då att framtida biologiskt faderskap omöjliggörs. Vår erfarenhet säger att männen sällan brukar ångra att man genomgått utredning och operation. Vetskapen att man försökt tillgängliga metoder för att påvisa egna spermier gör att man lättare kan gå vidare med till exempel spermiedonation eller adoption, alternativt att leva utan barn.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.