Allt fler vaskulära tillstånd upptäcks incidentellt i takt med att radiologisk avbildning av hjärnan blir vanligare. Behandlingsrisk måste då vägas mot den kumulativa risken av att lämna tillståndet obehandlat, vilket ofta är ett komplext ställningstagande.
Vid handläggning av akuta vaskulära neurokirurgiska tillstånd måste de insatser som behövs för att rädda patientens liv och förebygga sekundära skador samt komplikationer vägas samman med patientens förutsättningar för återhämtning.
Vaskulära sjukdomstillstånd som kan bli aktuella för neurokirurgisk åtgärd inkluderar cerebrala kavernösa missbildningar (CCM), arteriovenösa missbildningar (AVM), intrakraniella aneurysm, spontana intracerebrala hematom (ICH), durala arteriovenösa fistlar (AV-fistlar) och arteriell intrakraniell stenos (så kallad moyamoya-sjuka). Denna artikel behandlar de vanligaste av dessa.
När patienten insjuknar akut med en blödning vid något av ovan nämnda tillstånd krävs ofta skyndsam handläggning, ibland tillsammans med åtgärder med anledning av bakomliggande patologi. Vid elektiv handläggning föreligger ofta ytterligare svårigheter för riskvärdering och beslut om åtgärd mot det bakomliggande tillståndet. Allt fler vaskulära tillstånd upptäcks incidentellt i takt med att radiologisk avbildning av hjärnan blir vanligare. Behandlingsrisk måste då vägas mot den kumulativa risken av att lämna tillståndet obehandlat, vilket ofta är ett komplext ställningstagande. I samråd med patienten görs bästa möjliga bedömning av den samlade riskbilden, vilket vägs samman med patientens önskemål och förhållningssätt. I praktiken handlar det om att patient och läkare tillsammans måste komma fram till om man vill ta risken för morbiditet och mortalitet här och nu eller om man föredrar att leva med den ofta låga, men långsiktiga risken för blödningskomplikation. När man bestämt sig för behandling uppstår därtill frågor om vilken modalitet man bör välja. Under de senaste decennierna har mindre invasiva behandlingsmöjligheter utvecklats, såsom endovaskulär behandling och stereotaktisk strålbehandling, vilket har lett till att traditionell öppen neurokirurgisk åtgärd används alltmer sällan vid vissa av dessa tillstånd.
Intracerebrala hematom (ICH)
Epidemiologi och patofysiologi. År 2019 insjuknade ca 2 700 personer i Sverige med en intracerebral blödning (ICH), vilket utgör 13 procent av alla strokeinsjuknanden [1]. ICH är den strokeform som har högst mortalitet och morbiditet: 12-månadersmortaliteten uppgår till >50 procent, och mindre än 40 procent återgår till ett självständigt liv [2].
Orsaken till ICH är i 80 procent av fallen antingen hypertensiv angiopati, som företrädesvis orsakar centrala blödningar, eller cerebral amyloid angiopati, som till större del orsakar lobära blödningar, och dessa kallas ofta »spontana« ICH. Återstående 20 procent beror på annan bakomliggande patologi, däribland vaskulära tillstånd såsom AVM, aneurysm, CCM, dural AV-fistel, venös trombos, tumör, vaskulit m m [3]. Utredning om bakomliggande orsak med DT-angiografi och/eller MRT kan vara indicerad hos en yngre patient med atypisk lokalisation av blödningen och utan påtagliga kliniska eller radiologiska tecken på hypertoni.
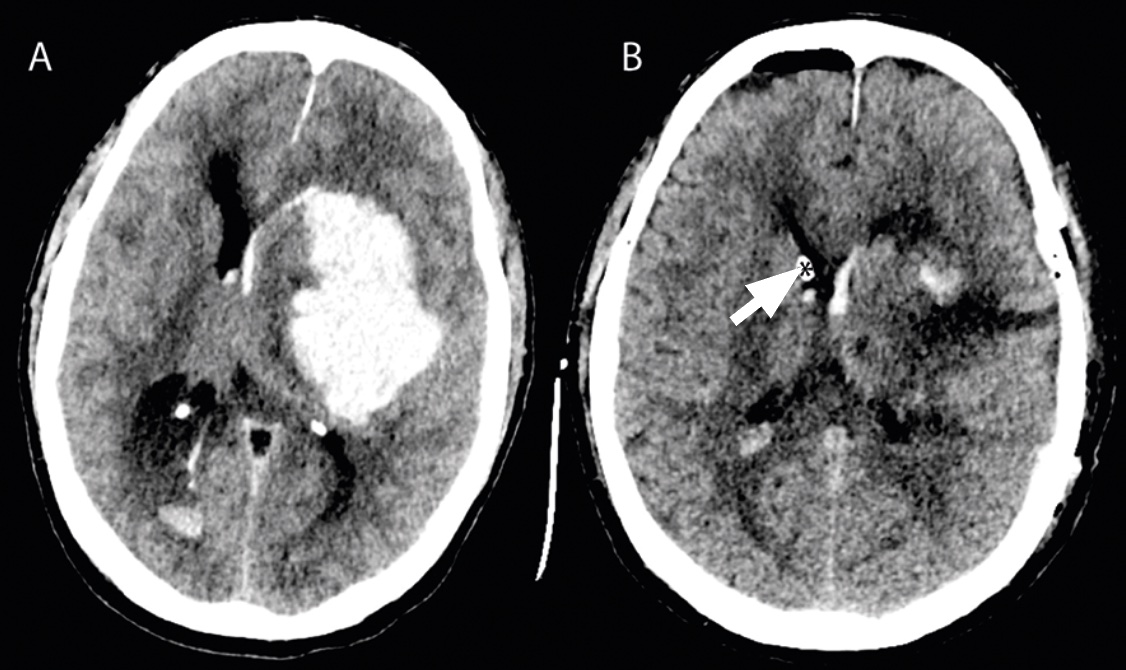
Akut behandling. Vid ett stort ICH kan det intrakraniella trycket stegras, vilket riskerar att försämra blodflödet även till övriga delar av hjärnan och i förlängningen leda till hjärnstamsinklämning. Utrymning av blödningen syftar till att förhindra detta och därmed rädda liv, men kan sällan återställa förlorad funktion. Endast en minoritet av patienterna i Sverige genomgår kirurgisk behandling, och det finns stora regionala skillnader över landet avseende kirurgiska indikationer [4], vilket speglar bristen på vetenskapligt stöd för beslut om kirurgi. Två stora randomiserade studier (STICH I och II) har inte kunnat visa någon klinisk fördel med tidig kirurgisk utrymning av hematom jämfört med enbart farmakologisk handläggning [5]. Nuvarande neurokirurgisk praxis är att utrymma hematom som har betydande masseffekt och hotar livet på patienter och då man tror att det finns en rimlig chans för återhämtning.
Cerebrala kavernösa missbildningar (CCM)
Epidemiologi och patofysiologi. Cerebrala kavernösa missbildningar, ibland även kallade kavernom eller kavernösa hemangiom, har en prevalens på 1,6‒5,0 procent, och årligen upptäcks ungefär 0,56 fall per 100 000 vuxna. Tillståndet kan ge symtom i form av epilepsi (50 procent), ICH (25 procent) och fokala neurologiska bortfall utan ICH (25 procent), men ofta är de asymtomatiska (upp till 50 procent) och incidentellt upptäckta. CCM finns i ärftlig form och kan uppstå spontant eller efter strålning. I en femtedel av fallen är CCM multipla.
Elektiv handläggning. Risken för blödning, som är den mest befarade komplikationen av CCM och det som avgör behandlingsstrategi, har uppskattats till 15,8 procent på 5 år för CCM som blött tidigare, men så låg som 0,08 procent för CCM som upptäckts incidentellt. Multipla CCM, lokalisation i hjärnstammen och tidigare blödning är riskfaktorer för upprepad blödning. Utredning av tillståndet består av kartläggning med MR inklusive susceptibilitetsviktad sekvens. Kirurgisk behandling rekommenderas inte för asymtomatiska CCM, men kan övervägas för CCM som tidigare blött eller ger epilepsi. Stereotaktisk strålbehandling kan övervägas vid solitära CCM i en lokalisation som innebär hög kirurgisk risk [6].
Arteriovenös missbildning (AVM)
Epidemiologi och patofysiologi. Incidensen av AVM i befolkningen anges vara ca 1/100 000 per år. Tillståndet kan orsaka blödningar eller epilepsi. Under de senaste decennierna, när radiologi av centrala nervsystemet har blivit vanligare på bredare indikationer, upptäcks en ökande andel AVM som inte har rupturerat eller orsakat symtom [7].
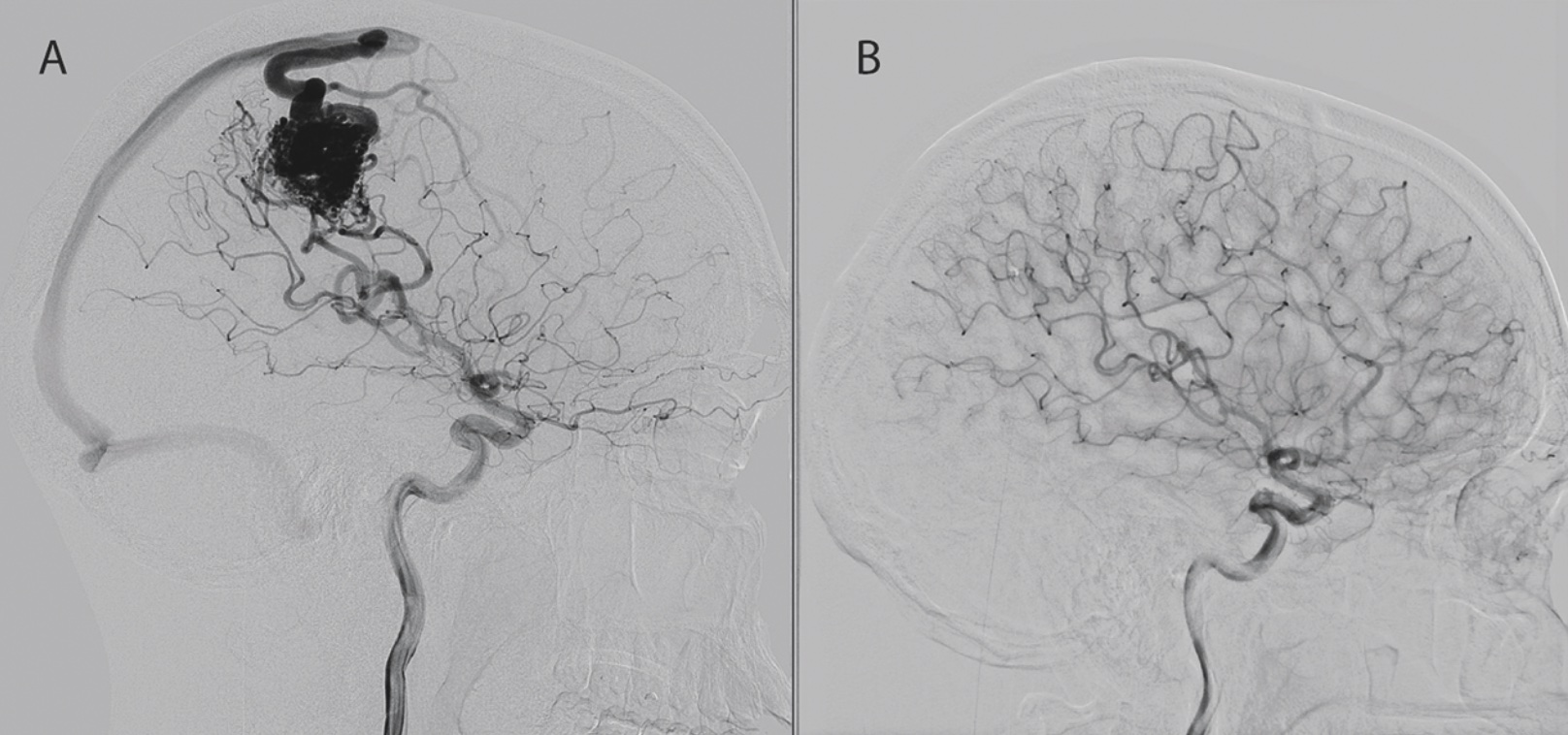
AVM består av ett patologiskt kärlnystan, nidus, där en sammankoppling av vener med artärer utan mellanliggande kapillärnätverk har skett vid embryonalutvecklingen. Följden blir högt flöde och tryck i nidus och dränerande vener, och detta kan leda till ruptur och parenkymblödning. Den årliga blödningsrisken hos AVM är ungefär 2‒4 procent, men beroende på kliniska och anatomiska faktorer kan den vara så låg som 1 procent eller så hög som 33 procent årligen [7]. AVM kan graderas utifrån den femgradiga Spetzler‒Martin-skalan, som utvecklades för att predicera risk för morbiditet och mortalitet vid mikrokirurgisk behandling. I graderingen väger man in storlek, närhet till känsliga områden och dränage till det djupa vensystemet, vilka alla ökar risken.
Akut handläggning. AVM ligger bakom ungefär 2 procent av akuta ICH-insjuknanden [3]. Om blödningen ger masseffekt kan den behöva utrymmas akut, och bakomliggande AVM kan då åtgärdas kirurgiskt, alternativt i kombination med endovaskulär behandling.
Elektiv handläggning. Behandlingsmodaliteterna vid AVM utgörs av kirurgisk exstirpation, endovaskulär embolisering eller stereotaktisk strålbehandling, eller en kombination av dessa. Enligt en stor metaanalys var risken för permanent neurologiskt deficit eller död 7 procent vid mikrokirurgisk exstirpation eller embolisering och 5 procent vid stereotaktisk strålbehandling, medan behandlingsresultatet (obliteration av AVM) var 96 procent vid kirurgi, 38 procent efter strålbehandling och 13 procent vid endast embolisering [8]. En värdering av behandlingsrisk jämfört med årlig risk för blödning samt val av behandlingsmodalitet måste göras i varje enskilt fall.
Den låga årliga blödningsrisken hos icke-rupturerade AVM har föranlett ett flertal studier för att utröna vad som är den bästa handläggningen i de fall där AVM inte har blött. I en randomiserad studie som fått stort genomslag (ARUBA) påvisades en betydligt högre risk för stroke eller död hos patienter som fick intervention jämfört med dem som endast behandlades farmakologiskt (12,3 procent jämfört med 3,4 procent per 100 patientår) under en uppföljningstid på 50 månader [9]. Studien har sedermera kritiserats, dels för selektionsbias och dels för att en låg andel (15,8 procent) av patienterna som fick intervention genomgick det som anses vara etablerad standardbehandling, det vill säga kirurgisk exstirpation. Därtill hade studien en kort uppföljningstid för ett tillstånd som innebär livslång blödningsrisk [10]. Sammanfattningsvis så behandlas icke-rupturerade AVM numera i hög grad konservativt, då behandlingsrisken är betydande.
Intrakraniella aneurysm
Epidemiologi och patofysiologi. Cerebrala arteriella aneurysm uppstår till följd av kärlsjukdom där en förtunning och degeneration sker i kärlväggen och en utbuktning uppstår. Denna utgör aneurysmsäcken, och dess vägg är ofta skör. Förekomsten av aneurysm i den vuxna populationen uppskattas till mellan 1 och 5 procent i angiografi- och obduktionsmaterial, men det är vanligare hos patienter med polycystisk njursjukdom, Marfans syndrom, Ehlers‒Danlos syndrom typ 4 och fibromuskulär dysplasi [11]. Den årliga blödningsrisken för ett aneurysm som inte tidigare blött brukar uppskattas till 1‒2 procent totalt [12], men kan vara upp till 10 gånger högre beroende på riskfaktorer, som aneurysmets storlek och lokalisation, patientens ålder, hypertoni samt rökning [13].
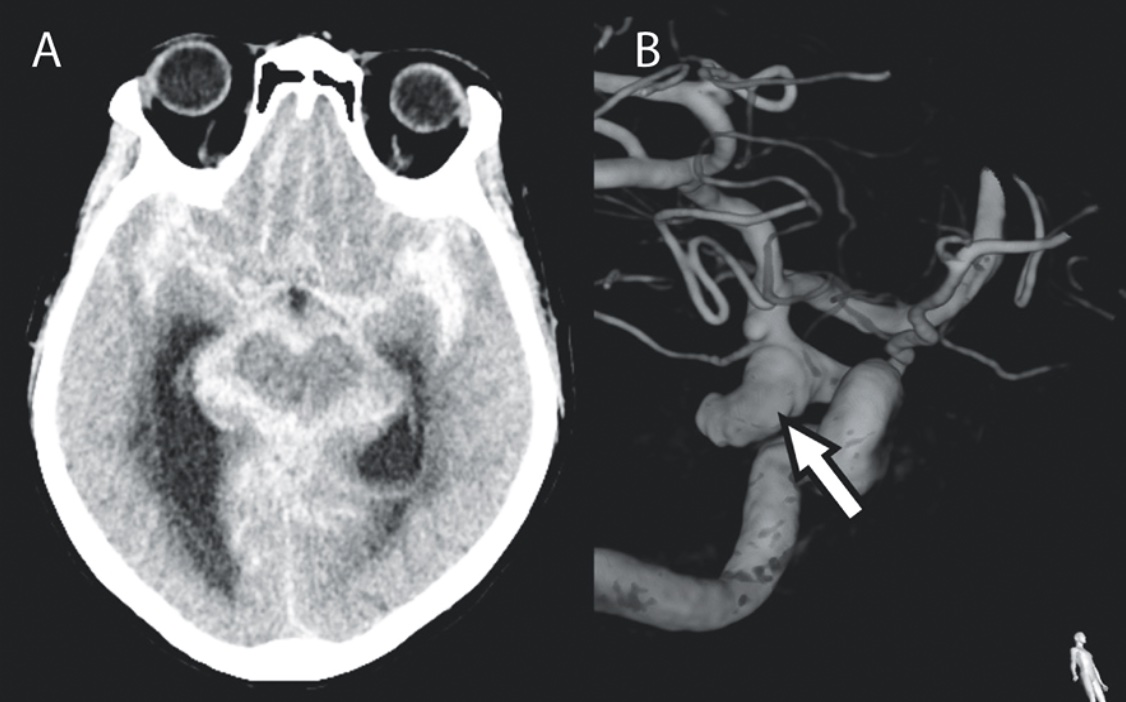
Plötslig ruptur av ett aneurysm orsakar en blödning ut i subaraknoidalrummet, s k subaraknoidalblödning, med en årlig incidens på 9,1 per 100 000 personer [14]. Insjuknandet debuterar ofta med kardinalsymtomet åskknallshuvudvärk, men även nackvärk, medvetandeförlust, kramper och neurologiska bortfallssymtom är vanliga. Subaraknoidalblödningar diagnostiseras med datortomografi, där sensitiviteten är hög om den utförs inom 6 timmar från symtomdebut, och bilderna bedöms av neuroradiolog [15]. Om datortomografin inte påvisar blod och det gått mer än 6 timmar sedan insjuknande bör utredningen kompletteras med lumbalpunktion och absorbansmätning av likvor. Det tar mer än 12 timmar från symtomdebut innan nedbrytningsprodukter av hemoglobin, främst bilirubin, kan upptäckas [16].
Ungefär 10 procent av dem som insjuknar råkar ut för en så allvarlig blödning att de inte kommer in till sjukhus utan avlider direkt [17]. Bland dem som når sjukhus är mortaliteten hög (27‒44 procent beroende på region i världen), även om den har reducerats kraftigt de senaste decennierna [18]. Risken för död eller svåra sekvele är tydligt kopplad till patientens kliniska tillstånd vid insjuknandet och varierar mellan 15 och 93 procent beroende på medvetandegrad vid ankomst till sjukhus [19]. Många drabbas av störningar i kognitiv funktion och uttalad trötthet som försvårar återgång i arbete och sänker livskvaliteten [20].
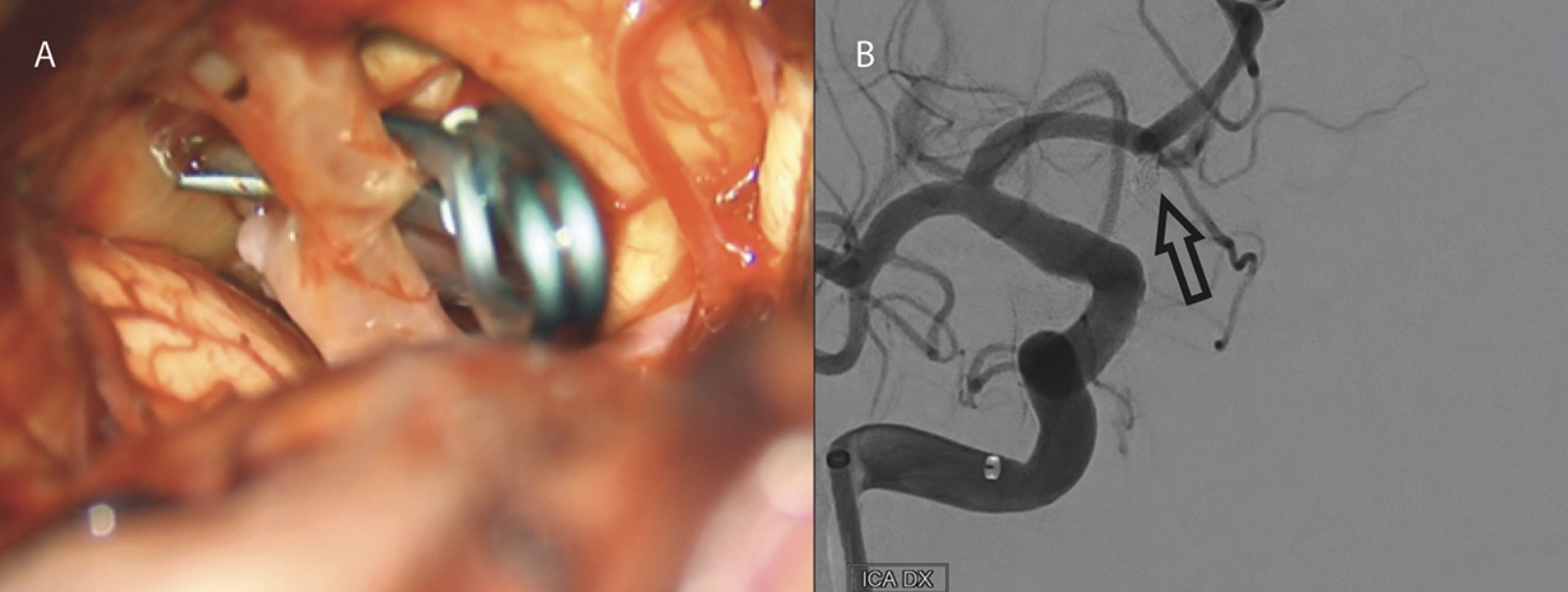
Behandling. Patienter med subaraknoidalblödning behöver neurointensivvård för att förebygga sekundära skador och komplikationer, som reblödning från aneurysmet, hydrocefalus och vasospasm. Behandling i form av öppen mikrokirurgisk clipsligatur eller endovaskulär coiling utförs så snart som möjligt för att undvika förnyad blödning. Avgörande för vilken metod som väljs är faktorer hos både patienten (bl a ålder, samsjuklighet och kliniskt status) och aneurysmet (bl a lokalisation, konfiguration av aneurysmsäck och -hals samt förekomst av hematom i parenkymet) [21]. Efter introduktionen av endovaskulär behandling har andelen som genomgår denna åtgärd ökat och utgör i dag en majoritet.
Neurointensivvården syftar till att monitorera, förebygga och behandla de nämnda komplikationerna hydrocefalus och vasospasm. Behandlingen syftar även till att förebygga epileptiska anfall, feber, hyper- och hypoglykemi, hypoventilation samt hjärnödem där förhöjt intrakraniellt tryck har lett till nedsatt perfusionstryck i hjärnparenkymet. Syftet är att etablera så normal fysiologi för hjärnan som möjligt. Hydrocefalus kan behöva behandlas med ventrikeldränage och i efterförloppet möjligen med en ventrikuloperitoneal shunt där man gör dränaget permanent från hjärnventrikel till fri bukhåla. Vasospasm drabbar hjärnans tillförande artärer och kan ge påföljande cerebral ischemi och infarkter. Patienter medicineras med kalciumflödeshämmaren nimodipin i förebyggande syfte. I de fall där symtomgivande vasospasm inte kan lösas med intensivvårdsåtgärder och nimodipin kan man ibland överväga intraarteriell injektion av nimodipin eller ballongangioplastik. Man har sett ett betydligt bättre kliniskt utfall för patienter med subaraknoidalblödningar de senaste decennierna, sannolikt till stor del beroende på förbättrad neurointensivvård [18].
Uppföljning, utfall och rehabilitering
Patienter drabbade av stroke som lett till neurologiskt deficit till följd av en vaskulär åkomma behöver ofta hjärnskaderehabilitering. Uppenbara grovmotoriska bortfall blir sannolikt oftare föremål för insatser än mer subtila förändringar, som uttröttbarhet, nedsatt koncentrationsförmåga, störd sömn och depression, det vill säga symtom som är problematiska i patientens vardag och sänker livskvaliteten påtagligt [20]. Ett gott samarbete mellan neurokirurgisk, neurologisk och rehabiliteringsmedicinsk kompetens behövs därför för patientens bästa.
Framtida funderingar
Det vore önskvärt med fler prospektiva studier för att förbättra evidensläget för behandlingsalternativen vid vaskulära tillstånd. Dock är det en speciell utmaning vid kirurgiska sjukdomar. Studier som inkluderar patienter baserat på kirurgisk obeslutsamhet, »surgical equipoise«, drabbas av selektionsbias eftersom alla patienter med en kirurg som tycker sig veta vad som är bäst, oavsett om det resulterar i kirurgi eller inte, kommer att exkluderas. Därmed blir resultaten ofta svåra att generalisera till hela populationen av patienter för vilka kirurgi övervägs.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.